松果菊苷对阿尔茨海默病转基因小鼠脑内氧化应激及β-淀粉样蛋白含量的影响
2021-10-25刘国力
李 旭 刘国力
中国医科大学附属第一医院(辽宁 沈阳 110000)
阿尔茨海默病(Alzheimer′s disease,AD),是一种与年龄相关,且以记忆障碍、失语、视空间机能损害及行为异常等为特征的神经退行性疾病。主要病理学特征为神经元内出现由过度磷酸化tau蛋白聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs)以及细胞外存在大量的以β淀粉样蛋白(amyloid-β protein,Aβ)沉积形成的老年斑(senile plaque,SP)[1-3]。
研究证实,氧化应激是AD发病的主要病因之一。研究发现,AD小鼠脑内过度的氧化应激反应能够导致膜脂质过氧化、突触功能受损、线粒体损伤等,最终引起神经变性死亡[4]。松果菊苷为苯乙醇苷类化合物,其药理作用主要有抗氧化作用和神经保护作用等[5-7]。研究表明,松果菊苷分子内含有多个酚羟基,能结合体内自由基,具有明显的清除自由基和抗脂过氧化作用[8]。然而,松果菊苷能否通过抑制氧化应激反应减少Aβ沉积数量进而缓解AD发病尚未见报道。本实验通过给予AD小鼠腹腔注射松果菊苷2个月后,采用Western blot的方法考察两组小鼠脑内SOD1的蛋白表达水平,检测ROS和SOD活性探讨松果菊苷对AD模型鼠脑内氧化应激的影响,同时,利用免疫荧光染色的实验方法检测两组小鼠脑内Aβ老年斑的含量变化,行为学实验考察松果菊苷能否通过抑制氧化应激反应而改善AD小鼠的学习记忆能力,最终缓解AD小鼠发病进程的作用。
1 材料与方法
1.1材料
1.1.1 药品和试剂盒 松果菊苷(中国成都瑞芬思生物科技有限公司);β-Amyloid Antibody,SOD1,β-actin,HRP-labeled goat anti-rabbit IgG(Cell Signaling Technology),Inc.Alexa Fluor 555-labeled goat anti-rabbit IgG、(Danvers,MA,USA);ROS和SOD试剂盒(上海碧云天生物技术有限公司)、PVDF膜,蛋白Marker(Thermo)。
1.1.2 实验仪器 Morris水迷宫(江苏淮北正华,中国),冰冻切片机,BIO-RAD凝胶图像分析系统,Tanon2500电泳凝胶分析仪,荧光共聚焦显微镜,电泳仪,水平摇床,低温离心机,酶标仪等。
1.1.3 实验动物与分组 5月龄APP/PS1转基因小鼠购于美国Jackson Lab(Stock Number 008169),体重约25克,每笼约3~4只,昼夜交替饲养,饲养室温度保持在22~25℃左右。具体分组及给药方式如下:AD模型组:5月龄的APP/PS1转基因小鼠10只,每日腹腔注射0.9%NaCl;松果菊苷治疗组:5月龄的APP/PS1转基因小鼠10只,每日给予20mg/kg/d松果菊苷腹腔注射,连续给药2个月。
1.2方法
1.2.1 Morris水迷宫 Morris水迷宫实验是评价AD模型鼠学习记忆和认知障碍最常用的研究手段,因此,本研究利用Morris水迷宫实验对APP/PS1转基因小鼠的行为表现进行评估。实验前,将水温加热至(25±2)℃。训练期为2天,每天三次,每次间隔30分钟,定位航行实验历时5天,每天3次,每次间隔30分钟。第8天进行空间探索实验,移走平台,记录小鼠穿越原来平台位置的次数,进行3次实验。
1.2.2 小鼠脑组织取材 各组小鼠进行深度麻醉后灌流处死,迅速取出大脑后,从中间矢状缝切开,大脑左半球放入4%多聚甲醛中固定,用于制备冰冻切片进行免疫荧光染色;另一侧放入-80℃保存备用,用于分子生物学等常规指标检测。
1.2.3 Western blot检测 各组小鼠皮层组织分别称重,按1∶5比例加入蛋白裂解液后进行超声粉碎,4℃裂解3个小时,4℃12000rpm低温离心15分钟,吸取上清,BCA蛋白浓度测定。
10%~15% SDS聚丙烯酰胺凝胶电泳分离胶,80V恒压低温电转2小时,取出膜后用5%脱脂奶粉封闭,一抗4℃孵育过夜,二抗室温孵育1h,ECL发光,显影。以β-actin作为上样量参照标准,用Image-pro Plus 6.0软件包分析。
1.2.4 免疫荧光染色 冰冻切片血清封闭液封闭1.5小时,一抗4℃孵育过夜。切片经PBS充分漂洗后,用荧光二抗室温孵育2小时,经PBS漂洗后,DAPI核染色,PBS漂洗后,防荧光淬灭剂(碧云天)封片,共聚焦激光扫描显微镜下观察并采集图像和分析。
1.2.5 活性氧(ROS)测定 称取各组小鼠大脑皮层组织,溶于冷藏的PBS溶液中,4℃离心15分钟,吸取上清用于ROS测定。根据试剂盒说明,进行ROS检测,ROS水平以每微克蛋白的荧光强度表示。
1.2.6 超氧化物歧化酶(SOD)活性检测 将皮层称重,在冷藏的SOD样品制备液中均质。裂解液4℃,4000×g离心15min,吸取上清用于ROS测定。根据说明书通过紫外分光光度法测定SOD活性。
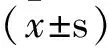
2 结果
(1)松果菊苷对AD模型鼠学习记忆能力影响
水迷宫实验结果显示,经过2d(3次/d)的训练,APP/PS1小鼠和松果菊苷处理的AD模型鼠在寻找可视平台的时间没有统计学差异(图1A),提示各组小鼠的运动能力和视力没有显著的差别。在隐蔽平台实验中,松果菊苷处理的AD鼠相比于AD模型鼠表现出较短的逃避潜伏期和逃脱距离(图1B),说明松果菊苷能够明显提高小鼠的学习能力。空间探索实验提示松果菊苷能够明显改善AD模型鼠的空间记忆损伤(图1C,D)。
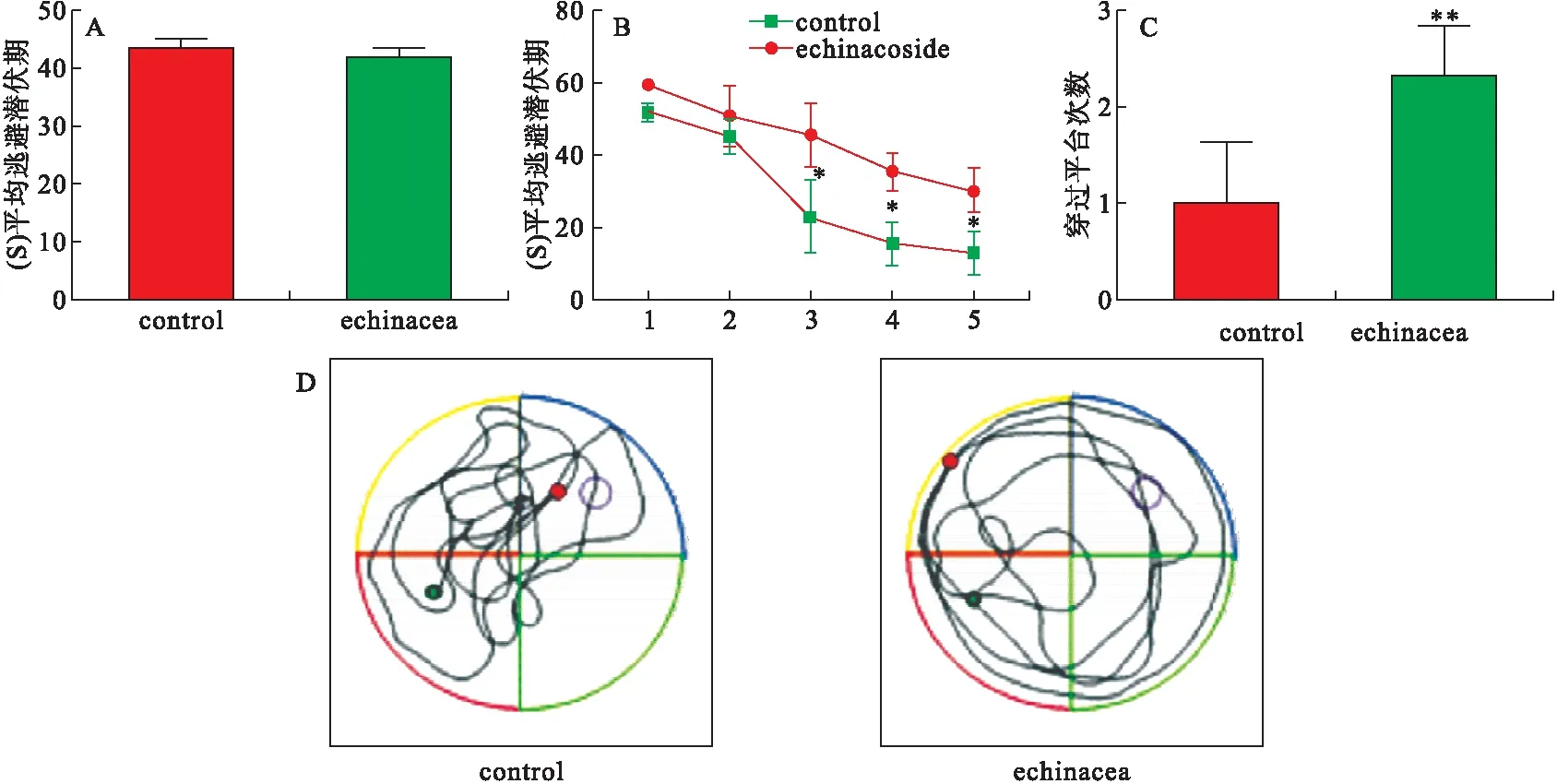
图1 松果菊苷对AD模型小鼠空间学习记忆能力的影响A.可视平台期内检测各组小鼠的平均逃避潜伏期;B.隐蔽平台实验检测各组小鼠的运动的平均路程;C.空间探索实验中,各组小鼠经过平台次数的比较;D.空间探索实验小鼠的运动轨迹。与AD模型鼠相比,*P<0.05,**P<0.01。
(2)松果菊苷对AD模型鼠皮层中Aβ沉积的影响
应用免疫荧光染色的方法检测两组小鼠大脑皮层区Aβ老年斑的沉积数量。结果说明,AD模型鼠的大脑皮层均出现大量Aβ阳性神经元胞体及阳性老年斑,与AD模型鼠相比,松果菊苷处理组小鼠大脑皮层的老年斑块数量明显减少,并且斑块体积缩小(图2)。以上结果说明松果菊苷能够通过减少Aβ沉积数量进而缓解AD模型鼠的学习记忆能力。

图2 皮层区各组小鼠Aβ老年斑沉积水平
(3)松果菊苷对AD模型小鼠脑内氧化应激的影响
研究结果显示,与APP/PS1转基因小鼠相比,松果菊苷处理后可明显促进SOD1蛋白表达,与此同时,松果菊苷可明显提高SOD活性。除此之外,松果菊苷能够明显降低ROS活性。以上结果显示,松果菊苷可明显抑制AD模型鼠脑内的氧化应激水平。
3 讨论
AD的主要病理特征是神经元内由过度磷酸化的Tau蛋白聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs)以及细胞外存在的大量的β-淀粉样蛋白(amyloid-β,Aβ)聚集形成的老年斑[1-3]。研究表明,Aβ形成过程中会产生大量活性氧(Reactive oxygen species,ROS),而ROS积累过多会产生氧化应激,氧化应激是指在活性氧(Reactive oxygen species,ROS)和活性氮(Reactive nitrogen species,RNS)的生产与抗氧化剂之间的严重失衡过程中对生物分子造成的损伤[9]。

图3 松果菊苷对AD模型鼠脑内氧化应激的影响A、B Western blot检测各组小鼠皮层区SOD1的蛋白变化。C、D各组小鼠脑内ROS和SOD活性的比较。与AD模型鼠相比,*P<0.05,**P<0.01。
松果菊苷(Echinacoside,ECH)是种天然化合物,主要从管花肉苁蓉中提取分离的,具有抗氧化和清除自由基活性的苯乙醇苷类化合物[10]。研究证实,ECH可以提高人体内重要的抗氧化物质过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)以及超氧化物歧化酶(SOD)的活性以及降低自由基损伤,从而起到保护神经元的作用。同时也有研究证实ECH可通过抑制氧化应激而保护神经元损伤[11]。除此之外,松果菊苷可通过改善中枢胆碱能系统功能从而促进蛋白和核酸合成,并提高小鼠的免疫功能,最终提高小鼠的学习记忆能力[12]。
本实验通过对氧化应激蛋白SOD1表达,以及ROS和SOD活性的检测,发现松果菊苷处理后的AD模型鼠与AD组相比,SOD1蛋白表达升高,活性增强,ROS活性降低,这一结果提示松果菊苷可能通过抑制AD小鼠脑内氧化应激反应而缓解AD发病,并且通过免疫荧光实验方法检测,我们发现松果菊苷可减少AD模型鼠脑内Aβ沉积数量,而且水迷宫实验更进一步证实松果菊苷可改善AD模型鼠的认知功能,为今后揭开松果菊苷缓解AD发病提供现实基础和理论依据。
