小鼠胚胎心包内动脉心外膜的形成及其细胞的分布变化
2021-10-21李云华王佳佳曹锡梅李海荣景雅谢建山杨艳萍
李云华,王佳佳,曹锡梅,李海荣,景雅,谢建山,杨艳萍
(山西医科大学组织胚胎学教研室,太原 030001)
心外膜是覆盖心肌外表面的上皮组织,起源于原始横膈的心外膜前体(proepicardium,PE)[1,2]。心外膜生长障碍导致心肌不致密、瓣膜畸形和冠状动脉异常等,因此,研究心外膜的发育对探讨这些畸形的发生机制具有重要意义。鸡胚流出道(outflow tract, OFT)近段的心外膜(epicardium spreading over the cardiac tube,cEP)是PE衍生的,远段的心外膜称为动脉心外膜(arterial epicardium,aEP)来自于aPE(arterial proepicardium)[3],即覆盖动脉囊基部(OFT与心包腔背侧壁交界处)的心包上皮[4]。小鼠胚胎OFT远段的心外膜是否同样有不同于PE的起源仍需证实。
胚胎心脏OFT在分隔前,其管壁由心外膜、心肌和心内膜构成。OFT心肌来自于第二生心区(second heart field,SHF),后者包括咽前间充质、鳃弓核心间充质和心包腔背侧壁脏壁中胚层[5]。OFT形成后,依据其组织学结构及重塑结果可分为心肌部(即OFT近段)和非心肌部(即OFT远段)。随发育,OFT非心肌部分隔为心包内升主动脉和肺动脉干[6]。随后SHF来源的间充质细胞分化为动脉中膜的平滑肌细胞(smooth muscle cells,SMCs)[7],两动脉壁表面则覆盖有心外膜。由于SHF前体细胞部分分布于心包腔背侧壁,而Pérez-Pomares等认为的心包内主、肺动脉心外膜的起源是动脉囊基部表面的心包膜上皮[4],二者是否属于同一结构,即aPE是否属于SHF尚不清楚。
心外膜细胞可经上皮-间充质转化形成间充质细胞(epicardial-derived cells,EPDCs)。已证实EPDCs 为多能干细胞[8],可分化为心肌细胞、冠状血管壁的内皮细胞与SMCs[1,8],也参与房室瓣的形成[9]。而aEP是否也可产生EPDCs,是否参与动脉壁的发育有待进一步研究。
因此,本研究用免疫组织化学染色和原代心外膜祖细胞(epicardial progenitor cells,EpiCs)培养等方法系统观察小鼠胚胎心脏心外膜的形成、OFT的分隔与重塑等过程,探讨小鼠胚胎心包内aEP的起源,形成过程及其所含细胞在心包内主、肺动脉管壁发育过程中可能的作用。
材料与方法
1 实验材料
9周龄健康ICR小鼠由山西医科大学实验动物中心提供[动物生产许可证号:SCXK(晋)2019-0004]。雌雄小鼠以2:1于18点合笼,次晨含阴栓雌鼠计为胚龄0.5d(embryonic day 0.5,E0.5)。实验中对动物的处理方法符合山西医科大学伦理委员会对动物实验的要求和规定。取E9.5—E16胚胎,石蜡包埋,制作7μm连续石蜡切片。
2 免疫组织化学染色
ABC法染色:石蜡切片脱蜡、水化、3%过氧化氢、TENG-T预处理后,分别用兔抗Sox-9抗体(1:50, Santa Cruz公司)、羊抗Tbx18抗体(1: 50, Santa Cruz公司)、兔抗胰岛素增强子结合蛋白1(insulin gene enhancer binding protein 1, Isl1)抗体(1:700,ABclonal公司)、兔抗重组anti-Wilms Tumor蛋白(WT1)抗体(1:1000, Abcam公司)、小鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体)(1:1500, 武汉博士德生物工程有限公司)、小鼠抗心肌肌球蛋白重链(myosin heavy chain, MHC)抗体(1:1500, Upstate公司)4℃过夜孵育,生物素标记羊抗小鼠/兔IgG(武汉博士德生物工程有限公司)或生物素标记驴抗羊IgG(1:500, Jackson公司)和SABC试剂分别37℃孵育30min,DAB显色,显微镜下观察并摄片。
双重免疫荧光染色:石蜡切片脱蜡、水化、TENG-T预处理后,选用兔抗Isl1抗体和小鼠抗α-SMA抗体,兔抗WT1抗体和小鼠抗α-SMA抗体混合,4℃过夜孵育,相应混合羊抗兔IgG-Cy3和羊抗小鼠IgG-FITC(1:100,武汉博士德生物工程有限公司),37℃避光孵育1h,DAPI室温10min,抗荧光衰减封片剂封片后,荧光显微镜下观察并摄片。
3 原代心外膜祖细胞培养
体式显微镜下解剖出心包内主、肺动脉,将组织放入六孔板,盖压无菌盖玻片。滴加含10%血清、1%青链霉素的高糖DMEM培养基,将6孔板移入培养箱中。48h后移除组织,加入含20ng/ml 血小板衍生生长因子-BB(platelet-derived growth factor-BB,PDGF-BB)(PE-PROTECH公司),倒置显微镜继续观察培养并摄片。
4 细胞免疫荧光染色
细胞经4%多聚甲醛、0.25%Triton X-100、5%BSA预处理后,选用兔抗WT1抗体、兔抗Tbx18抗体(1:100, Abcam公司)、兔抗WT1抗体和小鼠抗α-SMA抗体混合、兔抗Tbx18抗体和小鼠抗α-SMA抗体混合,4℃过夜孵育。相应选择羊抗兔IgG-Cy3、混合羊抗兔IgG-Cy3和羊抗小鼠IgG-FITC,37℃避光孵育1h,DAPI室温8min,抗荧光衰减封片剂封片后,激光共聚焦显微镜观察并摄片。
结 果
1 E9.5小鼠胚胎OFT的发育与PE来源心外膜细胞的迁移
E9.5小鼠胚胎,OFT远端与动脉囊相连(图1A),该部位心肌细胞特异性标记物MHC呈弱阳性(图1B箭头),而心肌细胞早期分化标记物α-SMA呈强阳性(图1A箭头)。SHF前体细胞标记物Isl1表达于心包腔背侧壁脏壁中胚层(图1C细箭头)以及与之相延续的OFT远端(图1C箭头),提示Isl1免疫反应阳性SHF前体细胞向OFT远端延伸并分化为心肌细胞。静脉端可见PE分布有较多WT1或Tbx18免疫反应阳性细胞(图1D、E),与房室管、左心室表面散在的WT1、Tbx18免疫反应阳性细胞直接相邻(图1D、E箭头)。提示可能此期PE的细胞已迁移至胚胎心脏房室管,并开始向与房室管相连的心房与心室扩展。
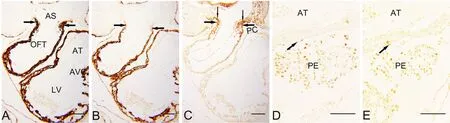
图1 胚龄9.5d胚胎横切面α-SMA、MHC、Isl1、WT1和Tbx18表达的免疫组织化学检测。A,α-SMA;B,MHC;C,Isl1;D,WT1;E,Tbx18。比例尺,100μm。OFT, 流出道;AS, 动脉囊;AVC, 房室管;AT, 心房;LV, 左心室;PC, 心包腔;PE, 心外膜前体Fig. 1 Immunohistochemical staining for the expression of α-SMA, MHC, Isl1, WT1 and Tbx18 in the transversal sections of mouse embryos at E9.5.A, α-SMA; B, MHC; C, Isl1; D, WT1; E, Tbx18. Scale bar, 100μm. OFT, outflow tract; AS, aortic sac; AVC, atrioventricular canal; AT, atrium; LV, left ventricle; PC, pericardial cavity; PE, proepicardium
2 E10.5小鼠胚胎OFT的发育与心外膜的形成
E10.5小鼠胚胎,动脉囊仍位于心包腔外(图2A)。MHC在OFT壁的表达与E9.5相似,由近端向远端逐渐减弱(图2B箭头),而在OFT壁与心包腔背侧壁返折处,Isl1与α-SMA表达较强(图2A、C箭头),说明Isl1阳性细胞继续向心肌细胞分化并向OFT远端添加,使OFT增长。Isl1免疫反应阳性的SHF细胞分布于心包腔背侧壁(图2C细箭头)与前肠腹侧间充质(图2C星号)。连续切片观察,WT1和Tbx18免疫反应阳性的心外膜细胞呈单层扁平状,广泛分布于心房、房室管、心室壁的外表面(图2D、E)。在与右心室相接的OFT壁,WT1和Tbx18阴性表达,说明OFT壁心外膜尚未形成(图2F、G)。此期由胚胎动脉端到静脉端,心包壁层大部表达WT1(图2H箭头),但在Isl1阳性的心包腔背侧壁(图2I箭头)未见WT1阳性细胞分布(图2H)。
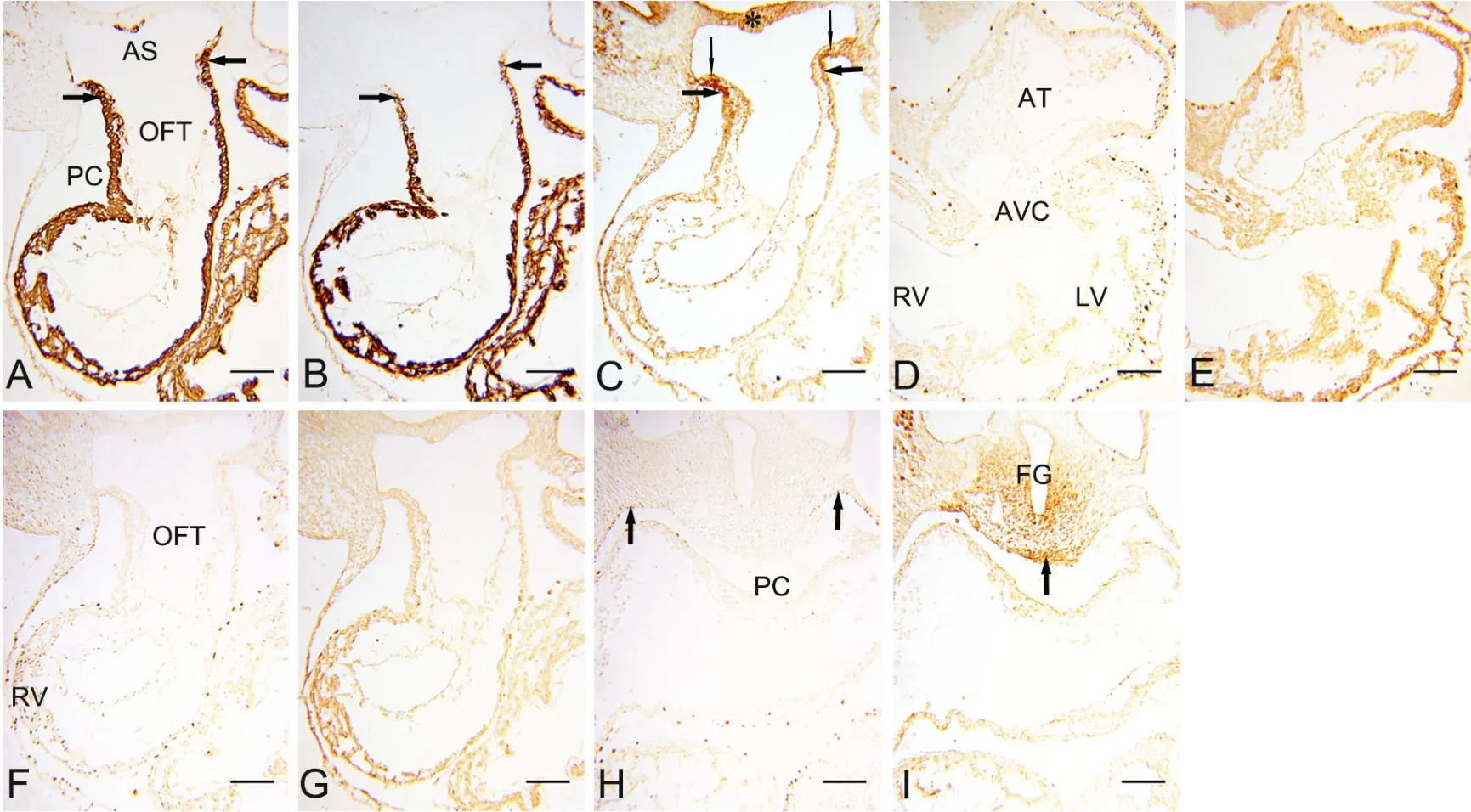
图2 胚龄10.5d心横切面α-SMA、MHC、Isl1、WT1和 Tbx18表达的免疫组织化学检测。A,α-SMA;B,MHC; C和I,Isl1;D、F和H,WT1;E和G,Tbx18。比例尺,100μm。OFT, 流出道;AS, 动脉囊; PC, 心包腔;AT, 心房;AVC, 房室管;RV, 右心室;LV, 左心室;FG,前肠Fig. 2 Immunohistochemical staining for the expression of α-SMA, MHC, Isl1, WT1and Tbx18 in the transversal sections of mouse embryonic hearts at E10.5. A, α-SMA; B, MHC; C and I, Isl1; D, Fand H, WT1; E and G, Tbx18. Scale bar, 100μm. OFT, outflow tract; AS, aortic sac; PC, pericardial cavity; AT, atrium; AVC, atrioventricular canal; RV, right ventricle; LV, left ventricle; FG, foregut
3 E11小鼠胚胎OFT的发育与心外膜的分布变化
E11小鼠胚胎,动脉囊进入心包腔,其壁为MHC阴性,因此形成OFT的非心肌部(图3A、B)。其远端及其与之相延续的心包腔背侧壁呈Isl1免疫反应阳性(图3C箭头),相邻切片免疫组化染色显示OFT非心肌部远端同时表达α-SMA(图3A箭头)、但不表达MHC(图3B箭头),说明Isl1免疫反应阳性的SHF细胞不再向心肌细胞分化。WT1的表达开始出现在Isl1阳性的心包腔背侧壁以及与之相连的OFT远端壁的表面(图3D细箭头)。在与右心室相连的OFT心肌部外表面,WT1免疫反应阳性的cEP清晰可见,但与OFT非心肌部远端的WT1阳性细胞带即aEP之间缺乏连续性(图3D箭头),进一步提示OFT心肌部与非心肌部的心外膜有不同来源。Tbx18在OFT非心肌部以及相连的心包腔背侧壁表达呈免疫反应弱阳性(图3E细箭头)。心包腔背侧壁与OFT非心肌部的WT1阳性细胞呈单层立方状(图3F、G箭头),而OFT心肌部的心外膜为单层扁平上皮(图3F、H箭头)。向静脉端移行,与心房相邻的Isl1阳性的心包腔背侧壁(图3I箭头),WT1表达仍为阴性(图3J箭头),即仅心脏动脉端相邻的心包腔背侧壁上皮开始表达WT1。
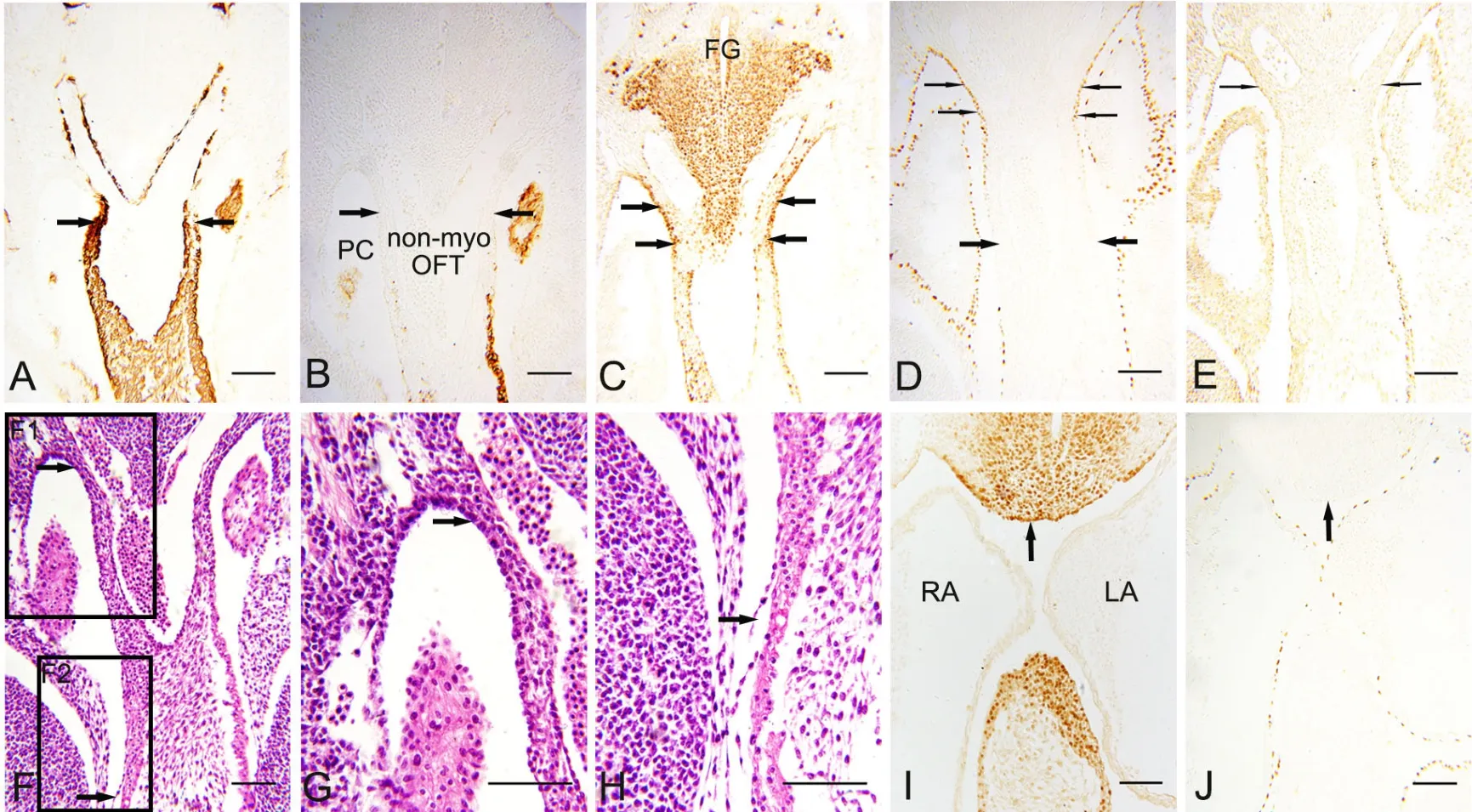
图3 胚龄11d心横切面α-SMA、MHC、Isl1、WT1和 Tbx18表达的免疫组织化学检测和组织学特征分析。A, α-SMA;B, MHC;C和I,Isl1;D和J,WT1;E,Tbx18;F,组织学特征的HE染色观察;G和H,分别为F中的F1和F2的局部放大。比例尺,100μm。PC,心包腔;non-myo OFT,OFT非心肌部;FG,前肠;RA,右心房;LA,左心房Fig. 3 Immunohistochemical staining for the expression of α-SMA, MHC, Isl1, WT1 and Tbx18 in the transversal sections of mouse embryonic hearts at E11 and their histological characteristic analysis. A, α-SMA; B, MHC; C and I, Isl1; D and J, WT1; E, Tbx18; F, analysis by HE staining for histological characteristics; G and H, magnification of F1 and F2 in F, respectively. Scale bar, 100μm. PC, pericardial cavity; non-myo OFT, non-myocardial part of the OFT; FG, foregut; RA, right atrium; LA, left atrium
4 E11.5小鼠胚胎OFT的分隔与EPDCs形成
E11.5小鼠胚胎,主肺动脉隔将OFT非心肌部分隔为心包内升主动脉和肺动脉干(图4A)。Isl1免疫反应染色显示此期SHF由Isl1阳性的气管腹侧锥形区(图4B星号)和心包腔背侧壁脏壁中胚层构成,前者体积较大,其尖端Isl1阳性细胞延伸至主动脉和肺动脉干管壁,因此两动脉壁内可见大量Isl1阳性SHF细胞(图4B、C)。α-SMA表达则局限于动脉壁近内皮处(图4A箭头)。提示此期较多SHF前体细胞已进入动脉壁,但尚未大量分化为α-SMA阳性SMCs。心包腔背侧壁仍表达Isl1、WT1、Tbx18(图4B-E箭头),且与主动脉壁外表面的aEP相延续(图4C、D、E),说明SHF前体细胞继续向心外膜细胞分化,而aEP与OFT心肌部的心外膜仍未彼此相连(图4D, E细箭头)。
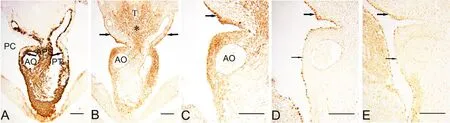
图4 胚龄11.5d心横切面α-SMA、Isl1、WT1和Tbx18表达的免疫组织化学检测。A,α-SMA;B,和C,Isl1;D,WT1;E,Tbx18;C,B中方框的局部放大。比例尺,100μm。PC,心包腔;APS,主肺动脉隔;AO,升主动脉;PT,肺动脉干;T,气管Fig. 4 Immunohistochemical staining for the expression of α-SMA, Isl1, WT1 and Tbx18 in the transversal sections of mouse embryonic hearts at E11.5.A, α-SMA; B and C, Isl1; D, WT1; E , Tbx18; C, the enlargement of the box in B. Scale bar, 100μm. PC, pericardial cavity; APS, aorta pulmonary septum; AO, ascending aorta; PT, pulmonary trunk; T, trachea
5 E12.5小鼠胚胎心包内主、肺动脉的发育以及EPDCs的分布变化
E12.5小鼠胚胎,升主动脉和肺动脉干完全分隔,两动脉壁内仍分布有丰富的Isl1免疫反应阳性的SHF细胞(图5A)。免疫荧光双染结果显示,部分Isl1免疫反应阳性细胞同时表达α-SMA(图5B箭头),即α-SMA在动脉壁的表达不再局限于近内皮处,而是向外层扩展,提示SHF前体细胞向SMCs分化。动脉壁外表面的WT1免疫反应阳性细胞未进入中膜(图5C)。在心外膜下间隙、致密心肌可见较多WT1阳性EPDCs分布(图5D箭头)。
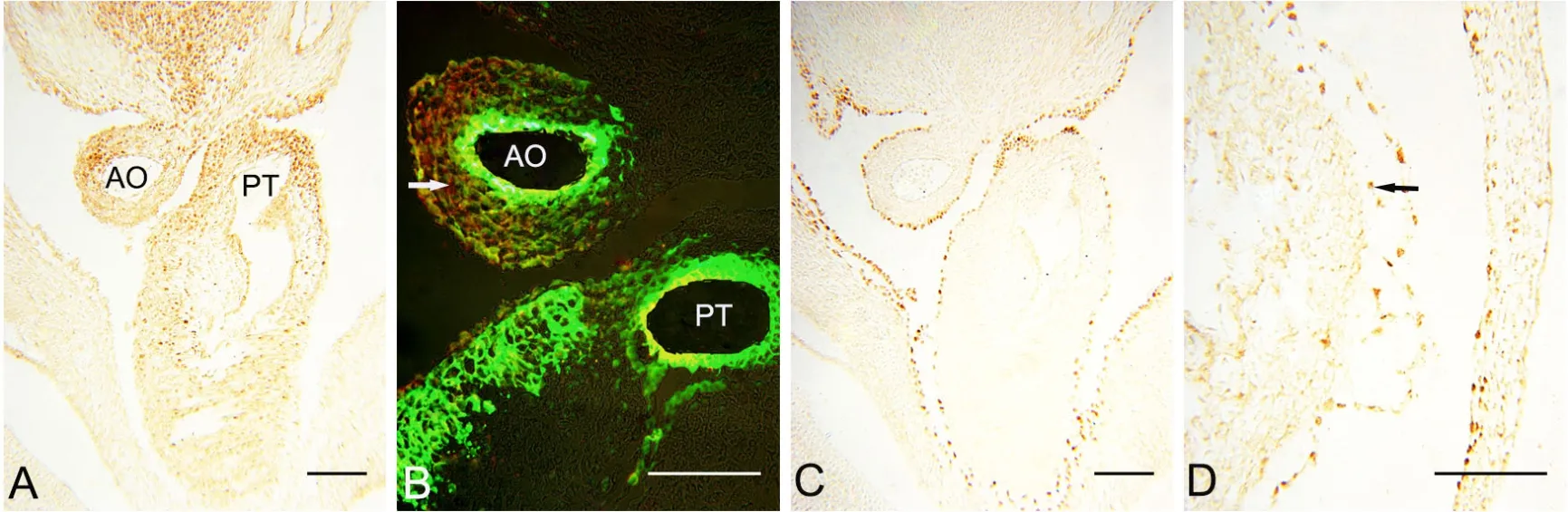
图5 胚龄12.5d心横切面Isl1、α-SMA和WT1表达的免疫组织化学检测。A,Isl1;B,Isl1和α-SMA免疫荧光双标,绿色示α-SMA,红色示Isl1;C和D,WT1。比例尺,100μm。AO,升主动脉;PT,肺动脉干Fig. 5 Immunohistochemical staining for the expression of Isl1, α-SMA and WT1 in the transversal sections of mouse embryonic hearts at E12.5. A,Isl1; B, double immunofluorescence staining of Isl1 (red) and α-SMA (green); C and D, WT1. Scale bar, 100μm. AO, ascending aorta; PT, pulmonary trunk
6 E14—E16小鼠胚胎心包内主、肺动脉的发育以及EPDCs分布变化
E14—E16小鼠胚胎,心包内主、肺动脉的aEP以及与之延续的心包腔背侧壁上皮由立方形变为扁平状,仍表达WT1(图6A、B箭头),但失去了Isl1的表达(图6C箭头)。主、肺动脉壁中膜的Isl1阳性细胞逐渐减少至消失(图6C、D星号),α-SMA表达扩展至管壁中膜全层(图6E)。免疫荧光染色显示,动脉壁中膜内也可观察到WT1免疫反应阳性细胞的散在分布,同时表达α-SMA(图6E)。提示aEP也可产生WT1阳性EPDCs并进入动脉中膜向SMCs分化。此期两动脉的瓣膜已形成,瓣膜内分布有丰富的Sox9免疫反应阳性间质细胞(图6F),免疫组织化学染色与免疫荧光双染均显示,瓣膜内分布有散在的WT1阳性心外膜细胞(图6G、H箭头)。
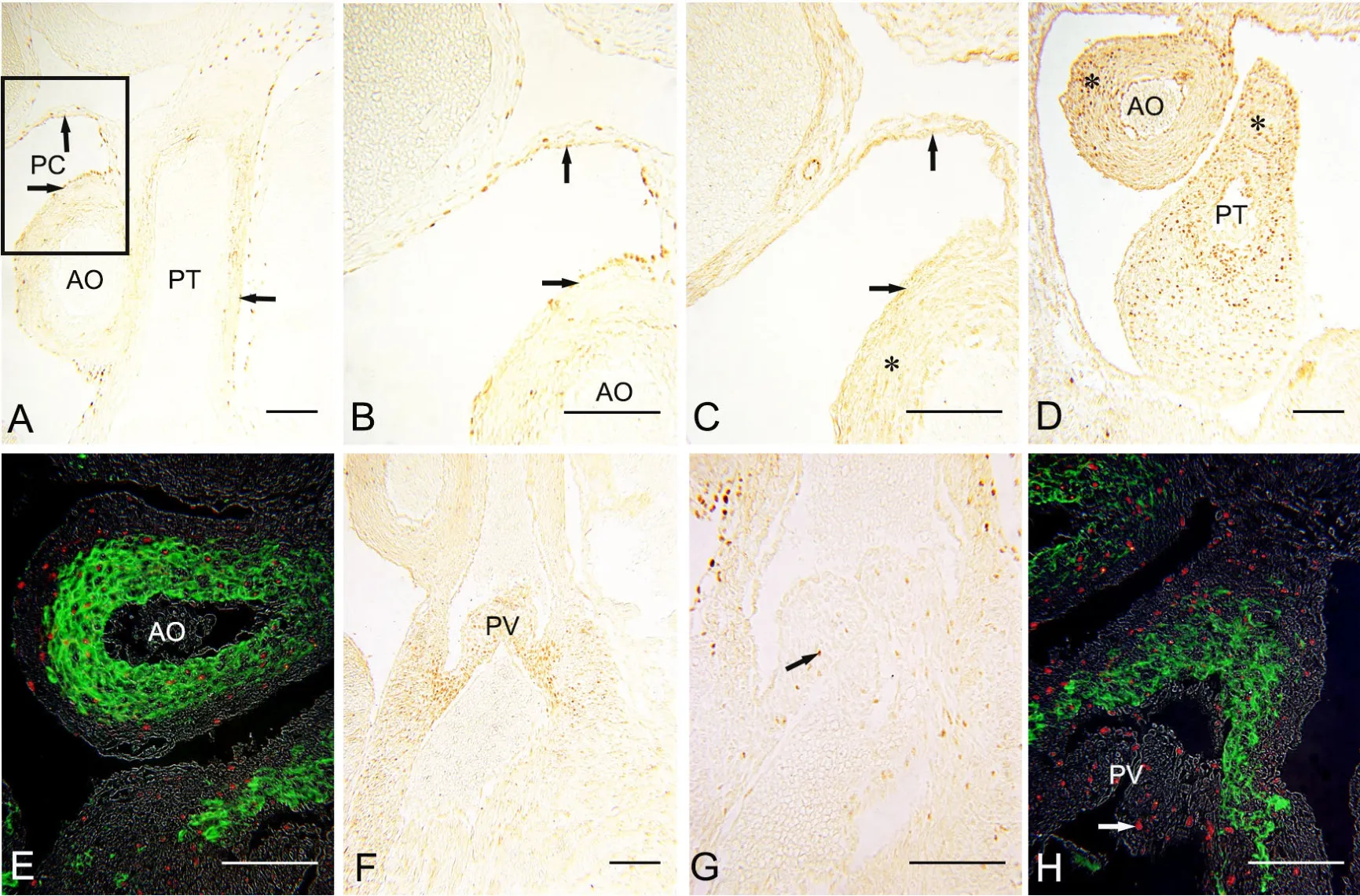
图6 胚龄14—16d心横切面WT1、α-SMA、Isl1和Sox-9表达的免疫组织化学检测。A、B和G,WT1,B为A中方框的局部放大; C和D,Isl1; E和H,α-SMA (绿色)和WT1(红色)免疫荧光双标;F,Sox-9免疫组织化学染色。比例尺,100μm。 PC,心包腔;AO,升主动脉;PT,肺动脉干;PV,肺动脉瓣膜Fig. 6 Immunohistochemical staining for the expression of WT1, α-SMA, Isl1 and Sox-9 in the transversal sections of mouse embryonic hearts at E14 to E16. A and G, WT1; B, enlargement of the box in A; C and D, Isl1; E and H, double immunofluorescence staining of α-SMA (green) and Isl1(red);F, Sox-9. Scale bar, 100μm. PC, pericardial cavity; AO, ascending aorta; PT, pulmonary trunk; PV, pulmonary valve
7 E13小鼠胚胎心包内主、肺动脉原代EpiCs体外培养并向SMCs分化
按照文献[10,11]所介绍方法,选取E13小鼠胚胎心包内主、肺动脉组织进行原代EpiCs培养。动脉组织种植24h后,可见部分EpiCs从组织边缘爬出,以鹅卵石样向外生长,显微镜下观察呈典型的上皮样细胞形态(图7A)。培养48h后,对EpiCs进行免疫荧光染色可见其高表达EpiCs标志物 WT1(图7B)与Tbx18(图7C)。对EpiCs纯度进行检测,使用ImageJ细胞计数,证实EpiCs纯度为97.78±0.50%。数据表明,EpiCs可以成功地进行高纯度的培养。部分EpiCs在添加PDGF-BB的培养基中培养72h后,出现较多形态不规则的SMCs;对照组未进行PDGF-BB干预的EpiCs,培养6d后出现少量的SMCs。免疫荧光双染检测显示添加PDGFBB组的细胞α-SMA呈强阳性表达(图7D—G),说明PDGF-BB可以诱导EpiCs向SMCs分化。而未进行PDGF-BB干预的对照组,α-SMA少量表达(图7H—K),说明在无PDGF-BB诱导情况下EpiCs也可以向SMCs进行缓慢分化,与对照组相比,PDGFBB对EpiCs向SMCs分化起促进作用。
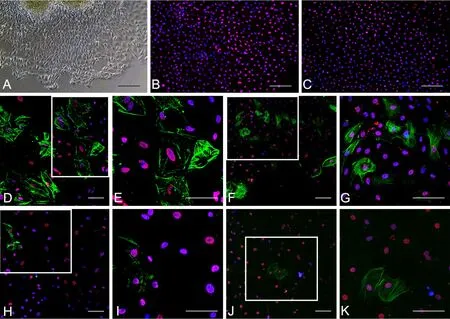
图7 胚龄13d心包内主动脉和肺动脉原代EpiCs中WT1、Tbx18和α-SMA表达的免疫荧光检测。A,EpiCs从组织边缘爬出;B,WT1(红色),蓝色示DAPI染色的的细胞核;C,Tbx18(红色),蓝色示DAPI染色的的细胞核; D、E、H和I,WT1(红色)和α-SMA(绿色)免疫荧光双标,蓝色示DAPI染色的细胞核;F、G、J和K,Tbx18(红色)和α-SMA(绿色)免疫荧光双标,蓝色示DAPI染色的细胞核;E、G、I和K,分别为D、F、H和J中方框的局部放大。比例尺:A—C,50μm; D—K,100μmFig.7 Immunofluorescence detection for the expression of WT1, Tbx18 and α-SMA in primary EpiCs of the intrapericardial aorta and pulmonary artery in mouse embryos at E13. A, EpiCs climbing out from the tissue edge; B, WT1 (red) and nuclei (blue, stained with DAPI); C, WT1(green) and nuclei(blue, stained with DAPI); D, E, H and I, double immunofluorescence staining of WT1 (red), α-SMA (green), and nuclei (blue, stained with DAPI); F,G, J and K, double immunofluorescence staining of Tbx18 (red), α-SMA (green), and nuclei (blue, stained with DAPI); E, G, I and K, enlargements of the boxes in D, F, H and J. Scale bar: 50μm in A to C; 100μm in D to K
讨 论
1 小鼠胚胎心包内主动脉和肺动脉心外膜来自动脉端心包腔背侧壁脏壁中胚层
目前为止,小鼠胚胎心包内aEP起源是否与鸡胚一致尚未见报道。本研究结果显示,E9.5—E10.5小鼠胚胎静脉端的PE富含WT1和Tbx18阳性细胞;在PE相邻的房室管心肌表面,观察到心外膜细胞,说明心外膜开始形成,并逐渐扩展至心房和心室。但在心脏动脉端的OFT尚无心外膜覆盖。至E11,OFT的非心肌部和心肌部形成,后者表面开始有来自PE的心外膜覆盖。值得注意的是,OFT非心肌部远端开始出现WT1和Tbx18阳性的心外膜,为单层立方上皮,与OFT心肌部的单层扁平的心外膜形态不同。两种心外膜之间有明显的中断,说明来自于静脉端PE的OFT心肌部的心外膜并未扩展至非心肌部,后者的心外膜有不同的来源。由于OFT非心肌部一端与心肌部相连,另一端与心包腔背侧壁相延续,既然OFT非心肌部的心外膜并非来源于心肌部心外膜的扩展,我们推测前者可能来自心包腔背侧壁,因此本实验观察了OFT非心肌部心外膜的形成过程以及心包腔背侧壁的相关蛋白表达模式,结果显示在E9.5—E10.5,心包腔背侧壁表达SHF标记物Isl1,但不表达心外膜标记物WT1和Tbx18,所含SHF前体细胞正在向心肌细胞分化;至E11,动脉囊进入心包腔,成为OFT的非心肌部,因此心包腔背侧壁不再向心肌细胞分化,该部位虽仍表达Isl1,但同时开始表达心外膜的标记物WT1、Tbx18,这些WT1、Tbx18阳性细胞延伸至OFT非心肌部的表面。由此说明OFT非心肌部心外膜开始形成,它与心包腔背侧壁相延续,后者同时表达心外膜的特异性标记物WT1与SHF标记物Isl1,由此推测OFT非心肌部心外膜有不同于PE的起源,来自于SHF。此与鸡胚的研究结果一致[4],但鸡胚的aPE位于动脉囊基部,形态与静脉端的PE相似,有多个突起[4]。本实验的结果则显示小鼠胚胎aPE来自于动脉端心包腔背侧壁脏壁中胚层,是SHF的构成部分,即aPE属于SHF,心包腔背侧壁SHF前体细胞具有上皮特性,呈单层或假复层立方形,在细胞基底面的丝状伪足参与下增生、向OFT非心肌部延伸[12]。小鼠E16,在动脉端心外膜形成后,aPE的细胞与主、肺动脉的心外膜细胞均变为单层扁平状。
2 心包内主动脉和肺动脉壁的心外膜来源细胞参与动脉壁及瓣膜发育
覆盖在心包内主动脉和肺动脉表面的aEP是否可产生EPDCs,是否参与动脉壁及瓣膜发育有待证实。本实验观察到在胚胎心包内主动脉和肺动脉形成后,二者管壁中膜于E12.5开始出现WT1免疫反应阳性细胞,至E14明显增多,这些细胞同时表达α-SMA,由此推测aEP来源的EPDCs进入动脉中膜,向SMCs分化。分离心包内主、肺动脉管壁体外培养进一步验证了此结论,aEP可以经上皮—间充质转化为EPDCs,进入动脉中膜,分化为α-SMA阳性SMCs细胞,参与动脉壁的发育。主动脉与肺动脉分隔后,瓣膜随之形成,二者的3个瓣膜内可见WT1阳性细胞的散在分布。现有研究证实主动脉和肺动脉的左、右两瓣膜内的间充质细胞为神经嵴与内皮来源[14],主动脉后瓣和肺动脉前瓣来自SHF[15]。本实验结果提示aEP的EPDCs可能也参与瓣膜的发育。与房室管的EPDCs仅参与壁侧瓣的发育不同,动脉的EPDCs见于任一瓣膜内。
综上,本实验为探究小鼠胚胎心包内动脉心外膜来自于SHF提供了形态学依据;动脉心外膜的WT1阳性细胞分布变化以及蛋白表达模式的改变,提示动脉心外膜所含细胞参与了主、肺动脉管壁以及瓣膜的发育。这些结果对探讨心外膜相关畸形的发生机制具有重要意义。
