雷帕霉素促进胚胎干细胞向心肌细胞分化
2021-10-21汪萍萍李涛翁晓菲李贤慧李彦明程冠昌
汪萍萍,李涛,翁晓菲,李贤慧,李彦明,程冠昌*
(1湖南师范大学医学院,长沙 410013;2武警医学院卫生勤务系人体机能教研室,天津 300309;3河南大学淮河医院心内科,开封 475000)
胚胎干细胞(embryonic stem cell,ES细胞)具有无限增殖、自我更新和多向分化的特性。无论在体外还是体内环境,ES细胞都能被诱导分化为机体几乎所有的细胞类型。对ES细胞定向诱导分化的研究,将揭示特定组织细胞类型形成的细胞和分子机制,在发育生物学和转化医学研究中具有重要意义。通过ES细胞、诱导多能干细胞、成体干细胞得到心肌细胞,将为心肌梗死等疾病的治疗提供良好的种子细胞,具有广阔的应用前景。目前,已经发展出了不同的心肌诱导分化策略,包括添加外源性生长因子或细胞因子,外源添加小分子信号通路抑制剂或诱导剂,与心肌细胞、内胚层细胞、内皮细胞共培养,心肌细胞条件培养基等不同技术路线。比较而言,小分子诱导剂具有多种优势,来源方便、经济实惠、均一性较好。小分子诱导剂通过激活或抑制特定的信号通路,促进干细胞向心肌细胞高效、专一的定向分化,减少混杂细胞的产生。比如,抗坏血酸被发现通过激活MEK-ERK1/2信号通路促进胶原合成,有利于心肌前体细胞的生成,促进心肌分化[1]。诱导早期加入GSK3β抑制剂(BIO、LiCl等),CK1激酶抑制剂CHIR99021,通过抑制GSK3β、CK1以达到活化Wnt/β-catenin通路,有利于中胚层和心肌前体细胞分化[2-4]。心肌分化晚期使用KY02111等新型Wnt抑制剂,抑制Wnt信号也能影响心肌分化,改善心肌细胞的成熟度[5]。
细胞自噬是细胞在自噬相关基因的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程,具有调控细胞自稳定的重要作用。自噬与生物的发育、衰老和疾病关系密切。现在已经衍生出多种自噬小分子激动剂和抑制剂。雷帕霉素是一种大环内酯类免疫抑制剂,可以抑制mTOR信号通路的mTORC1,从而激活自噬。在本研究中,我们检测了自噬诱导剂雷帕霉素对小鼠ES细胞向心肌分化的影响,并研究了相关机制。
材料和方法
1 材料和试剂
小鼠ES细胞E14tg2a株为郑州大学医学部臧明玺教授惠赠。抗坏血酸(AA)、β-巯基乙醇、白血病分化抑制因子(LIF)购自Sigma公司,雷帕霉素(Rapa)、羟氯喹(HCQ)购自Selleck公司,明胶、Hoechst33342和非必需氨基酸购自索莱宝生物技术公司,胎牛血清和DMEM培养基购自Gibco。国产细菌培养皿购自青岛金典,其他培养皿等购自康宁公司。心肌肌钙蛋白-T(troponin-T)、α-辅肌动蛋白(α-actinin)抗体购自Abclonal公司,抗Mef2c、Isl1抗体购自Abcam公司,抗Oct4抗体购自Santa Cruz公司,抗Gapdh抗体、辣根过氧化酶及FITC标记的二抗均购自Abclonal公司。RNA提取及反转录试剂盒购自碧云天公司,PCR引物由上海生工生物公司合成,Real-time PCR试剂盒购自TOYOBO公司。
2 ES细胞的培养及心肌诱导分化
小鼠ES细胞接种于用0.1%明胶处理的培养皿,含15%胎牛血清、2mmol/L非必需氨基酸、0.1mmol/L β-巯基乙醇、104U/ml小鼠LIF Medium、100U/ml青链霉素的DMEM高糖培养基中,于37℃、体积分数为5% CO2的细胞培养箱中培养。通过拟胚体法(embryoid body, EB)(由ES细胞在诱导分化培养基中悬浮培养,通过自发聚集和生长形成三维球状结构,以模拟早期胚胎发育)加抗坏血酸诱导ES细胞向心肌分化: ES克隆长满80%~90%后,用0.25% 胰酶消化,按2.8×104个细胞/cm3的密度接种于培养皿中,加入含20%胎牛血清、2mmol/L非必需氨基酸、0.1mmol/L β-巯基乙醇、10-4mol/L AA、100U/mL青链霉素的DMEM高糖培养基,悬浮培养,每2~3d换液。第5d将悬浮形成的拟胚体接种于细胞培养皿中贴壁培养。根据细胞生长情况每天或者隔天换液,细胞在诱导的第8~10d出现跳动。
3 Real-time PCR
RNA柱提方法参照碧云天公司产品说明。Real-time PCR采用TOYOBO公司的SYBR Green Real-time PCR Master Mix在ABI7700型定量PCR仪上进行。反应体系如下:2×SYBR Green Master Mix buffer 7.5μl,10pmol/μl正向和反向引物各0.25μl, cDNA模板1μl,灭菌去离子水补足至15μl。PCR 反应条件:95℃变性10min,95℃15s,60℃1min,40个循环。测定样品的循环阈(cycle threshold, Ct)值通过计算2-△△Ct来比较不同样品之间特定基因的表达差异。PCR引物序列:β-Mhc基因正向引物5’-ACAACCCCTACGATTATGCGT-3’ , 反 向 引 物 5’-ACGTCAAAGGCACTATCCGTG-3’; Mef2c基因正向引物5’-CTGAGCGTGCTGTGCGACTGT-3’,反向引物5’-GCTCTCGTGCGGCTCGTTGTA-3’; Isl1 基因正向引物5’-CTGCTTTTCAGCAACTGGTCA-3’,反向引物 5’-TAGGACTGGCTACCATGCTGT-3’; 18s 基因正向引物5’-GTAACCCGTTGAACCCCAATT-3’,反向引物 5’-CCATCCAATCGGTAGTAGCG-3’。
4 免疫荧光染色
分化后的细胞团加入胰酶消化,细胞滴于6孔板内的盖玻片上,待其贴壁2h后,4%多聚甲醛于室温固定切片15min;0.5%的Triton X-100/PBS(PBST)透膜10min;2% BSA 37℃孵育30min,以封闭非特异性结合位点;2% BSA 稀释的抗α-actinin抗体或抗Isl1抗体,4℃孵育过夜;PBST漂洗3遍后加入TRITC标记的山羊抗小鼠二抗,湿盒内避光孵育30min;PBST充分漂洗后,1μg/ml Hoechst33342核复染色5min,漂洗后,缓冲甘油封片(PBS:甘油=1:9),置荧光显微镜(Fluoview300, Olympus)下观察。
5 蛋白免疫印迹
将细胞用冰预冷的PBS洗两遍,将细胞刮下收集到Eppendorf管中,5000r/min离心5min,沉淀细胞,加入预冷的裂解缓冲液(pH 8.0、50mmol/L Tris-HCl,150mmol/L NaCl,0.1% SDS,1% NP-40,0.5% 脱氧胆酸钠),将细胞重悬,冰上孵育30min后,12000r/min离心15min,上清即为全细胞裂解液。BCA法蛋白定量。30μg蛋白煮沸后,10% SDSPAGE电泳转膜,5%脱脂奶粉封闭1h后加入一抗杂交,辣根过氧化物酶标记二抗孵育后化学发光法显色。
6 统计方法
数据以均值±标准差表示,采用SPSS18.0统计软件进行 t 检验和单因素方差分析。P<0.05表示差异有显著性。
结 果
1 拟胚体诱导法诱导ES细胞向心肌分化
采用拟胚体建立ES细胞向心肌细胞诱导分化的模型。ES细胞在维持培养基中呈集落样生长,边缘光滑(图1A)。ES细胞消化传代后,更换诱导分化培养基,撤除LIF,添加10-4mol/L AA作为诱导剂,并利用培养皿进行悬浮培养。ES细胞相互聚集形成EB球。经过5d的悬浮培养后将EB贴壁,撤去诱导培养基继续培养,约3~5d后可以在显微镜下观察到有节律收缩的EB,在8~10d开始起跳。real-time PCR检测显示心肌特异性收缩蛋白基因(肌球蛋白重链基因)β-Mhc随诱导时间递增(图1B),其中在第8~10d显著增加。免疫荧光染色显示在诱导后功能性心肌收缩蛋白α-辅肌动蛋白(α-actinin)表达(图1C)。由此证实ES细胞成功地被诱导为心肌细胞。
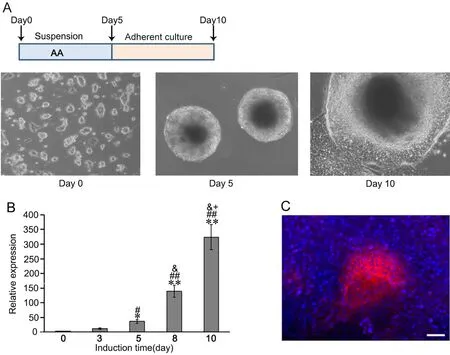
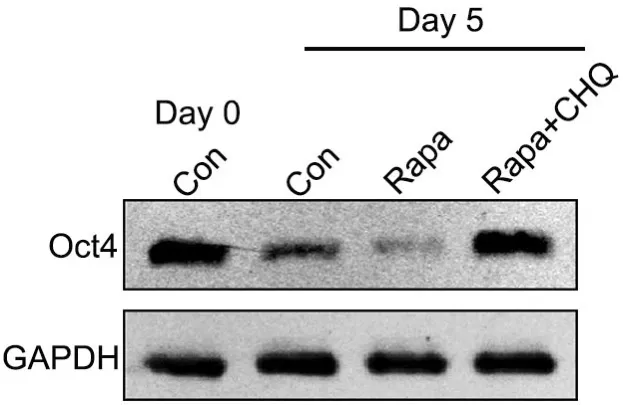
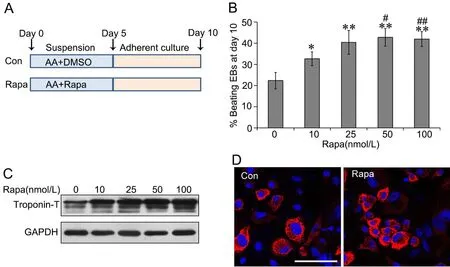
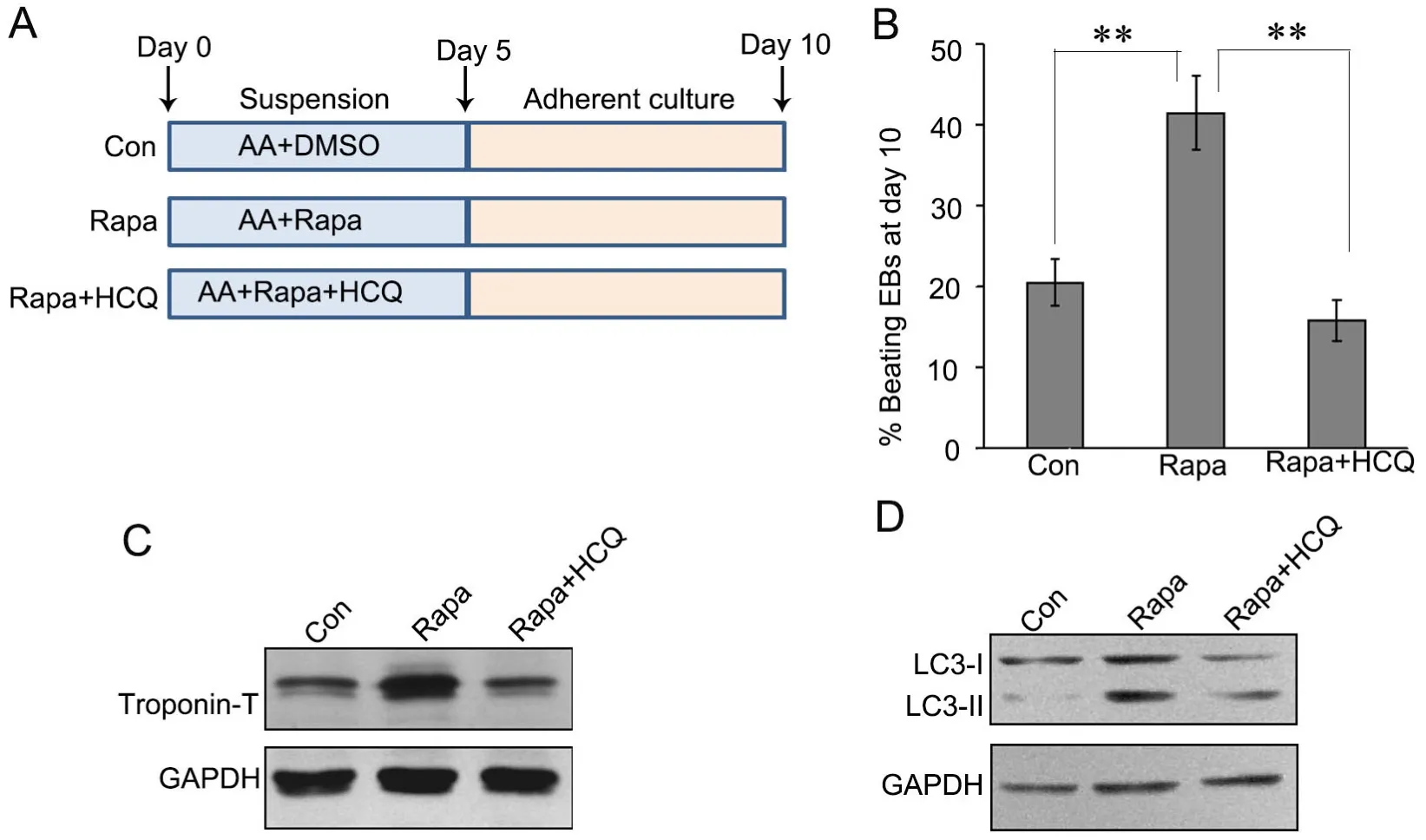
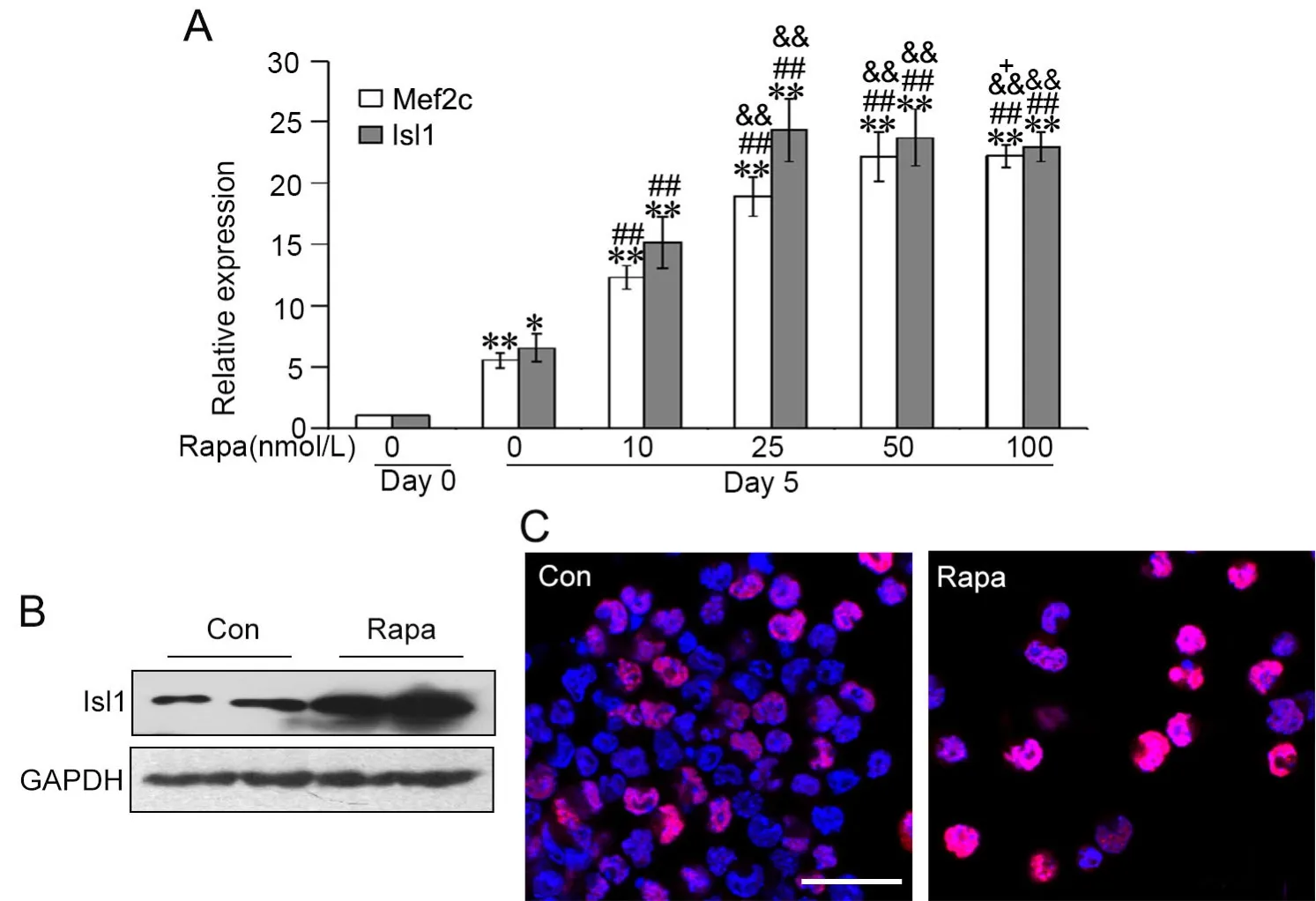
图1 ES细胞心肌分化流程及鉴定。 A,拟胚体法心肌诱导分化示意图,AA作为诱导剂。B,real-time PCR检测β-Mhc mRNA表达;与第0d组相比:*0.01 为了研究自噬对ES细胞心肌分化的影响,采用自噬激动剂雷帕霉素(Rapa)与AA联合诱导(在诱导第1~5d持续处理细胞,以DMSO为溶剂)(图2A)。在诱导分化第10d,统计产生自发搏动的EB球数量显示,Rapa组显著增强产生自发搏动的EB球数量,并随着Rapa浓度增加而递增(图2B);Western blot检测心肌细胞分化标志物troponin-T水平显示,Rapa显著上调troponin-T水平,并随Rapa浓度的增加而增加,其中25nmol/L有较好效果,且对细胞毒性较小(图2C)。免疫荧光染色显示,经25nmol/L Rapa处理能增强心肌细胞成熟标志物α-actinin免疫反应性(图2D)。 图2 雷帕霉素对ES细胞向心肌分化的影响。A,Rapa处理示意图。B,诱导分化第10d自发搏动的EB球百分比计数;与0nmol/L组相比:*0.01 采用自噬抑制剂羟氯喹(HCQ)联合Rapa处理ES细胞,阐释Rapa通过自噬通路影响心肌分化(图3A)。与单加25nmol/L Rapa相比,2μmol/L羟氯喹与25nmol/L Rapa联合处理细胞,诱导分化第10d自发搏动的EB球百分比显著降低,即2μmol/L HCQ完全抑制Rapa促进ES细胞向心肌分化的效果(图3B)。Western blot检测表明,HCQ抑制Rapa上调心肌分化标志物troponin-T水平(图3C)。LC3剪切是自噬的标志事件,自噬时胞质型LC3(LC3-I)会酶解掉一小段多肽,转变为自噬体膜型(LC3-II)。Western blot检测表明,在分化第5d,Rapa诱导LC3的剪切,而与HCQ的联合处理,LC3的剪切较单纯Rapa处理时明显减少(图3D)。这些证据表明,Rapa通过诱导自噬增强ES细胞向心肌分化,抑制自噬会导致这种分化效率降低。 图3 羟氯喹对雷帕霉素促进ES细胞向心肌分化的影响。A,2μmol/L HCQ和25nmol/L Rapa处理示意图。B,诱导分化第10d自发搏动的EB球百分比计数;*,0.01 为进一步阐释雷帕霉素的效应机制,通过real-time PCR检测了雷帕霉素对ES细胞心肌分化关键转录因子Mef2c和Isl1mRNA表达的影响。在未用Rapa处理的ES细胞培养5d后,Mef2c和Isl1 mRNA的表达增加;在Rapa处理5d的ES中,10nmol/L Rapa即显著增加Mef2c和Isl1 mRNA表达,25nmol/L Rapa时增加Mef2c和Isl1 mRNA表达达到高峰(图4A)。Western blot(图4B)和免疫荧光(图4C)检测也显示,25 nmol/L Rapa处理5d能上调Isl1水平。 图4 雷帕霉素对ES细胞Mef2c和Isl1表达的影响。A, Mef2c和Isl1 mRNA水平的real-time PCR检测;与诱导分化0天的0nmol/L Rapa组相比:*0.01 由于自噬通过降解冗余或损伤蛋白,维持细胞代谢稳定,因此,我们推测雷帕霉素可通过降解抑制心肌分化的因子,从而增强ES细胞向心肌细胞转化。Oct4是关键的干性基因,在维持ES细胞的多能性和自我更新具有极其重要的作用。Oct4在未分化ES细胞中高表达,一旦细胞分化,则快速降低。25 nmol/L Rapa处理ES细胞后,可极其显著地降低Oct4水平;而2μmol/L HCQ的联合处理,则阻断雷帕霉素对Oct4的降低。因此,本研究提示,雷帕霉素可能通过促进干性基因Oct4的降解,从而使细胞脱离未分化状态,在AA诱导下向心肌细胞分化。 自噬是真核生物细胞内进化保守、广泛存在的一种应激保护机制。自噬主要指细胞经溶酶体对细胞器、长寿命蛋白质进行降解,为细胞应激、修复再生提供基本原材料,从而实现氨基酸和能量物质的再循环利用。自噬有助于清除、降解细胞内受损的或衰老的细胞器和冗余的大分子,发挥保护性作用。在缺血缺氧、营养缺失、氧化应激或感染等不良因素刺激下,细胞可启动自噬来维护自身能量和代谢稳态,但是过度激活自噬可导致细胞死亡。mTOR是一个丝苏氨酸蛋白激酶,是调节自噬的重要通路。雷帕霉素通过抑制mTOR,促进细胞自噬。 除调控衰老外,自噬与发育分化关系密切。多个研究发现,自噬参与脂肪、血管、造血和神经分化[6,7]。在心脏发育的过程中,敲除自噬相关基因,会导致心脏发育障碍、异常环化、异常心室形态、瓣膜结构异常等,导致胚胎停育死亡[8]。多个研究显示自噬与干细胞心肌分化相关。有研究显示自噬通过p53通路减少细胞分化过程中的凋亡,从而促进心肌分化[9]。也有研究显示自噬促进β-catenin降解,从而抑制经典Wnt通路,促进晚期心肌分化[10]。本研究也证实雷帕霉素通过诱导自噬促进ES细胞向心肌分化,而羟氯喹则发挥相反的作用。 图5 雷帕霉素下调ES细胞Oct4水平。ES细胞经过雷帕霉素、羟氯喹处理5d,Western blot检测Oct4水平Fig.5 Rapamycin down-regulated the Oct4 level. ES cells were induced using AA in the presence of 25nmol/L Rapa with or without 2μmol/L HCQ for 5 days, and the level of Oct4 was detected by Western blot 既往研究发现雷帕霉素能促进心肌分化关键转录因子Gata4表达[11]。在本研究中,雷帕霉素处理促进心肌分化关键转录因子Mef2c和Isl1的表达。Mef2c属于肌肉增强因子2(myocyte enhancer factor 2,Mef2)家族。Mef2转录因子属于MADS超家族,其蛋白N端都具有一个保守的MADS盒和MEF结构域序列,包含Mef2a、Mef2b、Mef2c和Mef2d 4个家族成员。Mef2家族与骨骼肌、心肌、平滑肌的分化和功能调控关系密切,Mef2c在心脏发育中表达并且作为心脏特异的转录因子,参与心脏发育的各个过程,调节心脏特异基因的表达。通常,Mef2c与Gata4、Nkx2.5等心肌特异转录因子协同调控下游心肌功能性基因表达,如收缩功能蛋白α-Mhc和β-Mhc。Mef2c敲除会导致心脏发育严重障碍,多种心脏分化的标志基因表达降低或无法表达[12]。胰岛因子1(Islet-1,Isl1)属于LIM同源框转录因子家族,在成体组织中Isl1参与胰岛素分泌调控。研究发现,Isl1是重要的心肌前体细胞分化标志分子。Isl1在心脏早期的发育过程中必不可少,敲除Isl1导致小鼠心脏早期发育异常、胚胎死亡,其流出道、右心室以及大部分心房缺失[13]。系谱追踪发现Isl1是第二生心区心脏前体细胞的分子标志,心脏中2/3以上的各种类型细胞,包括心脏的起搏细胞、血管内皮细胞、血管平滑肌细胞和心肌细胞等均由Isl1+心脏前体细胞产生。Isl1发挥上述功能涉及到它与Gata4协同作用,激活心肌特异性基因Nkx2.5、Mef2C的表达[14-16]。 为何雷帕霉素能够促进心肌分化,促进Mef2c和Isl1表达?既往的研究显示,雷帕霉素单独不能诱导干细胞向心肌细胞分化,只能辅助增强心肌诱导分化效率[11]。我们推测,雷帕霉素通过诱导自噬,可能影响干细胞自我更新。既往研究显示mTOR通路促进ES细胞自我更新,抑制向中胚层和内胚层分化[17]。RNAi技术抑制mTOR,能促进Oct4、Sox2和Nanog含量降低,抑制干细胞自我更新,促进早期分化。Oct4、Sox2和Nanog是调控干细胞自我更新和未分化状态的关键转录因子,俗称干性因子。既往研究显示自噬能促进干性转录因子Nanog的降解,从而有利于ES细胞分化[18]。有研究发现,溶酶体阻断剂(巴弗洛霉素、氯喹等)处理人鼻咽癌细胞,Oct4会在细胞中出现大量累积,而通过qPCR检测Oct4的mRNA水平不变,提示Oct4可以通过自噬途径降解[19]。在本项研究中,我们发现,干性因子Oct4在分化过程中蛋白表达下调,而雷帕霉素促进Oct4的清除,羟氯喹阻碍这一过程。因此,我们的研究表明,雷帕霉素可能通过促进干性基因Oct4的降解,从而使细胞脱离未分化状态,在AA诱导下向心肌细胞分化。2 雷帕霉素促进ES细胞向心肌分化
3 羟氯喹拮抗雷帕霉素对ES细胞向心肌的分化
4 雷帕霉素促进心肌分化关键转录因子Mef2c和Isl1表达
5 雷帕霉素促进干性基因Oct4降解
讨 论