副流感病毒5型荧光定量RT-PCR检测方法的建立
2021-10-21吴华伟秦义娴陈晓春高金源薛青红陈延飞
吴华伟,秦义娴,陈晓春,高金源,邓 永,刘 丹,苏 佳,薛青红,陈延飞
(中国兽医药品监察所,北京 100081)
副流感病毒5型(Parainfluenza virus 5,PIV5)为单股负链不分节段的RNA病毒,属于副黏病毒科(Paramyxoviridae)副黏病毒亚科(Para-myxovirinae)腮腺炎病毒属(Rubulavirus),可引起犬、猫、猪、牛、仓鼠、豚鼠等多种动物及人呼吸道感染[1-2]。基因组大小为15246 nt,在副黏病毒科病毒中最小,遵循“六碱基原则”,其结构式为3'-NP-V/P-M-F-(SH)-HN-L-5',其中NP、P、L三种蛋白为PIV5病毒粒子的重要组成部分,为核衣壳的装配和指导病毒转录复制所必须,相互结合可形成核糖核蛋白体。L蛋白为多功能大蛋白,含有2256个氨基酸,分子量最大,常用作副粘病毒科遗传进化分析的靶基因或PIV5分子生物学检测的靶基因[3-4]。PIV5的检测方法有病原学方法(病毒分离、分子生物学检测和血凝试验等)和血清学方法(包括免疫荧光试验、中和试验、血凝抑制试验、酶联免疫吸附试验等)[5]。荧光定量RT-PCR具有特异性强、灵敏度高、检测时间短的优点,并能有效解决普通PCR污染问题,可作为常见病原核酸的检测方法。本研究针对PIV5 L基因保守区域筛选出一对特异性引物和探针,建立了一种特异性检测PIV5的Taqman荧光定量RT-PCR方法,以期为开展动物源性原辅材料中PIV5污染检测提供有效的技术手段。
1 材料与方法
1.1 病毒株 PIV5/01株、PIV5/02株,由中国兽医药品监察所分离、鉴定和保存。
1.2 主要试剂、试剂盒 AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit,Axygen公司产品;Reverse Transcriptase M-MLV(RNase H-),TaKaRa公司;快捷型琼脂糖凝胶DNA回收试剂盒II型(离心柱型),Bioteke公司;KOD FX Neo,TOYOBO公司;M-MLV III One-Step qPCR-PCR(Probe),北京博迈德公司;pEasy Blunt Simple、DNA分子量标准品(DL2000)、50×TAE电泳缓冲液,琼脂糖等,北京全式金公司。
1.3 主要仪器 台式离心机;旋涡振荡器;水浴锅;微量移液器1套(最大量程分别为10 μL、100 μL、200 μL、1000 μL)。
1.4 引物的设计与合成 根据GenBank中副流感病毒5型SER株(JQ743328.1)基因序列,针对L基因序列设计了一对引物和探针。上游引物(L119-F):5'-GACCAGAAAATTATTGAAT-3';下游引物(L119-R):5'-TACCAGGCACATGTGGGGTT-3'。预期扩增片段长度为119 bp。探针(L119-P):5'-FAM-TACTGAGTCGGGCCAAGTAGC-MGB-3'。引物和探针由华大基因公司合成。
1.5 标准质粒模板的制备 以提取的病毒总RNA为模板,先反转录为cDNA,反转录体系为20 μL:总RNA 10 μL,10 μmol/L下游引物1 μL,置70 ℃水浴5 min,冰浴2 min;然后依次加入5×M-MLV Buffer 4 μL、dNTP Mixture(2.5 mmol/L each) 2 μL、RNase Inhibitor(40 U/μL 0.25μL) 0.5 μL、RTase M-MLV(RNase H-)(200 U/μL) 0.5 μL、ddH2O 2 μL。反应条件42 ℃ 60 min,70 ℃ 15 min。以cDNA为模板进行PCR扩增。PCR反应总体系50 μL,其中2×PCR Buffer for KOD FX Neo 25 μL,dNTPs(2 mmol/L each)10 μL,L119-F(10 μmol/L)1.5 μL,L119-R(10 μmol/L)1.5 μL,KOD FX Neo 1 μL,ddH2O 6 μL,cDNA模板5 μL。反应程序为:94 ℃ 2 min;98 ℃ 10 s,52.9 ℃ 30 s,68 ℃ 15 s,30个循环;68 ℃ 10 min。将PCR产物经琼脂糖凝胶电泳分离,回收大小为119 bp的目的DNA片段,连接至pEasy Blunt Simple载体,经PCR和测序鉴定。质粒拷贝数计算公式copies/μL=6.02×1023×[质粒浓度ng/μL×10-9÷(碱基数bp×660)]。
1.6 荧光定量RT-PCR反应条件的优化 采用M-MLV III One-Step qPCR-PCR(Probe)说明书中推荐的反应体系,对反应体系中的引物浓度,探针浓度,退火温度等进行优化,以期找到最小的样本阈值循环数和最高荧光值,以及熔解曲线特异、检测灵敏度高、稳定性好的最佳反应条件。
1.6.1 退火温度的优化 荧光定量反应体系:One-Step qPCR Buffer(2×)10 μL,10 μmol/L上下游引物各0.8 μL,10 μmol/L探针 0.2 μL,病毒RNA 5 μL,补ddH2O 至20 μL。反应程序:45 ℃ 10 min;95 ℃ 2 min;95 ℃、5 s,温度梯度(62.0、61.6、60.6、59.2、57.1、55.7、54.7、54.0)℃ 20 s,40个循环。在延伸时收集荧光信号,报告基因设置为FAM。
1.6.2引物浓度优化 荧光定量反应体系:One-Step qPCR Buffer(2×)10 μL,10 μmol/L上下游引物各0.4、0.6、0.8、1.0 μL,10 μmol/L探针0.5 μL,病毒RNA 5 μL,补ddH2O至20 μL。反应程序:45 ℃ 10 min;95 ℃ 2 min;95 ℃ 5,54.7 ℃ 20 s,40个循环。在延伸时收集荧光信号,报告基因设置为FAM。
1.6.3 探针浓度的优化 荧光定量反应体系:One-Step qPCR Buffer(2×)10 μL,10 μmol/L上下游引物各1.0 μL,2 μmol/L探针(1、2、3、4、5 μL),病毒RNA 5 μL,补ddH2O至20 μL。反应程序:45 ℃ 10 min;95 ℃ 2 min;95 ℃ 5 s,54.7 ℃ 20 s,40个循环。在延伸时收集荧光信号,报告基因设置为FAM。
1.7 标准曲线的绘制 将阳性标准品做10倍系列稀释,分别稀释成1×109~1×101copies/μL共9个梯度,作为模板,进行荧光定量RT-PCR扩增,建立标准曲线。
1.8 特异性试验 将高致病性猪繁殖与呼吸综合症活疫苗(TJM-F92株)、猪繁殖与呼吸综合症活疫苗(CH-1R株)、伪狂犬病活疫苗(Bartha-K61株)、山羊痘活疫苗(AV41株)、小反刍兽疫活疫苗(Clone9株)、猪瘟病毒活疫苗(兔源)、猪瘟活疫苗(细胞源)、鸡新城疫活疫苗(LaSota株)、鸡传染性支气管炎活疫苗(H120株)、鸭瘟活疫苗、鸡传染性法氏囊病活疫苗(NF8株)、鸡传染性法氏囊病活疫苗(D-22株)、鸡马立克氏病火鸡疱疹病毒活疫苗(FC-126株)、鸡传染性喉气管炎活疫苗(K317株)、鸡痘鹌鹑化弱毒疫苗、PIV5/01株、牛副流感病毒3型、猪圆环病毒2型、猪传染性胃肠炎SCJY-1株、猪流行性腹泻SCSZ-1株、SIV-H1N1 LN株、SIV-H3N2 HLJ株、鸡新城疫病毒Clone30株、新生牛血清、胎牛血清、DMEM培养基、MEM培养基、199培养基、胰酶、牛血清白蛋白、蔗糖、脱脂牛奶、明胶、海藻酸钠等22种兽用生物制品、毒株及原辅材料按商品化核酸提取试剂盒说明书提取RNA或DNA(针对DNA病毒),按优化的反应条件进行扩增,以评估所建立方法的特异性。
1.9 敏感性试验 将阳性标准品10倍系列稀释为1×109~1×101copies/μL作为模板,用建立的副流感病毒5型TaqMan荧光定量RT-PCR检测方法进行敏感性检测。将测定好病毒含量的PIV5/02株10倍系列稀释后作为模板,提取RNA后用建立的副流感病毒5型TaqMan荧光定量RT-PCR检测方法进行敏感性检测。
1.10 重复性试验 以1×108~1×106copies/μL稀释的阳性标准品为模板,每个浓度的样品做3次重复,计算变异系数。分析所建立的荧光定量RT-PCR检测方法的可重复性。
2 结果与分析
2.1 PCR扩增和阳性重组质粒的鉴定 以制备的PIV5的cDNA为模板,对PIV5 L基因进行PCR扩增,大小为119 bp,与预期大小一致,结果见图1。目的片段阳性的重组质粒测序分析结果表明,成功构建了L基因的pEasy Blunt Simple阳性重组质粒。
2.2荧光定量RT-PCR反应条件的优化
2.2.1 最佳退火温度的确定 由图2可知,退火温度为54.7 ℃时,荧光定量扩增得到最小的Ct值及最高荧光值,确定为荧光定量反应的最佳退火温度。
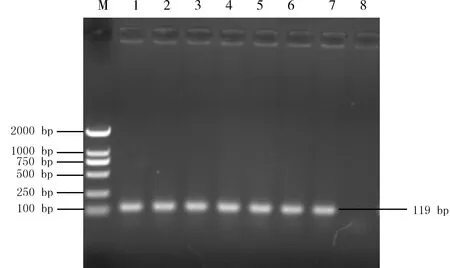
M:DL2000;1-7:L基因PCR产物;8:阴性对照M:DNA Marker;1-7:PCR-amplified L gene;8:Negative control图1 PIV5 L基因的PCR扩增及重组质粒的鉴定Fig 1 PCR amplification of L gene and identification of the recombinant plasmid
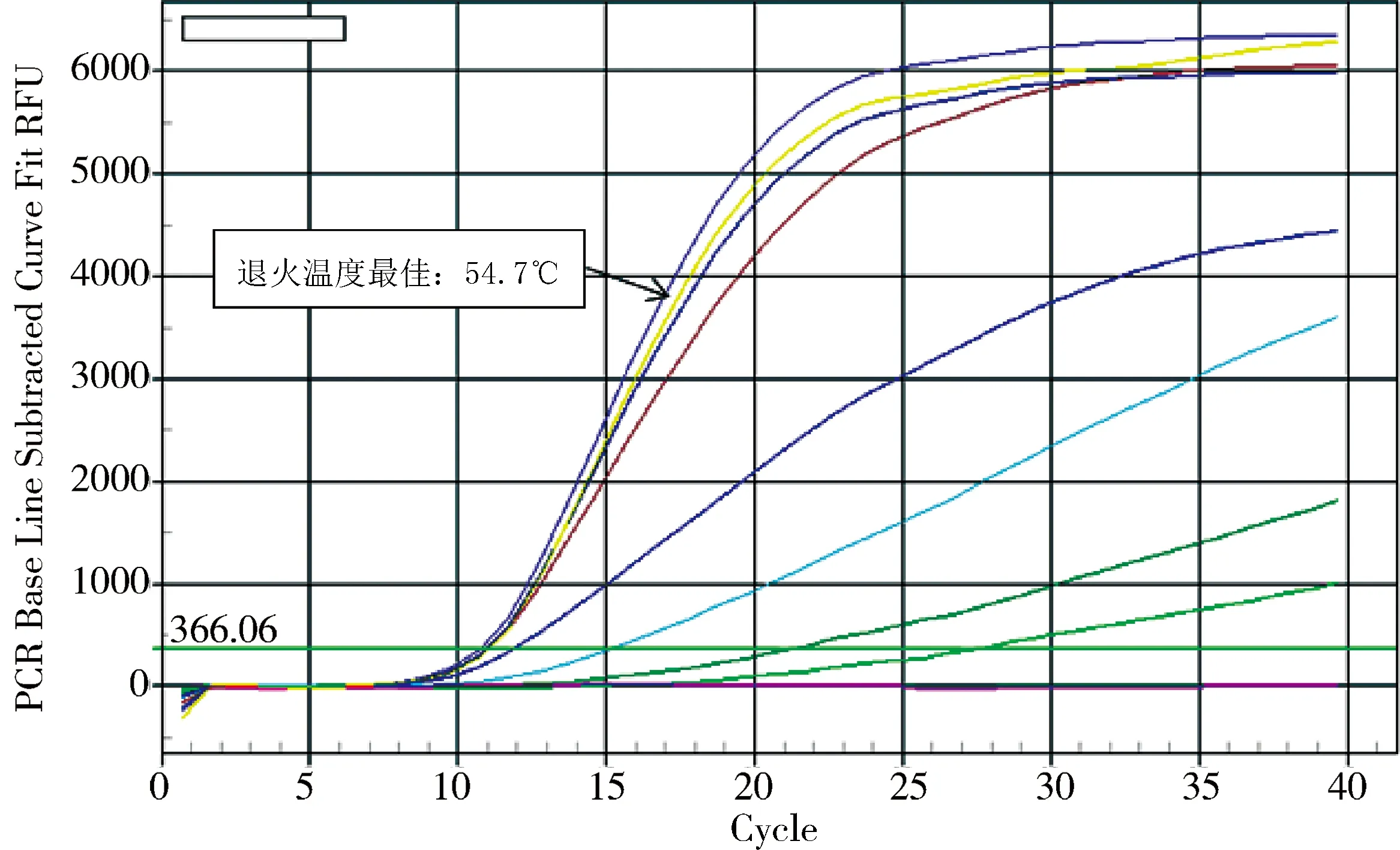
图2 最佳退火温度Fig 2 The optimal annealing temperature
2.2.2 最适引物浓度的确定 以退火温度为54.7 ℃进行荧光定量反应,最佳反应条件以得到最小的Ct值及最高荧光值为指标,最适引物浓度为0.5 μmol/L(图3)。
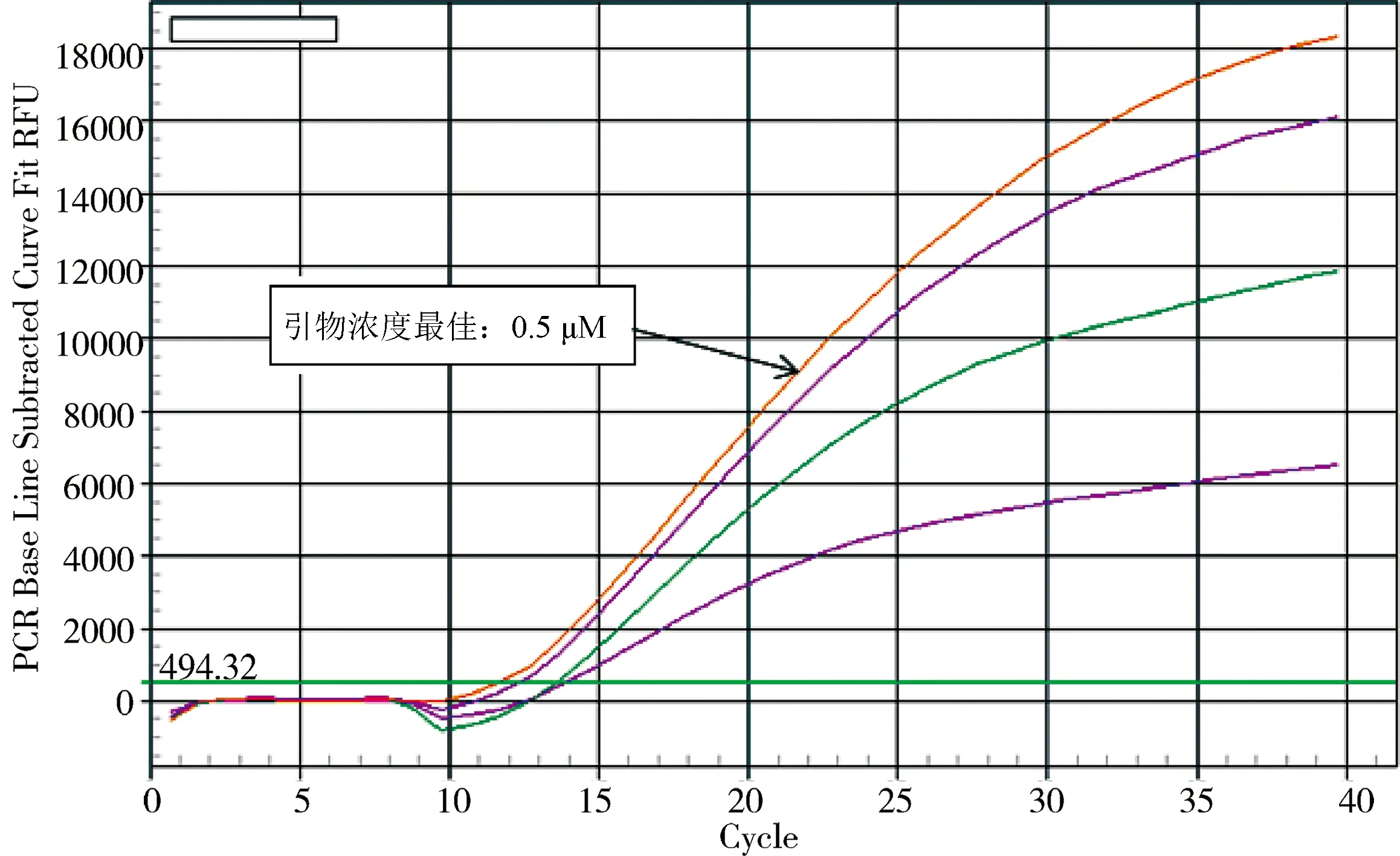
图3 最适引物浓度Fig 3 The optimum primer concentration
2.2.3 最适探针浓度 在确定最适退火温度和引物浓度的条件下,探针浓度为0.1 μmol/L时,荧光定量扩增得到最小的Ct值及最高荧光值,确定为荧光定量反应的最适探针浓度(图4)。
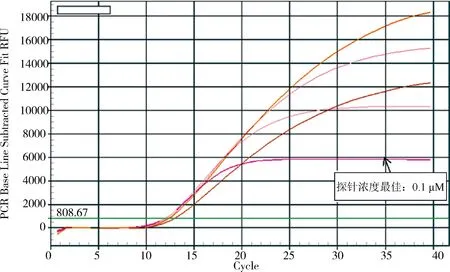
图4 最适探针浓度Fig 4 The optimum probe concentration
经过试验条件的优化,最终确定了最佳荧光定量PCR的反应条件:One-Step qPCR Buffer(2×)10 μL;酶0.6 μL;上游引物(10 μmol/L)1 μL;下游引物(10 μmol/L)1 μL;探针(10 μmol/L) 0.1 μL;模板5 μL;ddH2O 2.3 μL。反应条件:45 ℃ 10 min;95 ℃ 2 min;95 ℃ 5 s,54.7 ℃ 20 s,40个循环(PCR扩增)。在54.7 ℃延伸时收集荧光信号,报告基因设置为FAM。
2.3 标准曲线的绘制 将阳性标准品10倍系列稀释为1×109~1×101copies/μL 作为模板,以优化的特异性引物、探针、反应体系和反应条件进行荧光定量RT-PCR扩增,建立标准曲线。结果显示具有良好的线性关系。扩增效率E=92.6%,R2=0.995,标准曲线方程Y=-3.514X+41(图5)。
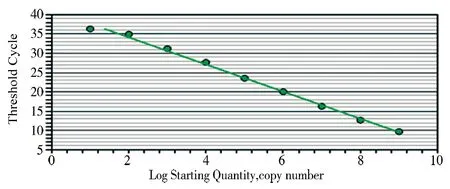
图5 L基因荧光定量RT-PCR的标准曲线Fig 5 Standard curve of Taqman fluorescent quantitative RT-PCR for L gene
2.4 特异性试验 选取了PIV5/01株、高致病性猪繁殖与呼吸综合症活疫苗(TJM-F92株)、猪繁殖与呼吸综合症活疫苗(CH-1R株)等22种兽用生物制品、毒株及原辅材料,用建立的方法,进行荧光定量RT-PCR扩增,结果显示除PIV5/01株外,其他样品均未检测到特异性扩增信号(图6),说明所建立的检测方法具有良好的特异性。
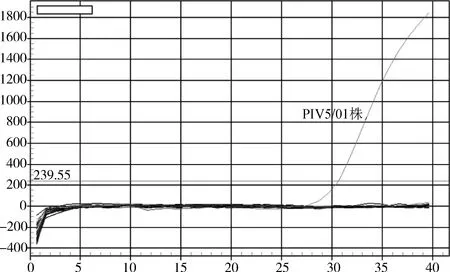
图6 PIV5 L基因荧光定量RT-PCR的特异性试验Fig 6 The specificity test of the Taqman fluorescent quantitative RT-PCR for PIV5 L gene
2.5 敏感性试验 以10倍稀释的标准品作为模板,按优化好的荧光定量RT-PCR反应条件进行扩增,其最小检出模板浓度为10 copies(图7)。将测定好病毒含量的PIV5/02株进行10倍系列稀释后作为模板,进行敏感性检测,其最小检出量为0.8 TCID50(图8)。
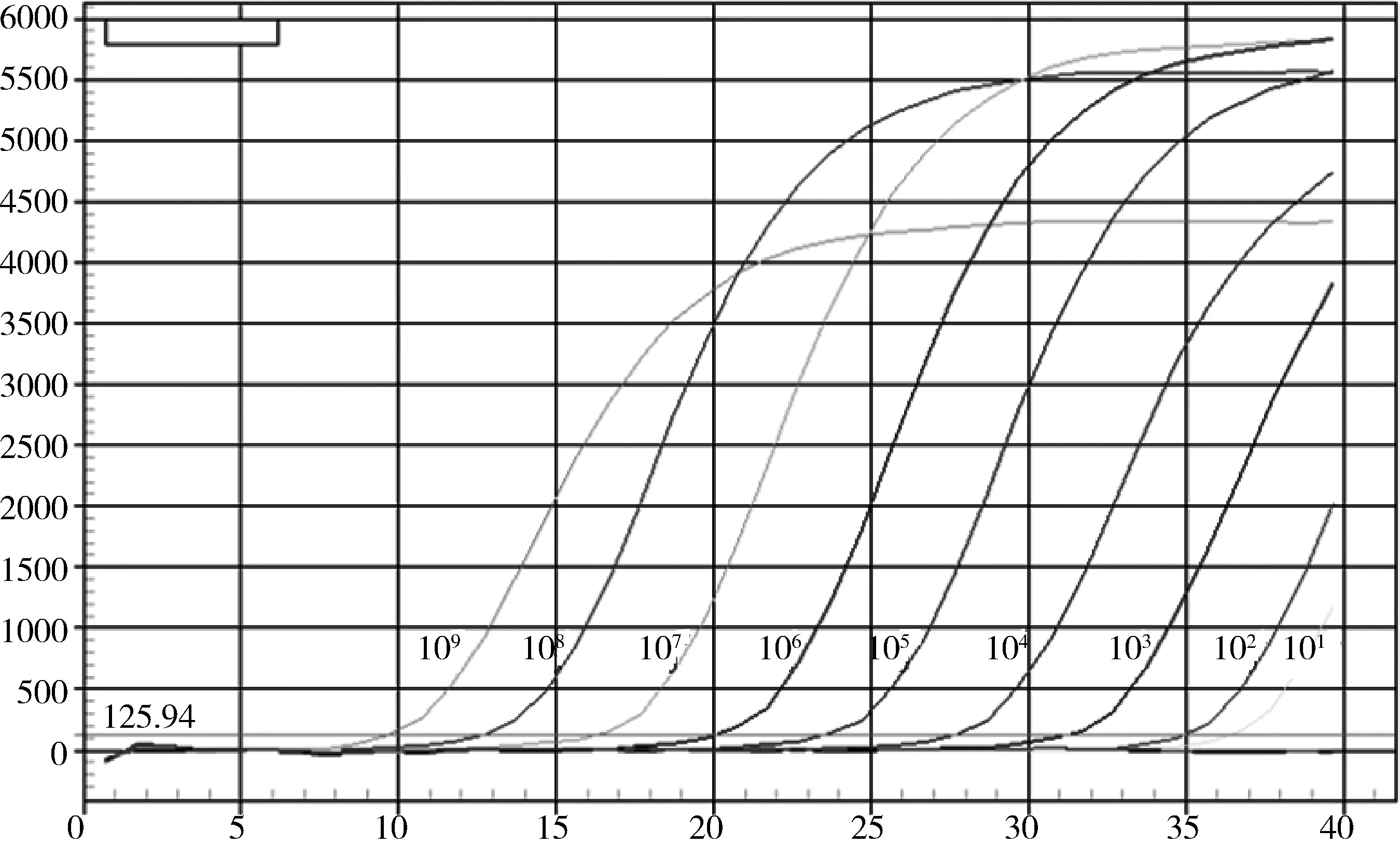
图7 敏感性分析的扩增曲线Fig 7 Amplification plots of the sensitivity test
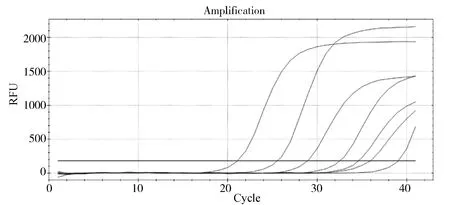
从左到右:分别代表800、80、8、0.8、0.08、0.008 TCID50PIV5/02株以及阴性对照的扩增曲线The curves from left to right represent 800、80、8、0.8、0.08、0.008 TCID50 PIV5/02 strain and negative control图8 对PIV5/02株检测灵敏度试验结果Fig 8 Amplification plots of the PIV5/02 strain
2.6 重复性试验 如表所示,不同模板浓度其变异系数均小于1.5%,表明所建立的荧光定量RT-PCR检测方法具有良好的稳定性(表1)。
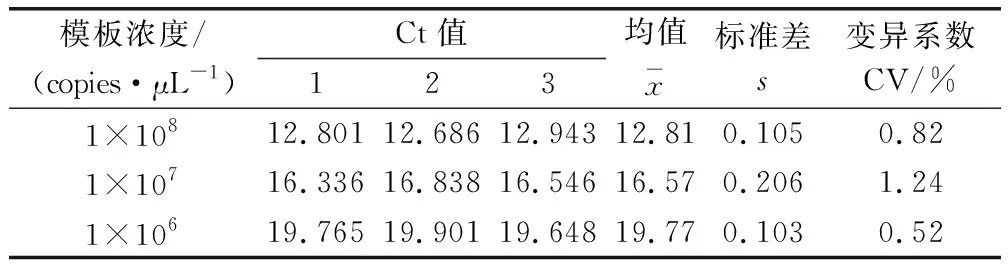
表1 稳定性试验Tab 1 Stability test of the Taqman fluorescentquantitative RT-PCR for L gene
3 讨 论
PIV5是近年来兽用生物制品用细胞和牛血清外源病毒检验中新发现的外源病原[6],具有血凝特性,可在Vero等细胞引起典型细胞病变,可作为该病原诊断的参考方法。目前用于诊断该病的方法有病毒分离鉴定、血清学方法和PCR等,上述方法存在费时、操作繁琐、无法定量等缺点,影响了对该病原的质量控制,成为目前兽用生物制品质量的潜在威胁,所以亟需建立一种特异、敏感、快速、简便、可定量检测PIV5的实时荧光RT-PCR方法,作为兽用生物制品企业加强动物源性材料控制的内控方法。国内已有商品化的PIV5荧光定量检测试剂盒,但大多都是染料法和两步法,为此本研究根据PIV5保守基因L基因进行设计一对特异性引物和一条探针,成功建立了一种一步法Taqman荧光定量RT-PCR检测方法,对PIV5 L基因重组质粒和PIV5/02株的最低检测限分别为10 copies和0.8TCID50,对22种常见猪病病毒、牛羊病病毒、禽病病毒和各种原辅材料均无交叉。在验证荧光定量检测方法的特异性时,DNA病毒直接提取DNA进行荧光定量检测,RNA病毒需要先提取RNA进行反转录然后再进行荧光定量检测。该方法显示出良好的敏感性和特异性,有望为保障我国兽用生物制品质量提供重要技术支撑。
