高效液相色谱-串联质谱法检测清肺止咳散中添加阿奇霉素含量
2021-10-21章安源张传津王洪涛陈志强李有志魏秀丽牛华星杨修镇薄永恒刘霄飞魏茂莲田学磊
章安源,张传津,王洪涛,张 琦,陈志强,李有志,魏秀丽,牛华星,杨修镇,薄永恒,刘霄飞,魏茂莲,田学磊,陈 玲 *
(1.山东省兽药质量检验所,山东省畜产品质量安全监测与风险评估重点实验室,济南 250022;2.潍坊海关,山东潍坊 261041;3.青岛信诺邦生物科技有限公司,山东青岛 266000,)
大环内酯类抗生素阿奇霉素抗菌谱广,临床上广泛用于治疗敏感菌所致呼吸道、皮肤和软组织感染[1-3]。有些养殖户在化痰清肺、平喘止咳等中兽药散剂中违规添加阿奇霉素, 目的是控制畜禽咳喘病的治疗,我国农业部在2005年8月曾发布了第560号令,取消了阿奇霉素作为兽药使用。非法添加人用抗生素,不仅易产生细菌耐药性问题,而且增加动物源性食品中阿奇霉素的残留风险。当前国内外尚无中兽药散剂中阿奇霉素的检测方法标准,仅有含量测定相关的液相色谱方法,专属性不强,且中药组分的干扰较大,本实验拟建立高效液相色谱-串联质谱方法检测中兽药散剂中违规添加的阿奇霉素含量,为中兽药单方或复方制剂中非法添加阿奇霉素含量的定性、定量检测提供技术支撑。
1 材料与方法
1.1 仪器 AE-240电子天平(瑞士Mettlrer Toledo 公司); Agilent 1260-6460高效相色谱四极杆电离喷雾串联质谱仪(美国安捷伦公司); KQ-250DB超声仪(昆山市超声仪有限公司),5810R高速冷冻离心机(日本日立公司),0.22 μm的滤膜为美国Waters 公司。
1.2 药品及试剂 阿奇霉素(来源:CAS公司,编号:83905-01-5,纯度≥97%)。甲酸、乙腈(色谱纯,德国Merk公司,);超纯水。高纯氮,高纯氩(纯度均为99.99%,济南德阳气体有限公司。
1.3 色谱条件 色谱柱:Agilent ZORBAX Eclipse Plus C18色谱柱,100 mm×3.0 mm,粒径2.7 μm,或性能相当者;流动相A:乙腈;流动相B:水溶液(0.1%甲酸);流速:0.3 mL/min;进样量:10 μL;柱温:40 ℃。高效液相色谱梯度洗脱程序见表1。
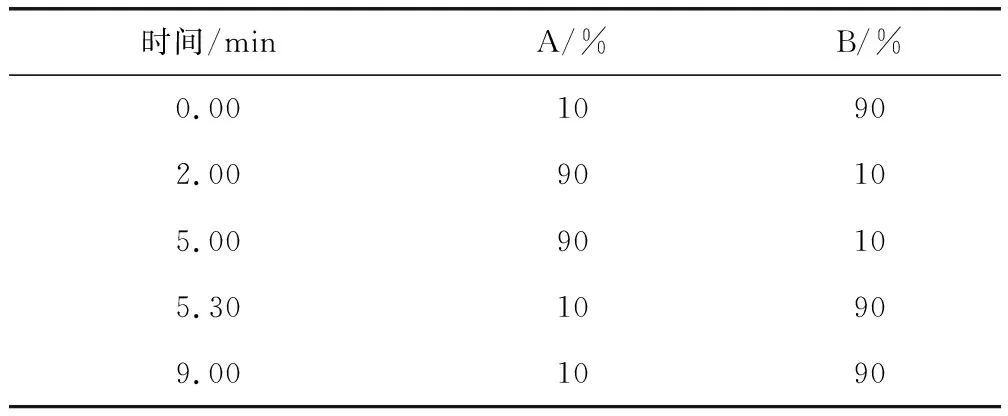
表1 梯度洗脱程序Tab 1 Program of gradient elution
1.4 质谱条件 电离方式:电喷雾离子源;扫描方式:正离子扫描(ESI+);检测方式:多反应监测(MRM);干燥气温度:350 ℃;干燥气流量:9.0 L/min;鞘气温度:250 ℃;鞘气流速:11.0 L/min;碰撞气:40 psi;毛细管电压:4 kV;测试药物定性、定量离子和碰撞能量见表2。

表2 质谱测定参数Tab 2 Mass Spectrometric Determination of Parameter
1.5 样品制备
1.5.1 阴性样品 清肺止咳散,来源:山东某兽药企业;批号20201101。
1.5.2 标准储备液的制备 精密称取阿奇霉素标准品10.31 mg(准确至0.01 mg),置10 mL容量瓶中,加乙腈溶解并稀释至刻度,摇匀, 即得1000 μg /mL标准储备液。-20 ℃冰箱保存,贮存期3个月。
1.5.3 样品溶液的制备 准确称取1.5.1项下样品0.2 g(精确到0.001 g)于250 mL三角烧瓶中,加入50 mL 40%乙腈溶液超声提取15 min,转移至100 mL容量瓶中,加初始流动相(1.3)稀释至刻度。用滤纸过滤,收集续滤液。准确吸取续滤液1.0 mL,至10 mL容量瓶中,用初始流动相(1.3)稀释至刻度,摇匀,滤膜过滤,过滤液待测。同时按上述步骤做样品空白试验。
1.5.4 空白基质溶液的制备 称取0.2 g 样品50 份,按照1.5.3项下方法处理后即得空白基质溶液。
1.5.5 基质匹配标准储备溶液的制备 精密量取标准储备液1 mL,置100 mL容量瓶中,加空白基质溶液稀释至刻度,摇匀,滤过,即得10 μg /mL的基质匹配标准储备溶液。
1.5.6 阳性添加样品的制备 准确称取阿奇霉素5、10、20、50 mg加入到阴性空白散剂样品100 g中,混匀,即每1 kg分别添加阿奇霉素50、100、200、500 mg,每个添加量制备3份平行样,按待测样品制备方法(1.5.3项)制备阳性添加样品,在上述液相色谱条件(1.3项)和质谱条件(1.4项)进行测定,每份样品至少进样2次,取平均值。
1.5.7 基质标准曲线的制备 准确吸取5.0 mL基质匹配标准储备溶液(10 μg/mL),至100 mL容量瓶中,用空白基质溶液稀释至刻度,摇匀,得500 ng/mL的基质标准溶液。分别吸取500 ng/mL的基质标准溶液适量,用空白基质溶液倍比稀释,得5、10、25、50、100、125、250 ng/mL的标准物质系列工作液。
2 结果与分析
2.1 线性考察 在选定的色谱条件下,使用梯度洗脱的方法,可有效地分离各离子。5、10、25、50、100、125、250 ng/mL的基质匹配标准溶液,经高效液相色谱-串联质谱仪测定后,以标准溶液中阿奇霉素定量离子峰面积为纵坐标,标准溶液中相应的阿奇霉素浓度为横坐标,绘制基质标准曲线。阿奇霉素在5~250 ng/mL范围内标准曲线线性回归方程为Y=1309.94X+119.96,其决定系数R2为0.9993,线性关系良好。
2.2 精密度试验 精密吸取基质匹配标准溶液50 ng/mL(10 μL),连续进样6次。以峰面积计算,得出阿奇霉素峰面积的RSD(相对标准偏差)为1.8%。表明仪器精密度良好,符合检测要求。
2.3 稳定性试验
2.3.1 标准溶液稳定性 配制阿奇霉素标准储备液将其分装为3瓶,分别将其储存在冷冻、冷藏和室温条件下,每周稀释上机,考察稳定性。实验数据表明,-20 ℃和4 ℃储存的标准储备液3个月内无明显差异,25 ℃存储条件下略有差异。结果见表3。

表3 标准储备液稳定性考察Tab 3 Stability of standard stock solution
2.3.2 基质添加阿奇霉素稳定性 清肺止咳散中添加阿奇霉素(50 mg/kg)后,分别将其储存在冷冻、冷藏和室温条件下,稀释至10 ng/mL上机,并且每周将不同储存状态下的标准储备液和中间液进行稀释上机,即用第0天的数据为标曲单点对每周的数据进行校正。实验数据表明,在冷冻(-20 ℃)条件下储存的标准90 d内,无降解。而在室温条件下储存的阿奇霉素储备液从第2个月开始出现降解;阿奇霉素中间液从第1个月就开始出现降解,第2个月时已经出现明显降解。结合实验数据和GB/T 27404-2008推荐的有效期,阿奇霉素储备液和中间液的有效期最终定为3个月。结果见图1。
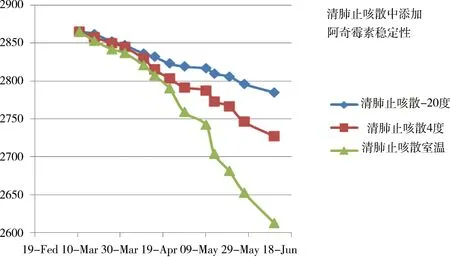
图1 清肺止咳散添加阿奇霉素溶液稳定性Fig 1 Stability of Qingfeizhike powder added azithromycin solution
2.4 回收率试验 50、100、200、500 mg/kg四个添加浓度下,平均回收率在89.1%~98.6%(表4)。批内相对标准偏差<1.6%,批间相对标准偏差为4.1%。

表4 回收率和精密度试验结果(n=3)Tab 4 Result of recovery and precision for azitromycin
2.5 检出限和定量限 空白基质按确定的步骤处理后,测定结果表明:在相应的保留时间,空白基质对所测分析物无干扰。在空白样品中添加阿奇霉素标准品,按确定的提取方法处理后,经高效液相色谱-串联质谱仪检测,计算信噪比。添加浓度为25 mg/kg时,标准溶液信噪比(S/N))≥3,确定为方法的检出限。添加浓度为50 mg/kg时,标准溶液显示信噪比(S/N))≥10,作为此方法定量限。检测限和定量限满足检测要求。
2.6 质谱图 空白样品、对照溶液及阳性添加样品的高效液相色谱-串联质谱图见图2~图4。
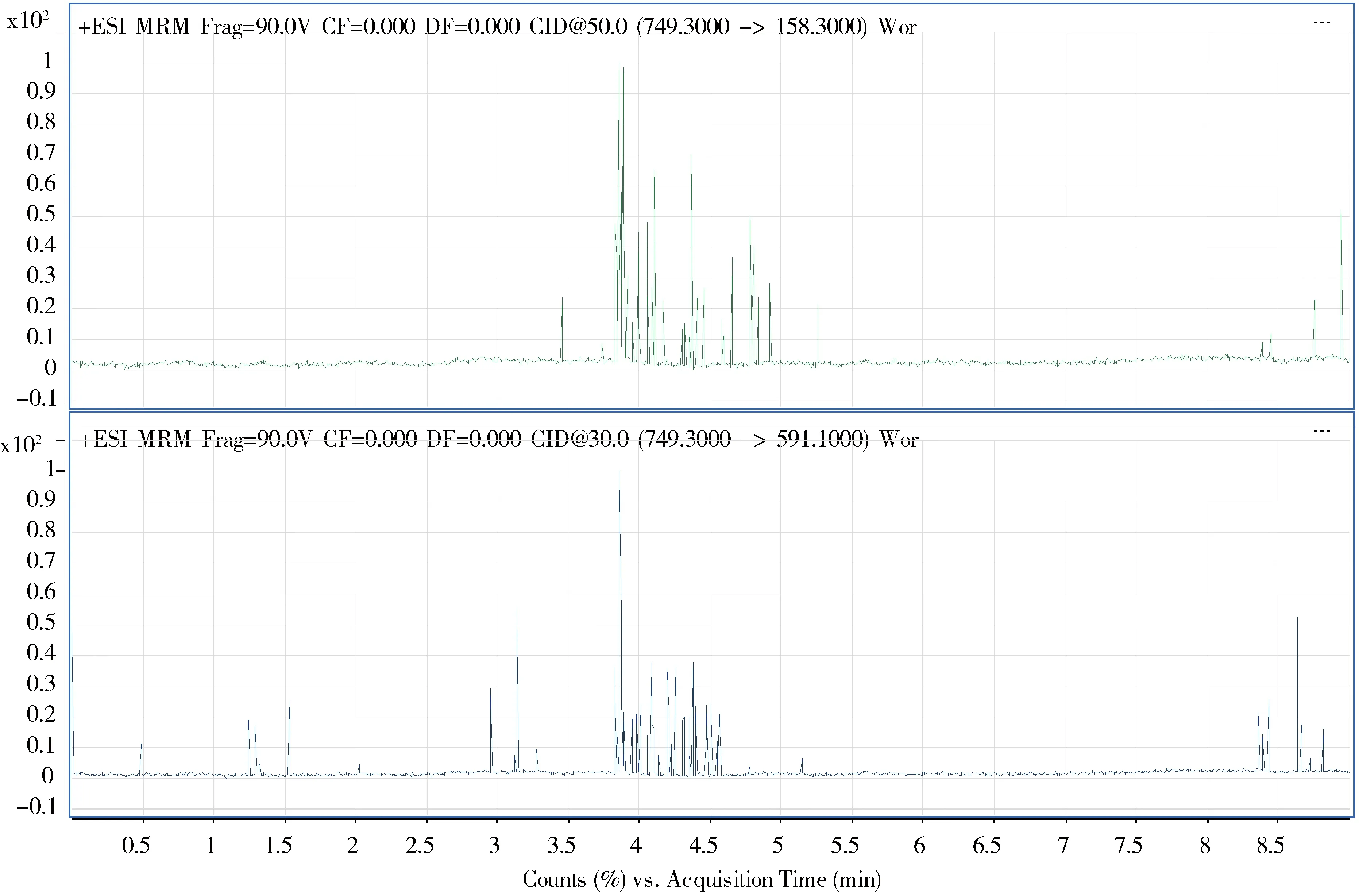
图2 空白样品特征离子质量色谱图Fig 2 Extraction ion chromatograms of the blank sample
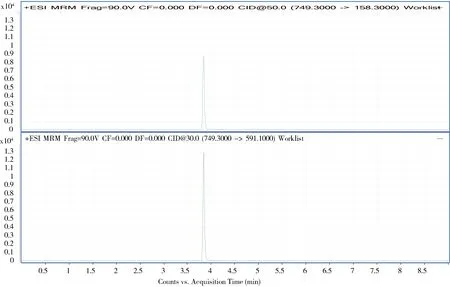
图3 对照溶液提取离子色谱图Fig 3 Extraction ion chromatograms of the contrast solution
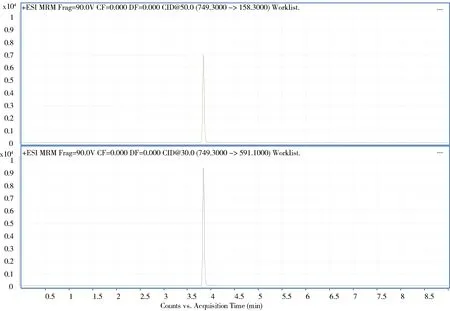
图4 阳性添加样品特征离子质量色谱图Fig 4 Extraction ion chromatograms of the positive added sample
3 讨论与结论
3.1 前处理方法的选择与优化 为确保散剂中添加阿奇霉素有效成分全部溶解,分别用甲醇、乙腈、水、20%乙腈水、40%乙腈水、60%乙腈水、80%乙腈水、乙腈:0.1%甲酸水(40∶60)、乙腈:0.2%甲酸水(40∶60)、乙腈:0.5%甲酸水(40∶60)对不同批号的样品稀释并超声提取。结果发现甲醇、水提取时,提取得到供试品杂质成分多,回收率不高;用乙腈提取后的提取液较为清澈,基质干扰小。因为阿奇霉素在中性水溶液中相对较稳定,因此,决定调节乙腈和水的比例,实验结果发现,40%乙腈水提取后的供试品溶液基质干扰最小。阿奇霉素属于弱碱性化合物,易溶于酸性水溶液[4],为进一步确定甲酸水的用量,研究比较甲酸0.1%、0.2%、0.5%用量时,结果表明甲酸用量为0.1%时,超声提取15 min,且基质效益无明显差别,杂质干扰少,峰形对称,阿奇霉素回收率较高。故选择初始流动相处理样品。基质匹配标准溶液采用空白基质溶液定容,空白基质溶液在与阿奇霉素对照品相同保留时间处,均无色谱峰出现,证明在很大程度上基质效应小,实验准确度高。
3.2 液相色谱条件的选择与优化 本实验分别考察甲醇-0.1%甲酸水溶液和乙腈-0.1%甲酸水溶液分离情况,摒弃了乙腈-0.01 mol/L磷酸二氢钾溶液(12∶88)作为流动相,降低了色谱柱因磷酸盐易堵的风险[5-8]。不断调整流动相比例:甲醇和乙腈由30%下降到10%,最终选择了乙腈-0.1%甲酸水(1∶9,体积比)为初始流动相,不仅能使阿奇霉素很好的分离,其特征离子质量色谱图的峰形和分离度好,降低了检测成本,有机试剂使用量较少,有利环保。
3.3 质谱条件的选择与优化件的选择与优化 采用1.0 μg/mL的阿奇霉素标准溶液在不接色谱柱的条件下,分别用电喷雾电离正离子模式(ESI+)和负离子模式(ESI-)进行母离子全扫描。结果发现,阿奇霉素正离子模式的[M+H]+为m/z749.3,负离子模式下的[M-H]-为m/z747.3,[M+H]+信号远远高于[M-H]-。在正离子模式(ESI+)下对阿奇霉素进行二级质谱全扫描,得到m/z591.1、m/z158.3、m/z116.1、m/z83.1四个相对信号较高的子离子。利用安捷伦Optimizer软件对阿奇霉素的子离子碎裂电压、碰撞能量等参数进行进一步的优化,获得最佳的仪器条件。结合样品基质的质谱图最终选取离子丰度最高、本底干扰最小的m/z749.3>591.1作为定量离子,m/z749.3>158.3作为定性离子。
本实验建立了中兽药散剂中非法添加阿奇霉素含量的高效液相色谱-串联质谱法检测方法。实验过程简单、快速,回收率较高,各项性能指标均达到了行业标准要求,同时基质干扰小,检测结果准确可靠,检出限低,灵敏度高,适用于清肺止咳散中非法添加阿奇霉素的定性、定量检测,为治理整顿中兽药中添加违禁药物,提供了检测参考和技术支撑。
