口腔鳞状细胞癌外周血循环肿瘤细胞检测及其临床意义
2021-10-21张帅源秦硕李光辉易雅群付昊杰高雅靖孙明磊
张帅源 秦硕 李光辉 易雅群 付昊杰 高雅靖 孙明磊
郑州大学第一附属医院口腔颌面外科,郑州450052
口腔颌面部恶性肿瘤是全球十大恶性肿瘤之一,其中约90%为鳞状细胞癌,其次为腺性上皮癌,间叶组织来源肿瘤少见[1]。过度饮酒、吸烟、咀嚼槟榔、不良习惯及长期物理化学因素的刺激是口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)最主要的发病因素,近年来有文献[2-4]报道人乳头状瘤病毒(human papilloma virus,HPV)也与OSCC发病有关。肿瘤的转移和复发是影响患者预后最主要因素,随着手术与放、化疗等医疗手段的进步,OSCC患者的预后虽得到相当的改善,但5年生存率仍低于50%[5],因此寻找一种更为简便且有效的临床评价指标尤为重要。
循环肿瘤细胞(circulating tumor cells,CTCs)是一种有远处转移倾向的,短暂的肿瘤转移前体细胞。在1869年由Thomas Ashworth提出,他发现肿瘤患者血液里存在与自身瘤体相同的细胞组织,该发现后续在1954年被Watanabe等证实。CTCs与肿瘤转移关系密切[6],由于CTCs本身来源于肿瘤组织,与肿瘤组织具有相同的遗传物质[7],将其用于肿瘤的识别和定性,特异性极高[8]。但是外周血中的CTCs含量极少,检测难度较高,理想的CTCs检测方法必须能够分离并检测所有异质CTCs,同时丢弃正常血细胞的大背景[9]。随着检测技术的进步,最新的阴性富集及靶向聚合酶链反应(polymerase chain reaction,PCR)检测技术成功解决了上述问题,该方法基于CTCs与正常血细胞表面抗原CD45+之间的表达差异,利用免疫磁珠将两者分离并最大限度的将CTCs纯化,大幅提高了检测质量[10],这使CTCs在恶性肿瘤的辅助诊断、判断疗效和预后等方面受到越来越多的关注[9]。但目前CTCs与OSCC相关性的研究报道较少见。叶酸受体(folate receptor,FR)是一组跨膜蛋白,分为α、β和γ三种亚型,由于FR在人体大部分的肿瘤细胞中都有特异性高表达,如卵巢癌、肺癌,而在正常组织中少有表达,是一种理想的CTCs检测靶点[11]。据文献[12]报道,OSCC组织中亦可见FR高表达,本研究应用的阴性富集及靶向PCR(FR+CTC)检测技术即利用该点,以肿瘤表面FR为靶点,检测OSCC患者外周血的CTCs,分析其与肿瘤患者病理分期、病理亚型、淋巴结转移、分化程度、临床分期等临床病理特征间的关系,探讨CTCs检测的价值和应用前景。
1 材料和方法
1.1 一般资料
选择2019年5月—2020年5月在郑州大学第一附属医院确诊的93例OSCC患者为试验组,同期选取20例健康志愿者为对照组。试验组中,男64例(68.8%),女29例(31.2%),年龄25~78岁,平均年龄(51.50±12.53)岁;对照组中,男9例(45%),女11例(55%),年龄22~69岁,平均年龄(44.60±12.66)岁。
本研究纳入标准:1)病理诊断为鳞状细胞癌;2)除OSCC外无其他部位原发恶性肿瘤以及严重全身性疾病;3)入院前未接受放化疗及手术等其他相关治疗。排除标准:1)入院前曾接受放化疗及手术等其他相关治疗;2)严重感染或肝肾功能严重异常;3)生活不能自理或不能配合治疗者。
1.2 CTCs的富集与检测
CTCs的检测采用负向富集及靶向PCR检测技术。严格遵循采血标准,取患者3 mL静脉血,血样中加入红细胞裂解液孵育,红细胞裂解后离心,加入CD45+磁珠结合白细胞,用磁场捕获并去除白细胞,剩余富含CTCs的细胞群,加入特异性探针(针对表达FRα的细胞设计,由靶向FR的叶酸单元与共价偶联的寡核苷酸单元组成)标记CTCs,离心,去除上清液游离探针,加入洗脱剂,洗脱与CTCs特异性结合的探针,制备待测样品,加入PCR扩增试剂后进行荧光实时PCR扩增(PCR扩增模板的寡核苷酸单元序列为:5’-CTCAACTG‐GTGTCGTTGGGCAATTCAGTTGATTCTAA-3’),经数据分析,计算出3 mL血样中CTCs的含量。
1.3 统计学方法
采用R4.0.0(R Foundation for Statistical Com‐puting,澳大利亚)统计软件进行数据分析,单组间比较使用了Kruskal-Wallis检验,多组间使用Mann-Whitney U检验。采用受试者工作曲线(re‐ceiver operating characteristic curve,ROC)分析外周血CTCs对OSCC相关的诊断价值,并通过其敏感度和特异性来计算约登指数。多因素分析采用线性回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 2组外周血CTCs值的比较
OSCC患者的术前CTCs值中位数=10.8,四分位范围=[9.7,13.6],对照组的CTCs值中位数=8.00,四分位范围=[7.67,8.10],试验组显著大于对照组(P<0.000 1)(图1)。
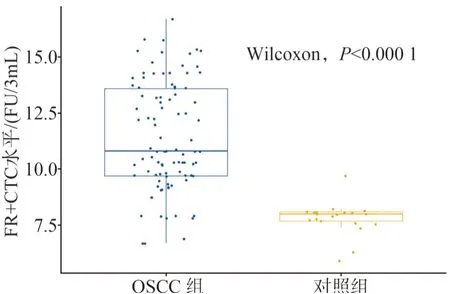
图1 OSCC组与对照组CTCs的比较Fig 1 Comparison of CTCs values between OSCC group and the control group
2.2 外周血CTCs与OSCC临床病理特征的关系
外周血CTCs与患者的性别、周围组织浸润、发病部位等无关(P>0.05)。与患者的年龄(P=0.022)、OSCC的分化程度(P<0.001)、淋巴结转移(P=0.006 4)、肿瘤T分期(P=0.02)、N分期(P=0.007 5)及临床分期(P=0.029)、早晚期相关(P=0.022)等相关,差异均有统计学意义(P<0.05)。M1期患者CTCs值较M0期显著增高,Ⅲ+Ⅳ期患者CTCs值高于Ⅰ+Ⅱ期者,差异均有统计学意义(P<0.05)(表1、图2)。
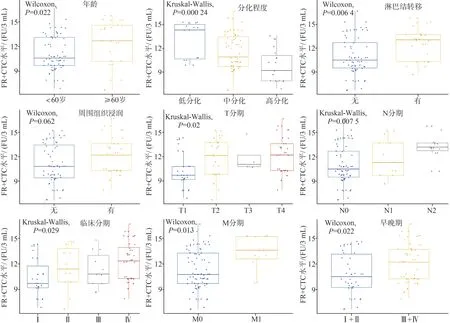
图2 CTCs与OSCC临床病理特征的关系图Fig 2 The relationship between CTCs and clinicopathological features of OSCC patients
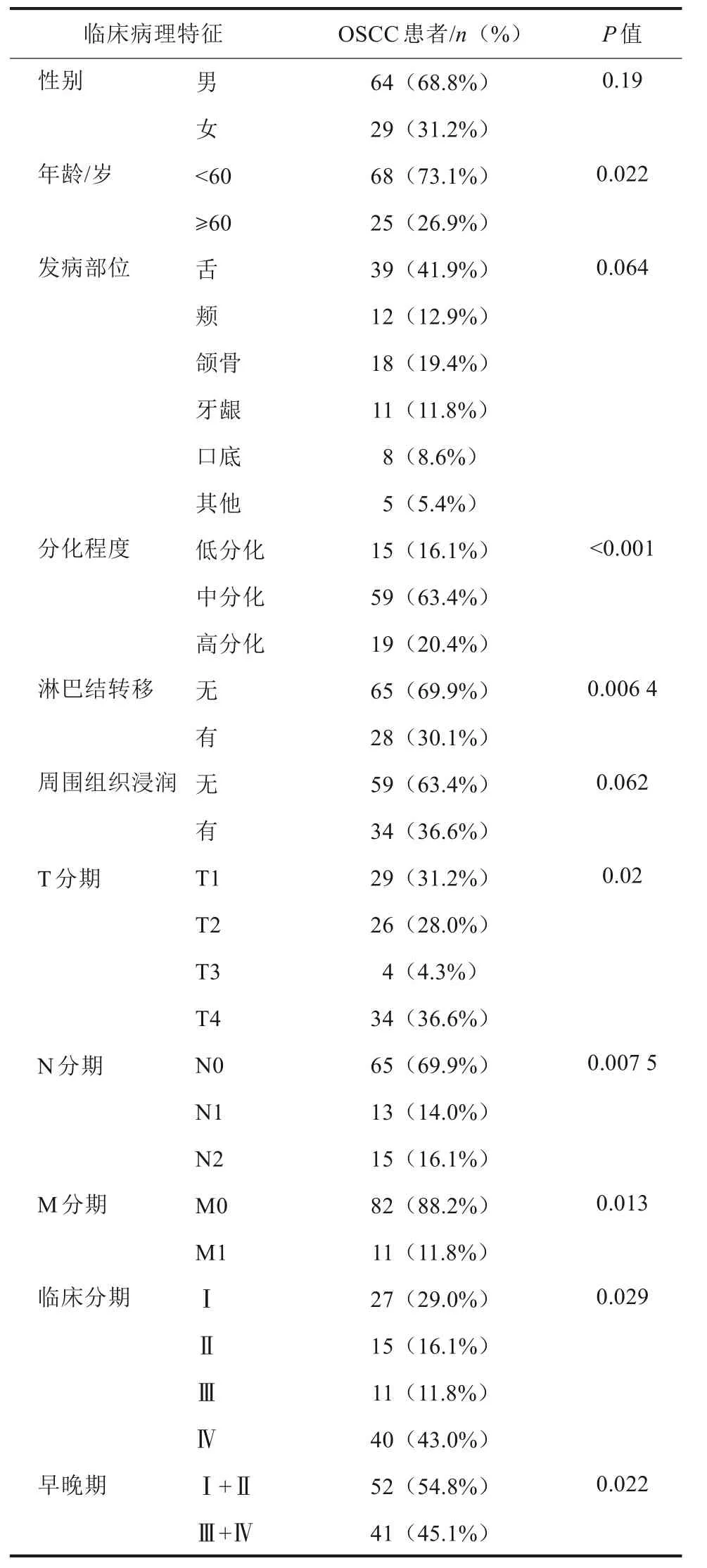
表1 OSCC患者外周血CTCs与临床病理特征的关系Tab 1 The relationship between CTCs and clinico‐pathological features of OSCC patients
2.3 CTCs诊断价值分析
2.3.1 外周血CTCs检测对OSCC的诊断价值 应用CTCs诊断OSCC的AUC值为0.925,检验能效性有统计学意义[P=0.000,95%CI(0.876,0.974)],当CTCs值为8.450 FU/3 mL时,约登指数最大为0.853,敏感度90.3%,特异性95.0%(图3)。
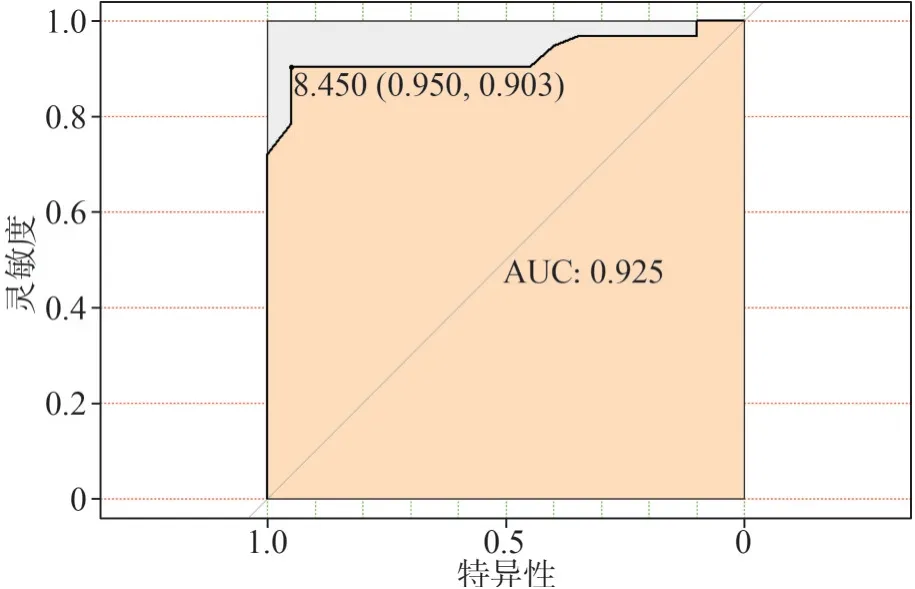
图3 CTCs用于诊断OSCC的ROC曲线Fig 3 The ROC curve of CTCs in diagnosis of OSCC
2.3.2 外周血CTCs检测对OSCC转移的诊断价值应用CTCs诊断OSCC转移的AUC值为0.691,检验能效性有统计学意义[P=0.000,95%CI(0.580,0.803)],当CTCs值为12.250 FU/3 mL时,约登指数最大为0.367,敏感度63.6%,特异性73.3%(图4)。
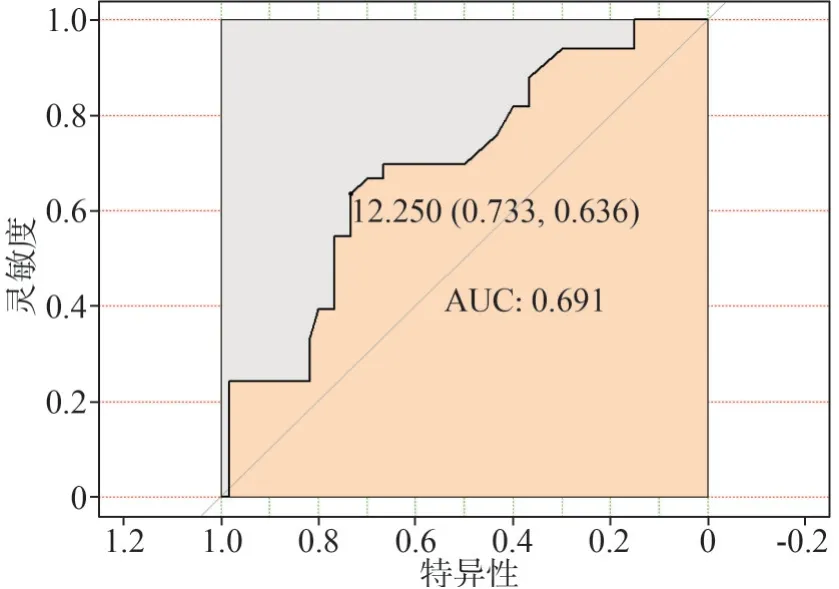
图4 CTCs用于诊断OSCC转移的ROC曲线Fig 4 The ROC curve of CTCs in diagnosis of OSCC metastasis
2.4 CTCs与OSCC患者临床病理特征之间的多因素回归分析
将单因素分析中P<0.2的变量全都纳入到了多因素线性回归模型中。纳入的变量包括性别、年龄、发病部位、分化程度、周围组织浸润、淋巴结转移、T分期、N分期、M分期以及临床分期等。使用逐步回归法筛选变量,得到以下模型。肿瘤原发于颊部与OSCC患者CTCs值呈负相关(P=0.001 08);N2分期(P=0.000 74)及M分期(P=0.026 38)与OSCC患者CTCs值呈正相关;肿瘤分化程度中高分化(P<0.000 1)和中分化(P=0.001 5)与OSCC患者CTCs值呈负相关,分化越高,CTCs值越低。

表2 CTCs与OSCC患者临床病理特征之间的多元素回归分析Tab 2 Multielement regression analysis of clinicopathological features between CTCs and OSCC patients
3 讨论
在OSCC临床诊治中发现有部分TNM分期较早的患者,虽无远处转移证据,并接受了根治性手术,但仍在一段时间后发生了肿瘤的复发或转移,考虑这部分早期OSCC患者术前已发生了微转移,此前常规的术前临床检查手段并不能及时发现肿瘤的亚临床病灶[13],随着医疗水平的提高,近年来应用CTCs等“液体活检”技术为筛查OS‐CC提供了新的思路[14-16]。
CTCs是存在于外周血中的各类肿瘤细胞的统称,因自发或诊疗操作从实体瘤病灶脱落,进入外周血循环的肿瘤细胞,并可以在一定条件下发展为转移灶[17]。肿瘤释放至外周血中CTCs的多少,可直接的反映出肿瘤发生、发展的功能状态。在乳腺癌[18]、肺癌[19]等肿瘤中,CTCs已成为了较可靠的肿瘤标记物,用于评估患者的治疗效果、无进展生存期和预后[20]。CTCs在口腔颌面部肿瘤中的研究起步稍晚,Buglione等[21]研究表明CTCs在头颈部肿瘤患者中表达水平与肿瘤分期、肿瘤负荷、淋巴结及远处转移这些高危参数显著相关。
目前CTCs检测方法较多,各类方法灵敏度及特异性参差不齐。本研究采用的阴性富集及靶向PCR检测技术较为先进,有较高的临床参考价值。通过检测,单因素分析中OSCC患者外周血CTCs与健康人群相比明显升高,表明CTCs值的升高与肿瘤发生密切相关,有助于肿瘤的早期诊断,这与其他学者[22]的研究一致。在CTCs与OSCC临床特征关系的研究中发现,≥60岁组患者的CTCs值明显较高,考虑可能与该组患者中Ⅳ期占比较高(48%)有关,说明年龄为OSCC危险因素之一,老年患者更应密切随访,这是肿瘤治疗过程中关键步骤。在外周血CTCs与OSCC临床病理指标的相关性研究中发现,CTCs与OSCC的分化程度相关,肿瘤分化程度越低,恶性程度越高,外周血CTCs值越高,反之亦然,笔者认为可能是因为恶性程度高的肿瘤更易侵入小血管壁,从而更易发生血行转移。OSCC组患者中,外周血CTCs值随T分期、N分期增高而呈总体上升趋势,淋巴结转移组高于无淋巴结转移组,M1期组高于M0期组,表明外周血CTCs水平与肿瘤大小、淋巴结转移及远处转移等临床病理指标密切相关,临床上遇到CTCs检测值较大的患者,医生应尽可能完善相关检查,确定肿瘤负荷大小,有无临床转移迹象,明确手术适应证。另外CTCs与有无肿瘤周围组织浸润之间虽差异无明显统计学意义,但有肿瘤周围组织浸润组CTCs值较无浸润组增高,考虑可能由于样本量不足导致偏倚,后续笔者将扩大样本量进一步比较。在CTCs与临床分期的关系研究中也发现,CTCs与患者临床分期相关,发现Ⅲ+Ⅳ期患者的CTCs值较Ⅰ+Ⅱ期者明显升高,这与周士超等[23]的研究结果相一致,表明通过检测CTCs值有助于辅助判断患者临床分期,对OSCC临床诊疗有一定的指导意义。由于仅依靠单因素分析,各变量的真实效应有可能被其他混杂变量所掩盖,因此增加了多因素分析控制偏倚,通过推导CTCs与OSCC之间的线性回归方程得出颊部,N2分期,M分期,中、高分化程度等因素均为OSCC患者术前CTCs的独立影响因素。以上结果表明检测CTCs有助于判断肿瘤的恶性程度、进展情况、病理分级,CTCs值可一定程度反映出肿瘤的活跃程度和疾病的进展程度,可成为较为可靠的肿瘤监测指标之一。本研究通过对照组和OSCC组CTCs值绘制ROC曲线,计算出应用CTCs值诊断OSCC的AUC值为0.925,通过其敏感度及特异性计算出其约登指数为0.853,所对应的外周血CTCs值为8.450 FU/3 mL,敏感度与特异性均>90%,有较高的检验效能和临床诊断价值。将其应用于OSCC的筛查和辅助诊断,当CTCs检测值<8.450 FU/3 mL时,有较小患癌可能,若高于此值,则需密切随访或行必要的检查来排查患癌可能。同样通过转移组与未转移组之间CTCs值绘制ROC曲线,评估CTCs对OSCC转移的诊断价值,计算出AUC值为0.367(P=0.000),约登指数为0.44,相对应的CTCs值为12.250 FU/3 mL,敏感度为63.6%,特异性为73.3%,当OSCC患者CTCs值>12.250 FU/3 mL时有较大转移可能,具有一定的转移预测价值。
本研究结果表明,CTCs的检测对于OSCC的早期筛查、辅助诊断及转移预测等均具有重要的临床意义。本研究也存在一定不足,由于随访时间较短,未能进行完整的预后分析,后续将加强随访,进一步探讨CTCs对OSCC预后评估的价值。
综上所述,外周血CTCs的检测,对OSCC的早期筛查、辅助诊断、评估转移以及判断肿瘤的恶性程度,进展情况、病理分级等均有较为重要的临床价值,是一个较为可靠的肿瘤检测指标。
利益冲突声明:作者声明本文无利益冲突。
