紫溪山华山松种子园无性系SCoT遗传多样性分析
2021-10-21夏茂甜赵文植王正德李卫英辛培尧
徐 剑 叶 鹏 夏茂甜 赵文植 王正德 王 飞 李卫英 辛培尧
(1. 西南林业大学国家林业局西南风景园林工程技术研究中心,云南 昆明 650233;2. 西南林业大学西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650233)
植物遗传多样性分析,可以挖掘物种优良基因资源、掌握遗传变异规律、揭示物种的进化过程及潜力等,是植物遗传多样性保护和利用的重要工具[1]。华山松(Pinus armandii)是松科(Pinaceae)松属的常绿乔木树种之一,也是我国特有的多用途树木,分布范围广,经济价值高,可食用、材用,是重要的造林树种[2]。种子园是由优良遗传特性的林木组成的人工林,是实现林木良种化的重要途径之一[3]。目前,诸多研究人员已在贵州、云南等地营建了华山松无性系初级种子园,并进行了辅助授粉、病虫害防治等相关工作[4-5]。然而,全国多个省区大面积营建华山松单一类型的人工纯林,导致华山松的生长量持续衰退减少,病虫害增加。因此,基于华山松的自然资源分布以及人工种植的状况,对华山松进行遗传多样性研究,从而指导其遗传改良工作显得尤为重要。多年来,国内相关研究者从最初的以表型为基础,发展到现在从分子水平上开展华山松优良基因资源的发掘,对其种质资源高效合理的利用进行遗传改良,以提高林分质量[6]。祝娟[7]曾对华山松自然分布区内52个种源的遗传结构和遗传多样性进行了SSR研究,对其影响遗传结构和物种分化的因素进行了探讨。朱晓丹[8]、刘成等[9]和赵杨等[10]分别将RAPD、SRAP和ISSR标记运用在华山松相关的遗传多样性分析中,为华山松的遗传改良工作奠定了基础。
研究物种的遗传多样性可以从其形态特征水平、染色体水平、生化生理水平以及分子水平来进行[11]。相比于传统形态学而言,现代分子标记技术可以准确、快捷地反映出物种的遗传物质和表达产物的遗传变异,且这种方式的运用与目标基因紧密相关,不易受到外界环境或其它基因效应的影响,实验结果稳定可靠。目标起始密码子多态性分子标记(SCoT)是一种基于单引物扩增反应的目的基因分子标记方法[12],是以植物基因中起始密码子ATG侧翼序列的保守性和一致性设计单引物为原理,继而对基因进行扩增,能有效地产生偏向候选功能基因区的显性多态性标记,也是一种能跟踪性状的新型分子标记[13]。SCoT分子标记凭借其具有稳定性、多态性较高,特异性较强和重复性较好等优点,目前已在多种农作物的分子生物学研究中得到应用[14-18]。
本研究以云南省楚雄市紫溪山林场华山松种子园内不同种源无性系为材料,利用SCoT标记技术分析不同种源华山松无性系的遗传变异及其亲缘关系,从而对园内华山松种质资源进行评价。
1 材料与方法
1.1 实验材料
实验材料采集于楚雄市紫溪山林场华山松种子园,共计97份,分别来自于会泽县、巍山县、腾冲市、楚雄市、南华县和宜良县等6个不同种源地(表1),选取无病虫害的新鲜幼嫩针叶作为实验材料,按单株编号装入自封袋,做好标记,置于-80 ℃超低温冰箱中保存,备用。

表1 华山松6个自然群体的地理位置信息及样本数Table 1 Geographical information and number of samples of 6 natural populations of P. armandii
1.2 华山松DNA提取与检测
摘取5~10根冷冻的华山松叶样,采用2×CTAB法对无病害的幼嫩新鲜叶样进行DNA的提取。将提取出的华山松DNA用1%的琼脂糖电泳凝胶进行检测,对于DNA的提取效果,琼脂糖电泳凝胶以条带明亮,无拖带现象效果最佳。提取出来的华山松DNA浓度应在100 ng/μL以上150 ng/μL以下为最佳,最后将DNA放入-20 ℃冰箱中保存。
1.3 SCoT-PCR扩增
实验所用引物选用蔡元保等[19]、陈熙等[20]已报道的相关文献中公布的SCoT引物共40个。将符合实验要求的华山松DNA进行SCoT-PCR扩增,反应体系如下:ddH2O 9.5 μL、Green Taq Mix 12.5 μL、Primer 1 μL、模板DNA 1 μL,总体积24 μL。SCoT-PCR扩增反应程序如下:94 ℃预变性3 min;94 ℃变性1 s;50 ℃退火(可根据实 际情 况进 行 调整)1 min;72 ℃延伸1 min;35个循环;再延伸72 ℃ 10 min;4 ℃保存。
1.4 SCoT引物筛选
选取来自6个不同种源(表1)的华山松叶样,每个种源取1个样本进行初筛和复筛,共筛选出34个反应稳定、条带清晰且具有较好多态性的SCoT引物(表2)。

表2 华山松34个SCoT引物信息Table 2 Thirty-four SCoT primer information in P. armandii
1.5 数据分析
将6个种源共计97份华山松样品DNA与复筛得到的具有较好多态性的引物进行PCR扩增,再利用聚丙烯酰胺凝胶电泳法检测全部样品的遗传多样性,首先统计确定每个引物在所有供试样品中有多少互异条带,汇总各位点信息,录入到WPS表格中。
利用POPGEN1.32计算华山松群体等位基因数(Na)、有效等位基因数(Ne)、基因流(Nm)、和Shannon多样指数等;依据POPGEN1.32计算出华山松群体Nei's遗传距离数据,用NTSYS 2.10e构建群体的聚类图;用Structure 2.3.1使用MCMC方法评估多态位点的基因数据并建模聚类,估计最佳群体组群数K值。
2 结果与分析
2.1 华山松DNA提取
运用1%的琼脂糖电泳凝胶技术检测提取的6个种源共计97份华山松DNA,部分结果如图1所示,可以看出,实验样本DNA条带清晰明亮,无明显拖带弥散现象,基本符合总体实验的要求。

图1 部分华山松样本DNA琼脂糖电泳检测结果Fig. 1 Agarose gel electrophoresis detection results of partial P. armandii
2.2 多态性引物筛选
本研究利用40个SCoT引物对6个不同种源(每个种源各1个)华山松样品DNA进行引物筛选,其中34个引物可获得明亮、无拖尾现象的清晰谱带,均可用于后续复筛实验。部分结果如图2所示。
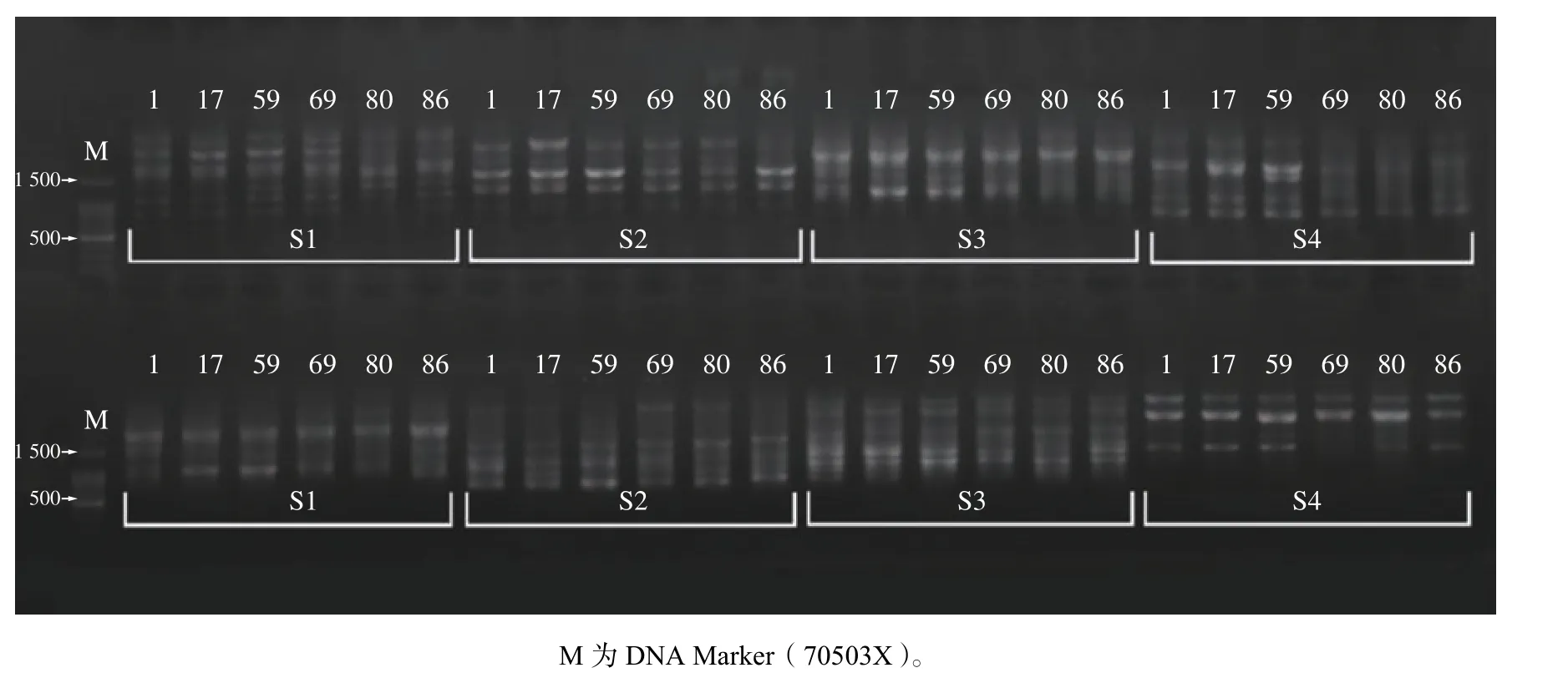
图2 部分引物初筛结果Fig. 2 Partial image of primer screening results
2.3 遗传多样性分析
华山松各种源的多样性信息见表3,由表3可知,6个种源的等位基因数,巍山(6.235 3)>会泽(5.911 8)>楚雄(5.794 1)>腾冲(5.058 8)>南华(4.323 5)>宜良(4.264 7),平均值为5.264 7。种源有效等位基因数为3.104 8(南华)~3.892 6(巍山),平均值为3.490 4。种源Shannon's多样性指数为1.230 9(南华)~1.519 7(巍山),数值大小为:巍山>会泽>楚雄>腾冲>宜良>南华,且所有种源的多样性指数均大于1。由表3还可以看出,6个种源的Nei's基因多样性指数(H)的平均值为0.690 4,最高值为巍山(0.728 7),最低值为南华(0.646 7)。基于统计分析可知,在这4个参数方面,巍山、楚雄和会泽3个种源均普遍高于腾冲、宜良和南华。结果表明,总体上来说,本研究中6个华山松种源有着较高的遗传多样性。
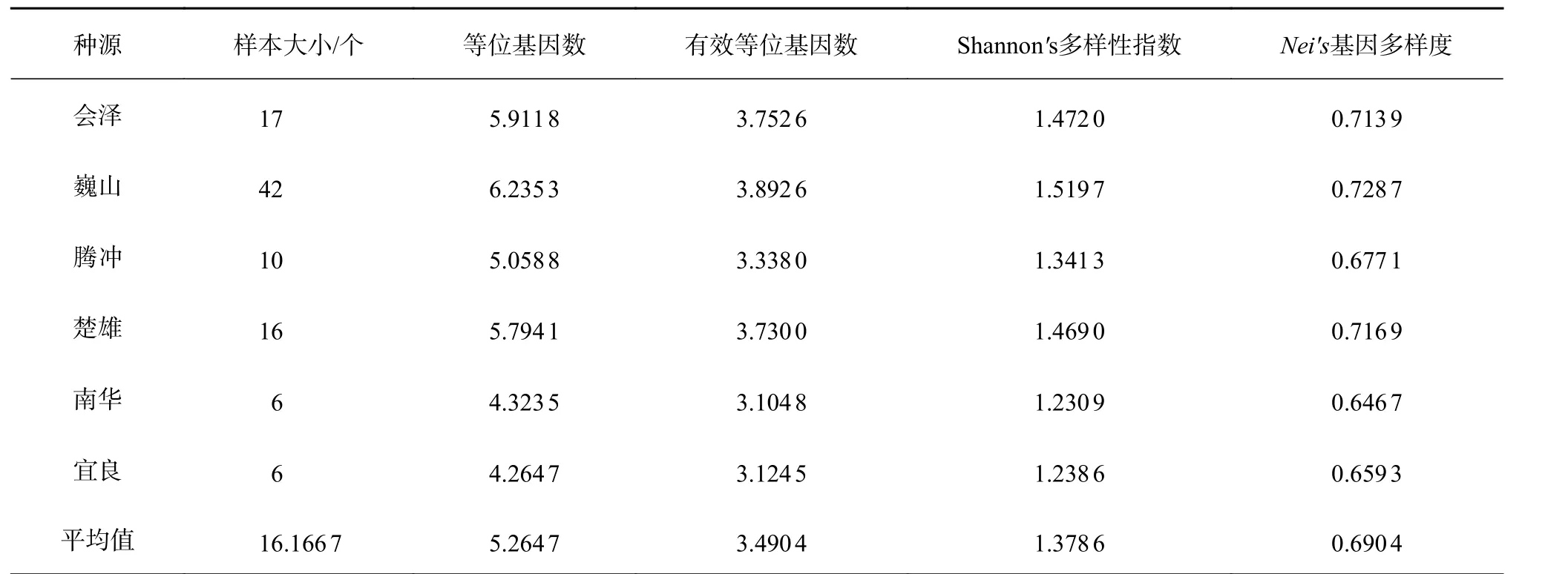
表3 华山松种源遗传多样性参数统计表Table 3 The genetic diversity information of P. armandii provenances
2.4 聚类分析
通过计算华山松6个种源两两之间的遗传距离和遗传相似系数,可以更进一步了解种子园内华山松群体间的遗传背景和亲缘关系。遗传距离可以体现种源间的遗传分化程度和遗传差异,在遗传多样性研究中是一项重要的参考指标。结果如表4所示,华山松6个种源的遗传相似系数在0.795 5~0.933 1之间,平均遗传相似系数为0.851 6;遗传距离范围0.069 2~0.228 8,平均值为0.161 6,可以看出,两两种源间的平均遗传距离趋近于0,且平均遗传相似系数趋近于1,总体来说,6个种源间有较近的亲缘关系。其中,巍山和会泽2个种源之间的遗传相似系数最大,遗传距离最小,这表明6个种源间,巍山和会泽的亲缘关系最近,遗传差异较小,相反,宜良种源和会泽种源的遗传相似系数最小,遗传距离最大,二者之间的亲缘关系最远,遗传差异较大。
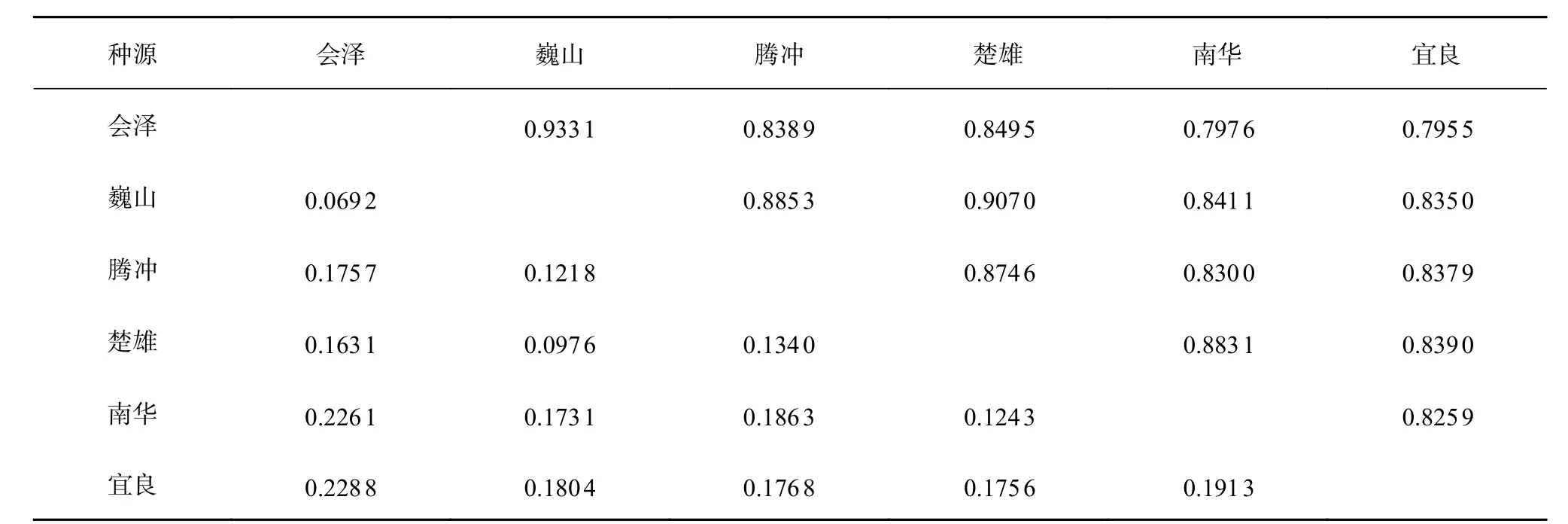
表4 华山松种源间Nei's遗传相似系数(对角线上方)和遗传距离(对角线下方)Table 4 Nei's genetic identity(above the diagonal) and genetic distance(below the diagonal) of P. armandii provenances
基于华山松6个种源间的遗传相似系数和遗传距离,利用NTSYS2.10软件对其进行聚类分析,构建UPGMA聚类图,其结果如图3所示。以0.822为阈值,将6个种源归为3类:会泽、巍山、楚雄、腾冲遗传距离较近,归为一类;宜良和南华各为一类。以0.868为阈值时可归为4类:会泽、巍山、楚雄种源间的亲缘关系较近,可聚为一类;腾冲、宜良、南华分别单归为一类。利用GenAIEx进行Mantel检测,结果如图4所示,r=-0.131(r<0),P=0.360(P>0.05),表明6个华山松种源间的遗传距离和地理不存在显著相关性,地理距离并未对其遗传距离造成明显影响。

图3 华山松6个种源聚类分析Fig. 3 Cluster analysis of 6 provenances in P. armandii

图4 Mantel检测距离和遗传地理距离的相关性Fig. 4 Correlation of Mantel detection distance and genetic geographic distance
2.5 遗传分化分析
通过数据统计分析可知,楚雄紫溪山林场华山松种子园内6个种源的基因流Nm平均值为4.368 3>1,且遗传分化系数(Gst)值为0.054 1,结果说明种源间存在5.41%的遗传变异,种源内存在94.59%的遗传变异,综上所述,楚雄紫溪山林场华山松种子园的遗传变异主要来源于种源内。由此可推断,高水平的基因流对各种源间产生均质化作用,削弱了其遗传差异,导致华山松种源间出现遗传分化较低的现象。
采用Structure2.3.1软件,基于数学模型分析由97个华山松无性系材料构成的群体遗传结构,结果如图5和图6所示。K值为横坐标,设定在1~10之间,由图5可知,随着K值的增大,lnP(D)呈持续增大趋势。根据Evanno等[21]报道的方法,经过分析来确定最优群体数K,可知,在K=2时,ΔK为最大值,表明将6个华山松种源划分为2个类群与上述PCoA聚类分析结果一致,第1个类群包括会泽种源、巍山种源、楚雄、腾冲和宜良种源共5个种源;第2个类群包括1个南华种源。参考陈越等[22]的研究,在该Structure群体遗传分析中,材料的遗传组分(Q值)是一项重要指标。在图6中,分析97个华山松无性系材料的最大Q值分布发现,其中Q≥0.6的共计53个无性系,占54.64%,说明这53个无性系拥有较为单一的遗传结构;而剩余的44个无性系的Q值<0.6,占45.36%,此部分无性系的遗传背景较为复杂,由此可知,6个华山松种源间存在基因渗透现象。

图5 lnP(D)和ΔK随K值的变化趋势Fig. 5 Trend of lnP(D) and ΔK with K value

图6 样品材料群组遗传结构Fig. 6 Group genetic structure of sample material
3 结论与讨论
华山松的遗传多样性研究是进行华山松育种工作的重要环节,借助种源间亲缘关系的分析可以挖掘优良基因,有效地对亲本选配和后期林木遗传育种保护提供指导。本研究结果显示,华山松6个种源的基因多样度为0.690 4,Shannon's多样性指数为1.378 6,遗传分化系数(Gst)值为0.054 1,表明种子园内不同无性系拥有较高水平的遗传多样性,且遗传分化主要存在于种源内。此外,朱晓丹[8]和刘成等[9]分别采用RAPD和SRAP标记对楚雄紫溪山华山松种子园进行了遗传多样性分析,2项研究皆表明该种子园遗传多样性丰富,各种源内的遗传分化远大于种源间,与本实验相一致。相比于RAPD和SRAP标记,SCoT标记既拥有较好的重复性又保证了其稳定性,因此对所提取的DNA质量要求较低,同时可以检测出更丰富的遗传信息。蒙东萍[23]、韦泳丽等[24]曾在对罗汉松(Podocarpus macrophyllus)的遗传多样性研究中指出,SCoT分子标记可以反映丰富的遗传信息,表现出较高的标记效率和多态性,对研究对象的数量以及遗传背景无过多要求。于是,在后续的杂交育种研究中,应以DNA水平分析的结果为主要依据,如在巍山种源和楚雄种源内的不同无性系间选配杂交组合,从而提高其杂交亲合性和丰富杂种后代的基因型。
遗传相似系数和遗传距离是衡量群体间遗传关系的重要指标。遗传距离大、遗传相似系数小表明群体间亲缘关系远,遗传距离小、遗传相似系数大表明群体间亲缘关系近[25]。本研究中,巍山和会泽2个种源之间的遗传相似系数最大,遗传距离最小,可知二者遗传差异小,遗传相似程度高,相反,宜良和会泽种源的遗传相似系数最小,遗传距离最大,说明其存在一定程度的遗传差异。一般认为,自然地理分布较近的种源之间存在相似的遗传基础,遗传差异较小,反之,地理位置较远的种源间遗传差异较大。根据6个华山松种源的遗传距离和遗传相似系数通过NTSYS软件构建UPGMA聚类图,结果发现,腾冲种源和巍山种源地理距离和遗传距离均较为接近,被归为一类,符合这一说法。然而,地理距离较近的南华种源和巍山种源,或会泽种源和宜良种源之间却没有被归为一类,显然该聚类结果不符合物种地域性分布。李彬[26]在对珊瑚菜(Glehnia littoralis)的研究中曾发现,两两居群间地理距离相近的遗传相似程度并不高,没有被归为一类,相反,地理距离相距较远的居群在NTSYS聚类检测中被聚在一起。此外,在对唐古特大黄(Rheum tanguticum)和裸果木(Gymnocarpos przewalskii)的研究中均发现,地理距离与种群间遗传距离没有直接的相关关系[27-28]。这可能是因为植物群体的遗传结构不仅受其自然地理分布距离的影响,还包括生态气候因子或人为活动干扰等诸多因素有关。
基因流(Nm)是决定物种遗传变异和导致物种进化的重要因素之一。本研究中华山松群体的Nm为4.368 3,Nm>1,通过遗传结构分析可知,华山松种源内的遗传变异显著大于种源间的遗传变异,6个华山松种源间存在基因渗透现象。华山松果实味道鲜香,深得部分鸟类、兽类的喜爱,从而可能会得到长距离的传播,促进了种子流,而降低了种源间的遗传分化[29]。同时,造林单位间的种源的调动,也可能是原因之一。此外,种子或花粉的传播在传递和交换遗传变异的同时会受到诸多新的或变化的生态因子的影响,比如气候、土壤和地理结构等,从而为这些不同的遗传来源提供新的选择和适应,最终可能导致遗传变异[7]。
