右美托咪定通过Akt/mTOR自噬通路介导NLRP3炎症小体失活而减轻脓毒症大鼠肠损伤*
2021-10-20李慧利周长浩
陈 浩, 李慧利, 杜 亮, 周长浩, 陈 欢, 王 欣
(河北医科大学第一医院麻醉手术科,河北石家庄 050031)
脓毒症由感染引发,患者全身发生有害反应,会出现低血压、恶病质和发热等症状,严重影响生命安全,危害严重[1]。脓毒症会导致炎症因子和自由基增多、出现线粒体损伤等,这些情况均导致细胞自噬增多,而自噬在脓毒症中发挥重要调节作用[2]。蛋白激酶B(protein kinase B,PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)自噬通路作为上游通路汇合点,在脓毒症大鼠中对于自噬调控发挥重要作用[3]。脓毒症中激活自噬可以抑制炎症反应,从而减少细胞死亡,减轻患者症状[4]。右美托咪定(dexmedetomidine,DEX)作为α2受体激动药物,对脓毒症患者有保护作用,可降低28 d死亡率和缩短机械通气时间[5],但作用机制尚需进一步探讨。因此,本研究采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)建立脓毒症大鼠模型,探究DEX 对自噬及核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体的作用,以期寻找DEX缓解脓毒症的机制。
材 料 和 方 法
1 动物
50 只SPF 级雄性Wistar 大鼠,10 周龄,体质量(200±10)g,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2016-0011。所有大鼠均在温度(23.5±0.5)℃、湿度(50±5)%、12 h黑暗/12 h 光照条件下自由饮水摄食,暂养1 周后进行实验,实验动物符合3R 原则。本研究经河北医科大学第一医院动物伦理审查委员会审核并通过。
2 主要试剂
盐酸DEX注射液(江苏恒瑞医药股份有限公司;国药准字H20090248;规格:2 mL、200 μg);PI3K/mTOR 抑制剂NVP-BEZ235(MedChemExpress;规格:200 mg;纯度:99.68%);自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA;Sigma;规格:100 mg);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝科技有限公司);大鼠白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、兔源Ⅰ抗[beclin-1、LC3-II、Akt、磷 酸 化(phosphorylated,p)-Akt、mTOR、p-mTOR、NLRP3、含caspase 募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)及caspase-1 及其前体pro-caspase-1、GAPDH]及Ⅱ抗羊抗兔IgG(Abcam)。光学显微镜(深圳市隆基金相仪器设备有限公司,型号:LJ-JX2030);透射电镜(Thermo Scientific,型号:Talos);蛋白凝胶成像仪(北京中西华大科技有限公司,型号:JY02G)。
3 主要方法
3.1 分组及处理 将大鼠分成假手术(sham operation,sham)组、模型(model)组、DEX 组、DEX+NVPBEZ235组和DEX+3-MA组,每组10只。除假手术组外,其余各组参考文献[6]采用CLP建立脓毒症大鼠模型:大鼠术前禁食但不禁水,麻醉大鼠,大鼠仰卧固定在鼠板上,腹腔经消毒后在正中切开约1.5 cm 切口,找出盲肠,结扎回盲瓣及远端盲肠,无菌注射器针头在结扎处与盲肠末端中点处做2 次贯通穿孔,挤出肠内容物,盲肠连同挤出的肠内容物一同回纳腹腔,逐层缝合切口。假手术组大鼠除了不结扎穿孔盲肠外其余处理相同。造模结束后DEX组、DEX+NVP-BEZ235 组和DEX+3-MA 组分别在0、3 和6 h 腹腔 注 射10 μg/kg DEX[7],DEX+NVP-BEZ235 组 在DEX 组基础上腹腔注射30 mg/kg NVP-BEZ235,DEX+3-MA 组在DEX 组基础上腹腔注射15 mg/kg 自噬抑制剂3-MA。
3.2 样品采集 造模24 h,腹主动脉采血,断头法处死大鼠,收集肠道组织,部分置于4%多聚甲醛中固定、部分置于-80 ℃冰箱保存。
3.3 HE 染色观察肠道组织形态和肉眼观察结肠大体形态 4%多聚甲醛中固定组织,梯度乙醇脱水后进行常规包埋、切片、贴片、烤片,切片(厚度5 μm),切片经二甲苯脱蜡、梯度乙醇脱水,晾干后苏木精染色、0.1%盐酸酒精分化、伊红复染,乙醇脱水、二甲苯透明后封片,光学显微镜下观察肠道组织形态。另外,肉眼观察大鼠结肠标本,进行结肠大体形态损伤指数(colon macroscopic damage index,CMDI)评分。评分标准:0 分,无损伤;1 分,轻度水肿、充血,表明光滑、无糜烂;2分,充血、水肿,组织表面呈颗粒状,有糜烂或肠黏连;3分,高度水肿、充血,黏膜表明坏死或溃疡,溃疡最大纵径<10 mm,肠壁增厚或表面坏死及炎症;4 分,在3 分基础上溃疡最大纵径≥10 mm,或出现全肠壁坏死。
3.4 ELISA 检测血清中IL-1β 和TNF-α 水平 腹主动脉血室温静置2 h,1 400×g离心10 min,上清为血清。参考大鼠IL-1β 和TNF-α ELISA 试剂盒检测血清中IL-1β和TNF-α水平。
3.5 免疫组化检测肠道组织中beclin-1 和LC3-II 蛋白表达情况 3.3 中切片经0.1 mol/L 枸橼酸钠缓冲液高温抗原修复,3% H2O2甲醇溶液封闭抗原,加入beclin-1(1∶100)和LC3-II(1∶250)抗体,4 ℃孵育过夜;37 ℃孵育HRP 标记的山羊抗兔IgG(1∶500),DAB 染色,苏木素染核。显微镜下观察肠道组织中beclin-1和LC3-II蛋白情况:beclin-1和LC3-II目的蛋白为胞质、胞核中棕褐色团状物质。蛋白阳性率(%)=阳性细胞/总细胞×100%。
3.6 Western blot 检 测 肠 道 组 织 中Akt、p-Akt、mTOR、p-mTOR、NLRP3、ASC、caspase-1 和pro-caspase-1 蛋白水平 从-80 ℃冰箱中取肠道组织30 mg,手术剪剪碎,添加蛋白裂解液,冰上研磨后冰上裂解20 min,10 000×g、4 ℃离心20 min,BCA 试剂盒测定蛋白浓度,每孔上样30 μg,凝胶电泳分离蛋白,PVDF 转膜;5%脱脂奶粉室温封闭2 h;加入Ⅰ抗[Akt(1∶10 000)、p-Akt(1∶500)、mTOR(1∶10 000)、pmTOR(1∶1 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、caspase-1(1∶1 000)、pro-caspase-1(1∶1 000)和GAPDH(1∶5 000)];对应加入Ⅱ抗羊抗兔IgG(1∶5 000),室温孵育2 h。DAB 显色试剂显色,蛋白凝胶成像仪拍照和定量分析。
4 统计学处理
数据均采用GraphPad Prism 7.0 进行统计学分析。计量数据以平均数±标准差(mean±SD)表示,组内比较用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 DEX对肠道组织形态的影响
假手术组肠上皮细胞大小均匀一致、排列整齐紧密,层次分明,无明显病理改变;模型组肠道组织完整性破坏严重,存在坏死脱落细胞,炎症浸润现象明显,基底面细胞染色较深,细胞挤压明显,游离面细胞有不同程度溃损;DEX 组肠道组织屏障较为完整,细胞形态清晰,无明显细胞碎片脱落,炎症浸润较轻;DEX+NVP-BEZ235组细胞形态改变,游离面排列不平整,胶原带增生明显,炎症浸润明显;DEX+3-MA 组肠道完整破坏,基底面细胞排列紊乱,胶原带增厚,细胞形态破坏严重,有较多游离的细胞碎片,见图1。

Figure 1. The morphological changes of rat intestinal tissues in the 5 groups. A:sham group;B:model group;C:DEX group;D:DEX+NVP-BEZ235 group;E:DEX+3-MA group. The black star indicates the collagen band. The scale bar=100 μm.图1 各组大鼠肠道组织形态变化
与假手术组相比,模型组、DEX 组、DEX+NVPBEZ235 组和DEX+3-MA 组CMDI 评分显著升高(P<0.05);与模型组相比,DEX 组和DEX+NVP-BEZ235组CMDI 评分显著降低(P<0.05);与DEX 组相比,DEX+3-MA 组CMDI 评 分 显 著 升 高(P<0.05),见图2。

Figure 2. The colon macroscopic damage index(CMDI)in each group. Mean±SD. n=10.#P<0.05 vs sham group;*P<0.05 vs model group;&P<0.05 vs DEX group.图2 各组大鼠结肠标本CMDI评分
2 DEX对血清中IL-1β和TNF-α水平的影响
与假手术组相比,模型组、DEX 组、DEX+NVPBEZ235 组和DEX+3-MA 组血清中IL-1β 和TNF-α 水平显著升高(P<0.05);与模型组相比,DEX 组和DEX+NVP-BEZ235 组血清中IL-1β 和TNF-α 水平显著降低(P<0.05),DEX+3-MA 组血清中IL-1β水平显著 降 低(P<0.05);与DEX 组 相 比,DEX+NVPBEZ235 组和DEX+3-MA 组血清中IL-1β 和TNF-α 水平显著升高(P<0.05),见图3。
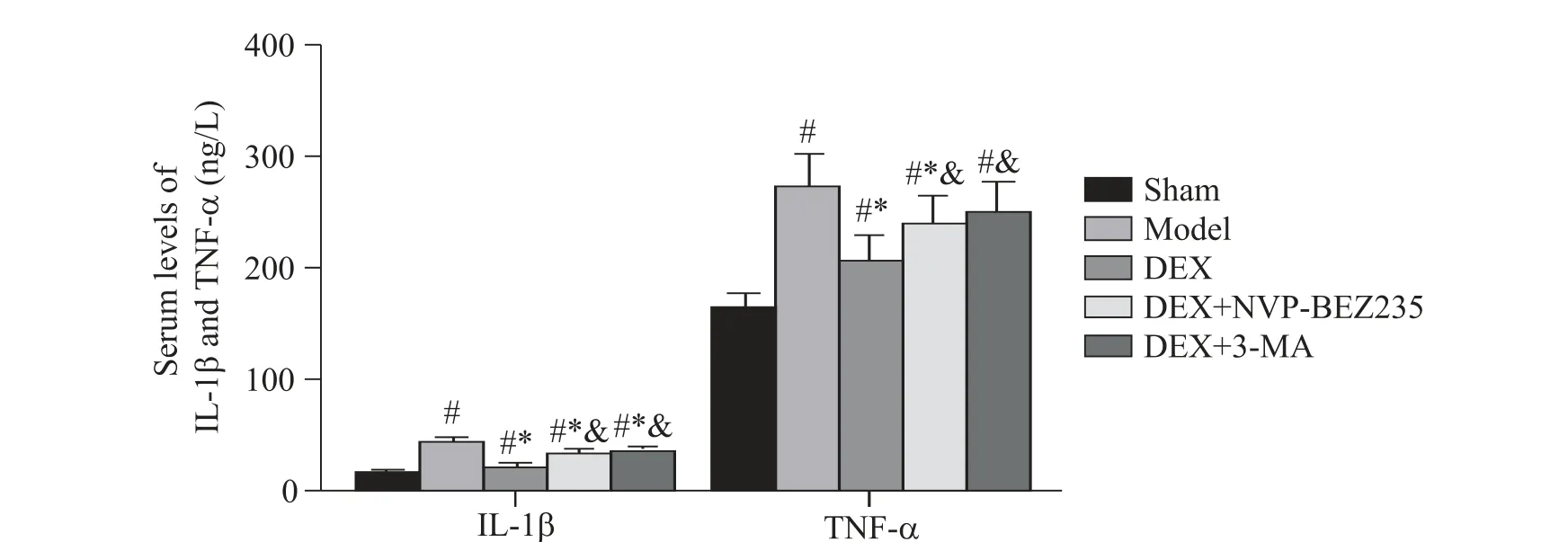
Figure 3. Comparison of serum levels of IL-1β and TNF-α in the 5 groups. Mean±SD. n=10.#P<0.05 vs sham group;*P<0.05 vs model group;&P<0.05 vs DEX group.图3 5组血清中IL-1β和TNF-α水平比较
3 DEX 对肠道组织中beclin-1 和LC3-II 蛋白的影响
与假手术组相比,模型组、DEX 组、DEX+NVPBEZ235 组和DEX+3-MA 组肠道组织中beclin-1 和LC3-II 蛋白阳性率升高(P<0.05);与模型组相比,DEX 组肠道组织中beclin-1 和LC3-II 蛋白阳性率升高(P<0.05),DEX+3-MA 组肠道组织中beclin-1 和LC3-II 蛋白阳性率降低(P<0.05);与DEX 组相比,DEX+NVP-BEZ235 组和DEX+3-MA 组肠道组织中beclin-1 和LC3-II 蛋白阳性率降低(P<0.05);与DEX+NVP-BEZ235 组相比,DEX+3-MA 组肠道组织中beclin-1蛋白阳性率降低(P<0.05),见图4。

Figure 4. The protein expression of beclin-1 and LC3-II in intestinal tissues of the rats in the 5 groups was detected by immunohistochemical staining(scale bar=100 μm). Mean±SD. n=10.#P<0.05 vs sham group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+NVP-BEZ235 group.图4 免疫组化检测各组大鼠肠道组织中beclin-1和LC3-II蛋白的表达情况
4 DEX 对 肠 道 组 织 中Akt、p-Akt、mTOR、pmTOR、NLRP3、ASC、caspase-1 和pro-caspase-1 蛋白水平的影响
5组肠道组织中Akt、mTOR 和pro-caspase-1蛋白水平差异无统计学意义(P>0.05);与假手术组相比,模型组、DEX 组、DEX+NVP-BEZ235 组和DEX+3-MA组 肠 道 组 织 中p-Akt/Akt、p-mTOR/mTOR、NLRP3、ASC 和caspase-1/pro-caspase-1 蛋 白 水 平 升 高(P<0.05);与模型组相比,DEX 组和DEX+NVP-BEZ235组肠道组织中p-Akt/Akt 和p-mTOR/mTOR 蛋白水平升 高(P<0.05),NLRP3、ASC 和caspase-1/pro-caspase-1 蛋白水平降低(P<0.05),DEX+3-MA 组肠道组织中p-Akt/Akt 蛋白水平升高(P<0.05),NLRP3 和ASC 蛋白水平降低(P<0.05);与DEX 组相比,DEX+NVP-BEZ235 组和DEX+3-MA 组肠道组织中p-Akt/Akt 和p-mTOR/mTOR 蛋 白 水 平 降 低(P<0.05),NLRP3、ASC 和caspase-1/pro-caspase-1 蛋 白 水 平 升高(P<0.05);与DEX+NVP-BEZ235 组相比,DEX+3-MA 组肠道组织中NLRP3 蛋白水平升高(P<0.05),ASC蛋白水平降低(P<0.05),见图5。
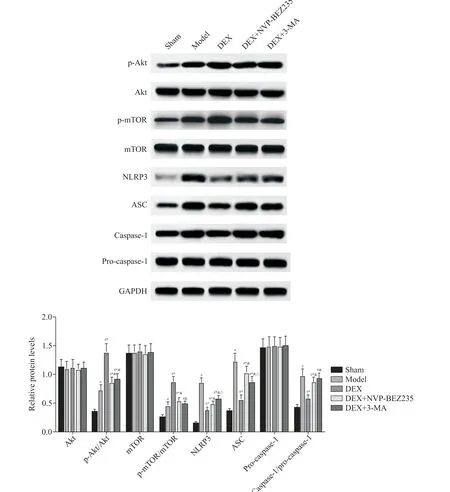
Figure 5. The protein levels of Akt,p-Akt,mTOR,p-mTOR,NLRP3,ASC,caspase-1 and pro-caspase-1 in intestinal tissues of the rats in the 5 groups were detected by Western blot. Mean±SD. n=10.#P<0.05 vs sham group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+NVP-BEZ235 group.图5 Western blot检测各组大鼠肠道组织Akt、p-Akt、mTOR、p-mTOR、NLRP3、ASC、caspase-1和pro-caspase-1蛋白水平
讨 论
DEX 作为临床上常用麻醉药物辅助剂,在重症监护室可镇定插管或呼吸机患者,安全性较高,较大剂量也不会损害心、肝、肾等重要器官,危害小[8]。随着研究深入,在临床上使用DEX 可以降低炎症因子,减轻水肿,在脓毒症中具有较高潜在价值[9],但具体机制尚需进一步研究,为探讨其机制进行本研究。在本研究结果,脓毒症大鼠肠道组织完整性遭到破坏,细胞脱落和炎症浸润现象明显,出现明显的病理损伤;经DEX治疗后大鼠肠道组织恢复完整性,仅存在部分细胞脱落和炎症浸润现象,且炎症因子IL-1β 和TNF-α 水平降低。这提示DEX 能够修复由于脓毒症造成的肠道功能破坏,缓解脓毒症大鼠中的炎症,具体机制尚需进一步探究。
本研究结果显示脓毒症大鼠肠道组织NLRP3、ASC 和caspase-1/pro-caspase-1 蛋白水平均处于升高状态。NLRP3炎症小体可活化ASC和caspase-1从而引起促炎因子IL-1β 的成熟和释放,促进炎症反应[10];且NLRP3与脓毒症的多器官损伤关系密切,在脓毒症大鼠中抑制NLRP3 炎症小体活化可抑制caspase-1 和IL-1β 释放,从而稳定血管内皮钙黏蛋白,缓解脓毒症引起的肺损伤[11]。DEX 在脓毒症患者中能够减轻NLRP3炎症小体从而减轻脓毒症诱发的肾损伤[12],提示脓毒症大鼠肠道组织中NLRP3 炎症小体处于激活状态,活化的炎症小体促进促炎因子IL-1β 和TNF-α 的表达,加重炎症反应。添加DEX 后能够抑制NLRP3炎症小体的激活,进而减轻炎症指标,缓解炎症损伤。
炎症损伤导致细胞自噬增多,脓毒症引发的多脏器功能衰竭器官中也存在自噬增多现象[13]。Akt/mTOR 通路作为自噬调节最经典的mTOR 信号转导通路,在脓毒症大鼠中处于激活状态,且自噬小体水平升高,机体处于自我保护状态[14]。beclin-1 是自噬活化的关键因子,LC3是自噬重要标志蛋白[15]。DEX能够激活Akt/mTOR 通路,降低促炎因子水平,从而减轻七氟醚诱导的大鼠炎症损伤[16]。本研究中脓毒症大鼠肠道组织中p-Akt/Akt 和p-mTOR/mTOR 蛋白水平及beclin-1 和LC3-II 蛋白阳性率升高,提示脓毒症大鼠肠道组织处于自噬激活状态,但本研究中脓毒症大鼠肠道组织中炎症因子水平升高,可能是自噬能力有限,整体上导致炎症加剧。添加DEX 后p-Akt/Akt 和p-mTOR/mTOR 的蛋白水平及beclin-1 和LC3-II 蛋白阳性率进一步升高,提示添加DEX 后能进一步促进自噬,自噬清除炎症因子,缓解炎症。进一步研究显示,分别在DEX的基础上添加Akt/mTOR通路抑制剂和自噬抑制剂后,beclin-1 和LC3-II 蛋白阳性率降低,炎症因子IL-1β 和TNF-α 水平升高,提示Akt/mTOR 通路抑制剂与自噬抑制剂功能类似,DEX通过激活Akt/mTOR 通路而促进自噬,进而减轻炎症反应,实现对脓毒症大鼠肠道组织损伤的缓解。
综上所述,DEX 能够激活Akt/mTOR 通路而促进自噬、减轻炎症,从而实现对脓毒症大鼠肠道的保护。但DEX与信号通路之间的具体调控尚需进一步研究。
