喀斯特高原山区灌丛草地昆虫群落多样性研究
2021-10-20陈志敏黄秀东李中森常志敏龙见坤
陈志敏,黄秀东,张 茂,李中森,常志敏,2,龙见坤,2*
(1.贵州大学动物科学学院,贵阳 550025;2.贵州大学昆虫资源开发利用省级特色重点实验室,昆虫研究所,贵阳 550025)
灌丛草地是草地生态系统的重要组成部分,具有涵养水源、防风固沙、保护生物多样性、调节气候等生态功能(张大治, 2012)。喀斯特高原山区,由于地形较为陡峭,光、水、土等资源分布不均匀和人类不合理的开发利用使水土流失日趋严重,导致大面积的灌丛草地退化,甚至向石漠化方向演变,农业生产环境恶劣、生态畜牧业发展受阻、生物多样性降低(许留兴, 2015; 史莎娜, 2018)。昆虫作为物种最丰富的动物类群,对维持植物群落组成及结构稳定性十分重要,是草地生态系统中生物多样性不可或缺的组成部分(杨兴卓, 2019)。然而,昆虫群落多样性易受气候条件、植被多样性等环境因子以及人为干扰的影响,进而产生不同的发生规律(刘生冬, 2019; 郑晓旭, 2020)。因此,开展放牧背景下灌丛草地昆虫群落多样性研究,对该生态系统及其物种多样性的保护与利用具有重要的指导作用。
目前,国内有关灌丛草地昆虫群落多样性及其功能群的研究报道较少,针对喀斯特高原山区灌丛草地昆虫群落多样性的研究几近空白。因此,本文通过对贵州省大方县星宿乡崔苏坝境内的灌丛草地昆虫群落多样性进行研究,旨在弄清喀斯特高山地区灌丛草地昆虫群落多样性变化特征和与环境因素之间的相关性,为喀斯特灌丛草地生物多样性的保护与利用提供理论依据和数据支撑。
1 材料与方法
1.1 试验区概况
研究区位于贵州省大方县星宿乡崔苏坝(27°23′N,105°52′E,海拔1 730~1 820 m),地势南北较低,中部较高,属于典型的喀斯特峰丛中切槽谷地形。研究区属于亚热带高原季风湿润气候,具有雨雾日多即属“十里不同天”的立体气候特点。其阴雨天气多,日照少,雨季特别明显,雨量充沛,年平均降水量为1 118.05 mm,月均降水量大于100 mm的月份集中在5-9月。研究区为天然灌丛草地,面积大小约为33.33 ha,灌丛以杜鹃花科Ericaceae和蔷薇科Rosaceae植物为主,全年放牧为当地农民自由放牧的本地黄牛和山羊。
1.2 实验设计与样品采集
本研究调查时间为2018年9月-2019年8月,每月中旬进行一次调查,调查天气均为晴天。以随机5点取样法进行样点取样,每个样点大小为40 m×40 m,样点间距不低于500 m,每个样点以Z字型5点取样法进行样方取样,每个样方面积大小均为2 m×2 m,共计25个样方。每个样方昆虫的采集采用网捕法、陷阱法和黄盘诱集法相结合进行。用昆虫网(昆虫网眼1 mm,口径为35 cm,网深80 cm,整体长度170 cm)在每个样方内来回重复2次扫网(共20网)进行昆虫标本的采集,之后用陷阱法在每个样方内以Z字型设置5个陷阱(陷阱为400 mL塑料杯,杯口直径为95 mm,杯深为116 mm,底部直径为55 mm,里面加入1/3容量的可乐作为引诱剂),同时在每个样方四周分别放置1个黄盘(共4个,每个黄盘口径为20 cm,盘内加入适量盐及无香味的清洁剂水溶液)。陷阱法与黄盘诱集法的放置时间均为24 h。将上述采集方法对每个样方所采集到的所有昆虫标本存放到装有75%酒精的50 mL离心管内保存,并做好编号、记录带回室内鉴定与数理统计。参考相关资料(杨贵军, 2013; 潘卉, 2017; 何云川, 2018; 陈蔚, 2019; 顾伟, 2011)将灌丛草地昆虫功能群划分为植食性昆虫(Phytophagous group,简称Ph)、捕食性昆虫(Predatory group,简称Pr)、寄生性昆虫(Parasitic group,简称Pa)、杂食性昆虫(Omnivorous group,简称Om;腐生性昆虫和对植物几乎没有危害也不捕食其它动物的昆虫)。
采用大小为1 m×1 m的样方框对上述样点进行植被数量特征调查,每个样点5个重复,分别记录样方框内的植被的物种数和植被的自然高度。利用Ttakeme土壤温度水分测定仪、温湿度计对样方框内的每个样方进行微气候的测定(包括土壤表层温度、土壤深度0~5 cm含水量、空气温湿度)。
1.3 数据分析
利用Excel和SPSS 26.0对灌丛草地所采集到的标本数量进行统计分析,其中昆虫群落的活动特征、物种丰富度指数、多样性指数、均匀度指数、优势度指数等指数的计算方法参照邹言等(2020)。灌丛草地昆虫群落的活动特征、物种丰富度、多样性指数、均匀度、优势度等与环境间的互作关系采用单因素方法、相关性分析进行分析。
利用Berger-Parker优势度指数(D)进行群落物种等级划分。其中D≥10%时为优势种(Dominant species),Ⅰ表示;5%≤D<10%时为丰盛种(Abundant species),Ⅱ表示;1%≤D<5%时为常见种(Frequent species),Ⅲ表示;0.1%≤D<1%时为偶见种(Occasional species),Ⅳ表示;D<0.1%时为罕见种(Rare species),Ⅴ表示。
2 结果与分析
2.1 灌丛草地昆虫群落及其功能团结构特征分析
本研究共采集标本12 481号,隶属8目77科(见表1)。其中优势科共计2科,分别为蚁科Formicidae和蚊科Culicidae,分别占总个体数的35.045%和24.950%;丰盛科仅1科,为姬蜂总科Ichneumonoidea,占总个体数5.244%;常见科共计10科,占总个体数的30.514%;偶见科共计21科,占总个体数的7.450%;罕见科共计43科,占总个体数的0.9%。
灌丛草地昆虫群落的4个功能团中(见表1),杂食性性昆虫(Om)个体数量最多,共3目8科7 534号标本,占总个体数60.365%;其次为植食性昆虫(Ph),共6目45科2 961号标本,占总个体数23.881%;第三为寄生性昆虫(Pa),共2目8科1 004号标本,占总个体数8.098%;最后为捕食性昆虫(Pr)的个体数量最少,共5目16科982号标本,占总个体数11.743%。而从灌丛草地昆虫群落功能团科级水平来看,科级数量大小顺序依次为Om>Ph>Pa>Pr。其中Om共有优势科2个、偶见科2个和罕见科4个;Ph共有常见科6个、偶见科14个、罕见科25个;Pa共有丰盛科1个、常见科1个、偶见科2个和罕见科4个;Pr共有常见科3个、偶见科3个、罕见科10个。从5个等级划分的级数来看,其中Pa的等级级数最多(共4个等级);其次为Om、Ph和Pr、(均为3个等级),且均无优势科;Om有优势科2个。
2.2 灌丛草地昆虫群落多样性动态变化分析
灌丛草地昆虫群落物种数的动态变化趋势如图1所示。昆虫群落的物种数在研究期间变化趋势为从1月(1科)逐渐增加,至8月最高(28科),之后逐渐减少直至次年1月最低(图1-a),其中1月与2月的昆虫群落物种数无显著差异外,与其它月份均存在显著差异性(P<0.05);2月的昆虫群落物种数与1月相同;6月与5月、7月、8月、9月的昆虫群落物种数无显著差异外,均与其它月份的昆虫群落物种数存在显著差异性(P<0.05);8月与5月、7月、8月、9月的昆虫群落物种数无显著差异外,均与其他月份的昆虫群落物种数存在显著差异性(P<0.05);10月与3月昆虫群落物种数无显著差异,均与其它月份的昆虫群落物种数存在显著差异性(P<0.05);11月与12月、4月的昆虫群落物种数无显著差异外,均与其它月份的昆虫群落物种数存在显著差异性(P<0.05);12月与3月、4月的昆虫群落物种数无显著差异外,与其他月份的昆虫群落物种数均存在显著差异性(P<0.05)。期间,昆虫群落的个体数量变化趋势为1月数量最少(1.6头),2月过后数量才开始逐渐升高,直至5月最多(393.4头),至6月有所跌落,然后进入7月数量又逐渐回升,直至8月、9月达第二个峰值后才逐渐降低至次年1月最少(图1-b),其中1月与7月、8月、9月的昆虫个体数存在显著差异性(P<0.05),与其它月份的昆虫个体数均无显著差异性;2月、5月的昆虫个体数情况与1月相同;6月与11月、12月、1月、2月的昆虫个体数存在显著差异性(P<0.05),与其它月份的昆虫个体数均无显著差异性;7月与5月、8月、9月、11月、1月、2月的昆虫个体数存在显著差异性(P<0.05),与其余月份的昆虫个体数均无显著差异性。而昆虫多样性指数则在6月(2.48)最高,6月到次年1月份呈现逐渐降低的现象,且在次年1月(0.24)达最低(图1-c);其中6月与12月、1月、2月、4月的昆虫多样性指数存在显著差异性(P<0.05),与其它月份的昆虫多样性指数均无显著差异性。丰富度1-8月份呈上升趋势,其中8月(4.91)最高,之后8月至次年1月份逐渐下降达最低(0.41)(图1-d),其中8月与5月、6月、7月、8月的丰富度无显著差异外,与其他月份的丰富度均存在显著差异性(P<0.05)。昆虫群落均匀性指数在研究期间波动相对较小,其中11月(0.84)最高,次年1月(0.34)最低(图1-e)。其中11月与1月的均匀度指数存在显著差异性(P<0.05),与其它月份的均匀度指数均无显著差异性;而1月与2月、6月、7月、11月的均匀度指数存在显著差异(P<0.05),与其它月份的均匀度指数均无显著差异性。灌丛草地昆虫群落的优势集中性指数共出现3个峰值,分别为1月(0.44)、4月(0.35)和9月(0.34)。
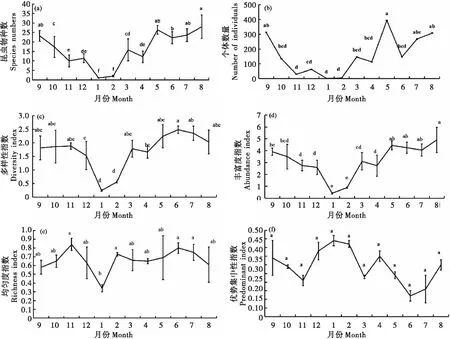
图1 喀斯特高原山区灌丛草地昆虫群落多样性动态变化(2018-2019年)
灌丛草地昆虫4个功能群个体数在不同时间的呈现趋势如图2所示。植食性昆虫个体数(图2-a)有4个峰值,变化趋势为1月最少(0.6头),5月最多(100.4头),6月时迅速减少,7月迅涨呈第二个峰值,8月又迅速降低,9月缓慢上升呈第三个峰值,10月缓慢降低,之后次年的2月升高呈第四个峰值,之后逐渐减少直至次年1月、2月最低,其中5月与8月、10月、11月、12月、1月、4月的植食性昆虫个体数均存在显著差异性(P<0.05);1月与5月、7月、9月的植食性昆虫个体数均存在显著差异性(P<0.05)。捕食性昆虫个体数(图2-b)有 3个峰值,变化趋势为由1月(1头)逐渐增加至7月最高(68.2头)呈现第一峰值,至8月降低,之后逐渐增加至9月呈现第二个峰值,10月急剧降低,至12月有所增加呈第三个峰值,之后逐渐减少到次年1月、2月最低;其中7月与5月、6月、8月、9月、12月的捕食性昆虫个体数无差异性外,其余均存在显著差异性(P<0.05);1月与2-5月、10月、11月的捕食性昆虫个体数无差异外,其余均存在显著差异性(P<0.05)。寄生性昆虫个体数(图2-c)有2个峰值,变化趋势为1月最少(0头),缓慢增加至3月呈第一个较小的峰值,4月稍有下降,至5月逐渐增加到7月呈第二个大的峰值(40.8个),8月逐渐减少至次年的1月达到最低,其中6月、7月、8月、9月分别与其他月份的寄生性昆虫个体数存在显著差异性(P<0.05);1月与2月、3月、4月、11月、12月的寄生性昆虫个体数无差异外,其余均存在显著差异性(P<0.05)。杂食性昆虫个体数(图2-d)有2个峰值,变化趋势为从1月(0头)开始逐渐增加至3月出现第一峰值,4月稍微降低,至5月呈现第二个峰值,之后在6月份急剧降低,6月后逐渐增加至9月出现第3个峰值且为最高峰(137.7头),10月后至次年1月缓慢较少,杂食性昆虫个体数在调查研究过程中9月与次年的8月均与其它月份的寄生性昆虫个体数存在显著差异性(P<0.05);1月与7月、8月、9月的寄生性昆虫个体数存在显著差异性(P<0.05),其余均无差异性。

图2 喀斯特高原山区灌丛草地昆虫功能群个体数动态变化
2.3 灌丛草地生态环境与昆虫群落多样性的相关性分析
生态环境与昆虫功能群个体数的相关性分析表明植食性昆虫(Ph)的个体数、丰富度、多样性指数与土壤温度、空气温度、植被物种数均呈极显著正相关关系(P<0.01);其丰富度、多样性指数与植被高度呈极显著正相关(P<0.01),与土壤含水量呈极显著负相关关系(P<0.01);其均匀度和优势度与空气湿度呈极显著负相关(P<0.01)(表2)。捕食性昆虫(Pr)的个体数、丰富度、多样性指数与土壤温度、空气温度、植被物种数均呈极显著正相关关系;其个体数和多样性指数与土壤含水量呈极显著负相关关系(P<0.01);其优势集中性指数与土壤温度、空气温度、植被高度、植被物种数均呈极显著负相关关系(P<0.01)。寄生性昆虫(Pa)的个体数、丰富度与土壤温度、空气温度、植被物种数均呈极显著正相关关系(P<0.01);其多样性指数、均匀度与土壤温度、空气温度均呈极显著正相关关系(P<0.01);其均匀度与空气湿度呈极显著负相关关系(P<0.01),而优势集中性指数与土壤温度、土壤含水量、空气温度、空气湿度、植被高度、植被物种数均呈负相关关系(P>0.05)。杂食性昆虫(Om)个体数、丰富度指数、多样性指数、均匀度指数均与空气温度呈极显著正相关关系(P<0.01);其个体数与土壤温度、植被高度、植被物种数均呈极显著正相关关系,而多样性指数和均匀度指数均与空气湿度呈极显著负相关关系(P<0.01)。昆虫的个体数、丰富度指数、多样性指数均与土壤温度、空气温度、植被物种数呈极显著正相关关系(P<0.01),其丰富度与植被高度呈极显著正相关关系,而优势集中指数与土壤温度、空气温度、植被物种数均呈极显著负相关关系(P<0.01)(表2)。
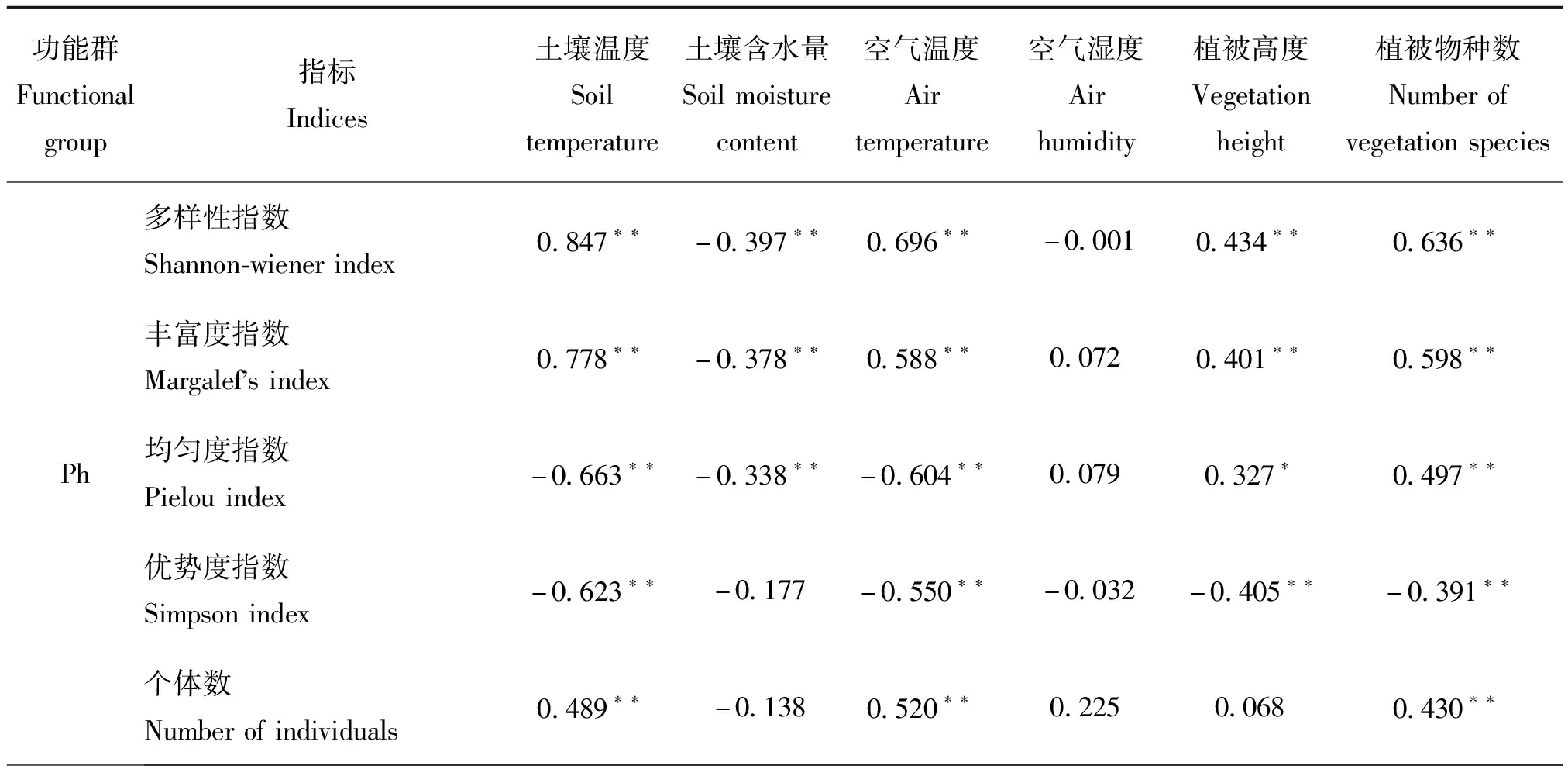
表2 环境因子与昆虫功能群的相关性分析
3 结论与讨论
本研究表明,在喀斯特灌丛草地不同季节昆虫群落组成与分布具有一定的差异。双翅目和膜翅目昆虫个体数量占据较大优势,这与王美娜等(2017)对山地昆虫研究结果相同。本研究的昆虫物种多样性大小变化与其丰富度和均匀度变化趋势一致,与其优势度相反,与周玉锋等(2009)对人工草地节肢动物多样性研究结果相同。个体数在6月份最高,这与李帅等(2016)对贵州人工混播草地昆虫群落多样性的研究结果相似。此外,昆虫多样性指数与均匀度指数一致时,昆虫群落结构较稳定(2011)。本研究结果表明昆虫多样性指数与均匀度指数变化趋势比较一致主要体现在5-8月(图1-c、1-e),说明喀斯特高原山区灌丛草地昆虫群落结构在5-8月比较稳定。
喀斯特灌丛草地功能群昆虫结构不同,本研究结果表明,杂食性昆虫最多,捕食性昆虫最少,与前人(李帅, 2016; 陈蔚, 2019)的研究结果相反,这是因为与研究区的生态环境有关,如杂食性昆虫蚊类数量随温度的升高而降低(童春富, 2002; 凡美玲, 2017)。研究区位于高海拔地区,温度较低,为杂食性昆虫提供了适宜的发育条件,此外,杂食性昆虫蚊科与蚁科个体数量异样,使得杂食性昆虫个体数量最多。杂食性昆虫数量多,说明灌丛草地害虫种群爆发的可能性较低(李志刚, 2016),同时,也是灌丛草地昆虫生态系统中对营养链的调控具有重要作用。此外,不同昆虫功能群除取食性不同外,生长发育、繁殖方式、活动等生物学特性也存在着一定的差异,从而导致不同的昆虫功能群个体数对生态环境因素的响应有着不同的变化模式。
灌丛草地昆虫群落组成与分布随季节的更替而产生差异,昆虫功能群个体数也随之发生变化。本研究结果显示植食性昆虫个体数在5月最多,这除了气温回暖引起之外,可能还与植食性昆虫有一部分为访花昆虫(蜜蜂科、花蝇科等)访问开花植物有关,而蜜源植物如火棘在5月仍任处于花期(朱欣, 2021),从而导致5月植食性昆虫多。捕食性昆虫与寄生性昆虫在7月个体数量最多,杂食性昆虫8月最多。主要是因夏季高温多雨,一方面促进植物与植食性昆虫生长繁殖,为另外三类昆虫功能群(捕食性昆虫、寄生性昆虫、杂食性昆虫)提供了丰富的食物资源,另一方面在草地生态系统中,灌丛草地在该气候条件下能为各类昆虫提供良好的栖息地和避难所(李文琼, 2017; Sloggett, 2020);同时草地植物群落的多样化也增强了自身的抗病虫害的能力,如蚂蚁以花蜜为食而保护植物免受其他害虫危害(Mohseni, 2021)。因此,捕食性昆虫、杂食性昆虫、寄生性昆虫数量在7月、8月达到最高。
昆虫多样性受诸多环境因素的影响,有研究认为温度是影响昆虫系统发育多样性的关键性生态因子之一(金倩, 2018),李欣芸等(2020)对贺兰山自然保护区昆虫多样性调查研究结果表明,在一定温度范围内,植食性的磷翅目昆虫多样性随温度的升高而升高;同时昆虫群落多样性随植被物种数的增加而增加(Litt, 2014)。本研究通过分析生态环境与昆虫功能群之间的相关性,结果表明土壤温度、空气温度、植被物种数与植食性昆虫、捕食性昆虫的个体数、丰富度、多样性指数均呈极显著正相关关系,而杂食性昆虫中仅有个体数、捕食性昆虫的个体数、丰富度与植被物种数均呈极显著正相关关系,这与陈蔚等(2019)对荒漠草原植物多样性对地面节肢动物功能群多样性的影响研究结果相似,这可能是因寄生性昆虫多数以腐殖质类动植物为食或为寄主(David, 2010),但其多样性指数、均匀度则与植被物种数无显著相关性,说明喀斯特灌丛草地生态系统在对寄生性昆虫的物种多样性的调节上很可能是通过植被物种多度来影响的,且在这一过程中植被物种多度对寄生性昆虫的物种数量和个体数量影响较明显,而对寄生性昆虫的活动、分布(即均匀度)等受影响不明显。其三,杂食性昆虫多样性指数等与植被物种数无显著相关性,可能是因为杂食性昆虫可以植物为食之外,其它资源如昆虫等也有可能是它丰富的食物来源。
昆虫群落多样性与温度、植被物种数有显著的相关性外,土壤含水量也是重要的因素之一(张艳, 2020),间接的影响昆虫群落的多样性。本研究结果表明土壤含水量与植食性昆虫、捕食性昆虫呈极显著负相关。因土壤含水量影响昆虫幼虫与成虫的取食行为与移动情况、生长发育情况,对成虫移动具有一定的导向作用(常晓娜, 2008),如陈法军等(2003)研究表明,土壤含水量越高,幼虫与蛹的死亡率越高。土壤含水量与寄生性昆虫、杂食性昆虫相关性不明显,原因可能是该类昆虫栖息方式(如不是土栖昆虫)和取食方式不同造成,如对水分的索取主要依赖于其寄主等。但土壤水分条件好能够促长丰富的植被,从而为昆虫提供丰富的食物与栖息地(刘继亮, 2017),但寄生性昆虫和杂食性昆虫的物种多样性并未与植被物种数相关性呈明显相关(表2),因此,寄生性昆虫、杂食性昆虫与土壤相关性较弱。
此外有研究表明,植被高度是直接或间接影响昆虫群落多样性的重要因素之一,植被高度从时间和空间上影响昆虫食物资源的丰富度与栖息地的复杂情况,植被复杂程度通过植被高度简单的表现出来,植被结构越复杂,如丰富的凋落物、土壤腐殖质、家畜排泄物等可为昆虫利用(Körösi, 2012; Streitberger, 2016)。因此在植被高度的一定范围内,昆虫种类和数量随植被高度的增加而增加(刘继亮, 2017)。
本文对喀斯特高原山区灌丛草地昆虫群落多样性研究调查结果表明,双翅目(蚊科)与膜翅目(蚁科)昆虫为优势类群,可作为灌丛草地的指示性昆虫;灌丛草地昆虫群落多样性随季节时序变化,反映出群落结构的稳定性主要表现在5-8月;功能群中杂食性昆虫最为丰富;灌丛草地生态环境与昆虫均有一定的相关性,其中土壤温度、空气温度、植被物种数相关性最强;研究结果可为保护喀斯特高原山区灌丛草地生态系及其生物多样性提供数据支撑。
