利用逆转录环介导恒温扩增技术建立新型冠状病毒核酸快速检测方法
2021-10-20徐秋月王云娟唐睿珠
李 欢,徐秋月,王云娟,苏 洋,唐睿珠
(昆明医科大学第一附属医院医学检验科,云南省实验诊断研究所,云南省检验医学重点实验室,云南 昆明 650032)
2019 年 12月,我国武汉市报道了多例病原体不明的肺炎病例,随后在全中国乃至世界多国暴发流行。2020 年 1 月 7 日,ZHOU 等[1]通过病毒分离和基因组测序,发现引起该肺炎的是一种新型冠状病毒。国际病毒分类委员会将其正式命名为严重急性呼吸道综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[2]。SARS-CoV-2属于β冠状病毒属,其基因组为单链正股RNA,长度为29 881个核苷酸[3]。SARS-CoV-2感染导致的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)传染性强,人群普遍易感,目前全球的疫苗普及率还有待提高,因此及早发现 SARS-CoV-2 感染者并进行有效的隔离与治疗,仍是当下控制疫情最有效的方法。核酸检测是确诊 SARS-CoV-2 感染的最主要的依据,血清学抗体检测是重要的补充方法。目前可用于 RNA 病毒的核酸检测技术主要有基因测序、聚合酶链式反应(polymerase chain reaction,PCR)、基因芯片和恒温核酸扩增等。其中Real-Time qRT-PCR(Real-time quantitative reverse transcription PCR)检测方法是首选方案[4],但该法对操作人员、设备以及实验室环境等要求较高。基因测序和基因芯片技术需要特殊设备,如测序仪、电泳仪及凝胶记录系统等,且存在检测周期长、操作复杂等诸多不便因素。这些方法并不适用于现场、基层医疗单位及资源贫乏的环境下使用。云南省位于我国边境,防疫情输入压力巨大,边境地区条件有限,因此疫情防控工作中需要采用高性能、快速且易操作的方法来进行新冠病毒核酸检测。
恒温扩增技术是新发展起来的一种核酸检测技术,由于其扩增不需要变温循环的特点受到关注,有望成为分子诊断中PCR的替代技术[5-6]。不同于常规PCR方法,恒温扩增方法不需要变温仪器和多个热循环程序,只需要在一个恒定的温度下就可对核酸进行指数扩增。其中逆转录环介导恒温扩增(RT-loop-mediated isothermal amplification,RT-LAMP)是在恒温条件下,利用链置换DNA聚合酶和针对靶基因6~8个区域设计的4~6条引物即可实现对RNA进行快速(扩增时间通常小于1 h)高效(大于109倍)扩增的检测技术。并且反应结束之后,不需要仪器,凭借肉眼观察颜色变化即可知道扩增结果为阴性或阳性。环介导恒温扩增技术在仪器需求、检测效率、操作方法、结果判读等方面均具有优势,非常适合在条件有限的环境下使用。
1 材料与方法
1.1 新型冠状病毒核糖核酸基因组标准物质
笔者从中国计量科学研究院订购了编号为GBW(E)091099的新型冠状病毒核糖核酸基因组标准物质。该标准物质为人源核糖核酸基因组,含有新型冠状病毒全部基因,包括全长的特征核壳蛋白N基因和开放阅读框1ab(ORF1ab)基因。N基因浓度为1.73×103copies/μL,ORF1ab基因浓度为8.96×102copies/μL。
1.2 核酸提取
新冠病毒标准物质用DNA/RNA磁珠法核酸提取试剂盒(天隆科技有限公司,西安,中国)提取,按厂家说明书进行操作。提取好的核酸放置-80 ℃备用。
1.3 引物设计
为了鉴定SARS-CoV-2,选择其特异性的ORF1ab基因和N基因作为目标基因,从GeneBank下载这两个目标基因的序列。参照疾病预防控制中心(CDC)公布的特征核壳蛋白N基因和开放阅读框1ab(ORF1ab)基因检测靶位[7]附近,采用Geneious10.2.3软件将各序列段与SARS病毒、MERS病毒和甲乙流感病毒序列进行比对,以确保所选序列的特异性,并用primer explorer V.5(http://primerexplorer.jp/e/)软件设计各靶基因的LAMP反应引物:F3,B3两条外引物和FIP,BIP两条内引物以及LF或LB环引物,各亚型引物序列见表1,由上海生工生物工程股份有限公司合成。

表1 RT-LAMP引物序列Tab.1 Primer sequences for RT-LAMP
1.4 RT-LAMP反应
LAMP检测试剂为WarmStart Colorimetric LAMP 2×Master 1.4 mM的dNTP Mix,320 U的Bst3.0 DNA Polymerase),2.5 μL 引物混合液(FIP、BIP各40 pmol,B3和F3为5 pmol,LB为20 pmol),1 μL cDNA模板,9 μL Rnase free水。RT-LAMP扩增条件为65 ℃、60 min,扩增仪器使用基因扩增仪(天隆Genesy 96T,西安,中国)。当试剂反应体系由红色变为黄色时结果判断为阳性,若始终为红色则为阴性。
1.5 特异性评价
将新型冠状病毒标准物质用于特异性评价,先提取标准物质的RNA,再用针对ORF1ab基因和N基因两套引物分别进行RT-LAMP检测,以甲型、乙型流感病毒质粒以及灭菌注射用水为模板作阴性对照。以新型冠状病毒标准物质为模板时,结果应为阳性;以甲乙流感病毒质粒以及去离子水为模板时,结果应为阴性。
1.6 最低检测限评价
将提取出的新型冠状病毒标准物质(N基因浓度 为1.73×103copies/μL,ORF1ab基因浓度为8.96×102copies/μL)用 DEPC水(diethyl pyrocarbonate,焦碳酸二乙酯)稀释至0.50×103copies/μL(目前临床常用的商品化qRT-PCR试剂的最低检测限)附近。N基因浓度稀释为0.87×103copies/μL、0.50×103copies/μL、0.40×103copies/μL。ORF1ab基因浓度稀释为0.60×103、0.50×103copies/μL。准备10份原浓度和各稀释浓度的标准物质后分别提取核酸,再采用RT-LAMP方法进行检测,以阳性检出率为100%的最低浓度为该目标基因的最低检测限浓度。
1.7 抗干扰能力评价
以一例正常人新鲜血液样本、一例鼻腔分泌物、灭菌注射用水和细胞保存液样本分别作为干扰物,各吸取20 uL(按提取样本体积的10%)加入到稀释至最低检测限的新型冠状病毒标准物质和灭菌注射用水中参与提取,然后用RT-LAMP方法进行检测。加入干扰物后,检测结果的阴阳性应不受影响。
1.8 最佳反应时间评价
观察以稀释至各基因最低检测限的新型冠状病毒标准物质为模板在不同的RT-LAMP扩增时间(40 min,50 min,60 min)的反应结果,以权衡选择最佳的反应时间。
2 结果
2.1 特异性评价
设计针对新型冠状病毒ORF1ab基因和N基因出的2套内、外引物,并在其中筛选出的一套最佳引物和相应的环引物。以新型冠状病毒标准物质为模板时,RT-LAMP反应结果应为阳性;以甲型、乙型流感病毒质粒和灭菌注射用水为模板时,RT-LAMP反应结果为阴性(图1)。

图1 特异性评价Fig.1 Evaluation of specificity
2.2 最低检测限评价
采用RT-LAMP方法将10份原浓度和各稀释浓度的新型冠状病毒标准物质进行检测,以100%阳性检出率的最低浓度为该目标基因最低检测限。因此ORF1ab基因的最低检测限为0.60×103copies/μL(图2),N基因的最低检测限为0.50×103copies/μL(图3)。
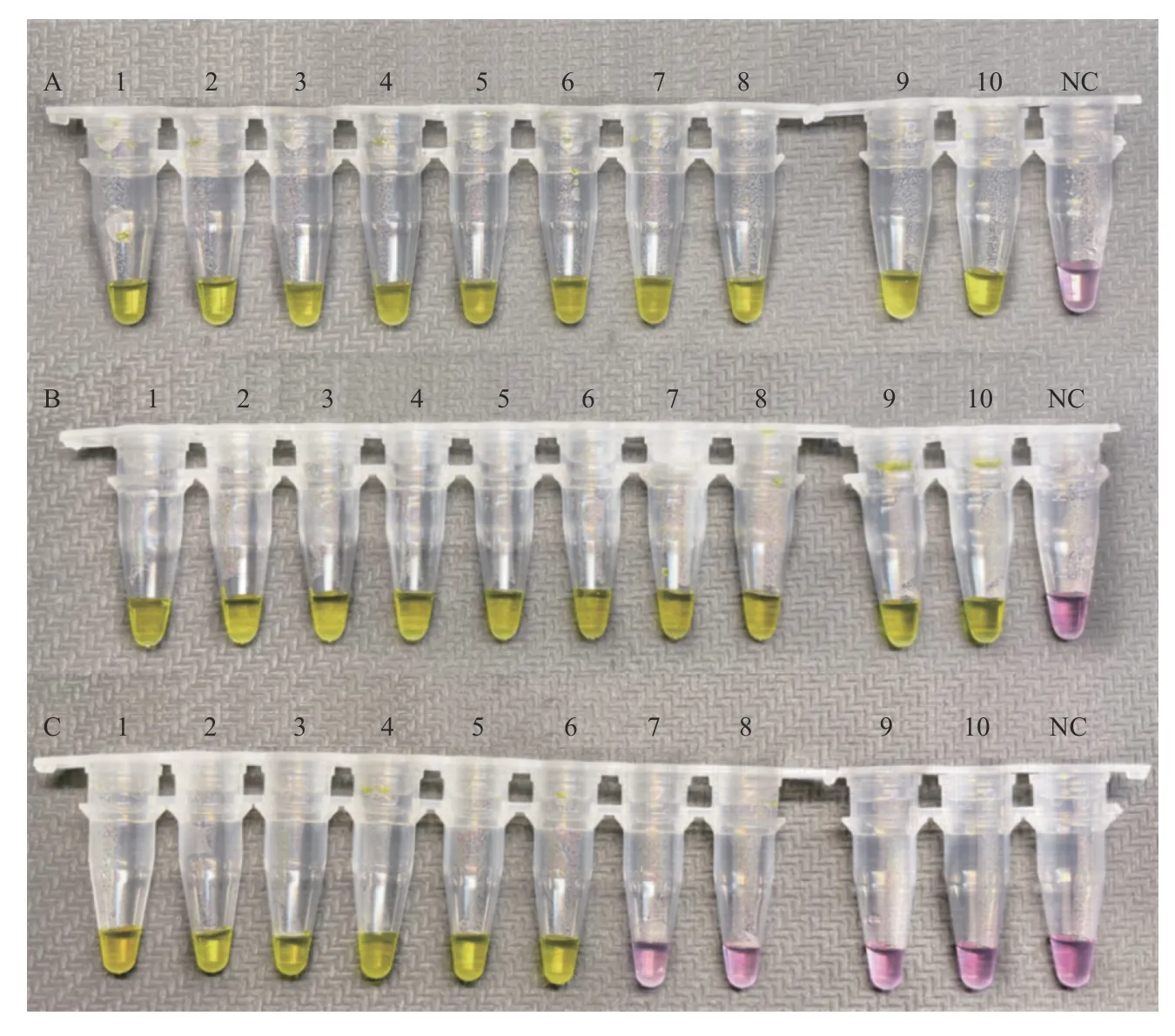
图2 ORF1ab基因的最低检测限评价Fig.2 Evaluation of limit of detection of ORF1ab gene set

图3 N基因的最低检测限评价Fig.3 Evaluation of limit of detection of N gene set
2.3 抗干扰能力的评价
针对新型冠状病毒ORF1ab基因和N基因2套试剂体系在新型冠状病毒标准物质(模拟阳性样本)和灭菌注射用水(模拟阴性样本)中的抗血液、鼻分泌物和样本保存液干扰能力良好,阴阳符合率均为100%(图4)。

图4 抗干扰能力评价Fig.4 Evaluation of anti-interference ability
2.4 最佳反应时间评价
为了评估新型冠状病毒ORF1ab基因和N基因RT-LAMP的最短扩增时间,将标准物质稀释至最低检测限附近进行RT-LAMP反应,在40 min,50 min,60 min时结束反应。结果表明ORF1ab基因在50 min变为阳性,N基因在40 min变为阳性(图5)。并且N基因在40 min仍然为阳性。因此,50 min为该体系的最佳反应时间。
2.5 结果的判读
在SARS-CoV-2的结构蛋白中,N蛋白是最保守的,检测序列特异性的N基因可作为冠状病毒属初步筛选的靶位。ORF1ab基因的同源性较低,可作为区分SARS-CoV-2与其他冠状病毒的重要靶位。因此,联合N基因和ORF1ab基因的检测结果进行综合分析,可尽量避免样本漏检和假阳性。因为本试剂体系是对两个基因分别进行检测,所以其实验结果应综合分析,对于结果的判读见表2。

表2 RT-LAMP反应结果的判读Tab.2 Strategies for judging RT-LAMP results of SARS-COV-2
3 讨论
虽然目前我国已经有效控制住了新型冠状病毒的传播,进入疫情防控常态化阶段,但境外新冠肺炎疫情仍然呈暴发蔓延态势。云南省位于我国边境与多个国家接壤,并且近期邻国缅甸国内爆发政变,导致边境城市疫情输入和扩散风险剧增。根据目前最新版新冠肺炎诊疗方案,确诊新型冠状病毒肺炎的首要标准仍为新冠病毒核酸阳性,而新冠病毒特异性抗体仅作新型冠状病毒核酸检测的补充指标,不能完全作为新冠肺炎的确诊依据。qRT -PCR 法是目前检测新冠病毒核酸最常用方法,但对操作人员、设备以及实验室环境等要求较高[8],对于实验条件有限的边境地区不太适用,因此在边境疫情防控工作中需要采用高灵敏、易操作、检测周期短的方法来进行新型冠状病毒肺炎核酸检测。
核酸扩增技术分为2大类:一类是以PCR为代表的非恒温扩增技术,另一类则是恒温扩增技术。近年来核酸恒温扩增技术得到了迅猛的发展与完善。其中,环介导恒温扩增技术只需在某个恒定的温度下、一个反应步骤即可扩增特异性核酸片段。该技术不需要精密的仪器对反应体系进行反复升降温,同时省去了多个循环进行变性、退火和延伸的耗时过程。并且LAMP技术的一个明显优势是可进行高通量检测,可实现标本的连续检测。由于该技术对引物设计要求很高,针对靶基因上6个区域设计特异性的引物,因此大幅提高了扩增反应的特异性。并且对于反应结果的判读简洁明了,只需要肉眼观察有无扩增反应产物生成就可以确认是否有靶基因存在。LAMP技术简单、快速、特异性强,去除了精密复杂的仪器设备的限制,反应时间短,结果判读简洁直观[9-10]。因为反应温度恒定,在检测过程中可不断插入新样本而对之前的反应不会造成影响,因此可实现标本高通量的自动化检测,十分适合在边境地区推广和应用。常用的LAMP 扩增结果的目测方法有浊度指示法、荧光染料法以及指示剂显色法等。浊度指示法是在试剂体系中加入钙黄绿素,在反应结束后就可通过扩增产物的浑浊度来判读阴阳性。荧光染料法通常以 SYBR Green I作为显色指示剂,但该荧光染料需要反应后开盖加入,增加了扩增产物污染实验室的风险。我们选用的是 NEB 公司产品,反应前已经预加入酚红为显色指示剂,酚红颜色在扩增反应前后随产物pH 值变化而变化(如在 pH 值高于8.2时为红色,而低于6.6时为黄色),肉眼判读结果比较直观[11-12]。
引物组属于检测体系的核心组分,我们选择新冠病毒的ORF1ab基因和N基因作为目标检测基因。针对新冠病毒核酸的检测,ORF1ab基因特异度高,N基因敏感度高,单独使用ORF1ab基因和N基因的准确率分别为99%、92.3%,联合检测结果的准确率为99%[13]。通过对两个基因的联合检测,N基因可以检测到低载量的病毒,降低漏检率,ORF1ab基因可以降低假阳性率,因而既保证了SARS-CoV-2检测的敏感性也保证了特异性。笔者参照CDC公布的新冠病毒的ORF1ab和N基因检测靶位附近分别设计出针对两个基因的3套内、外引物。从这些引物中测试、筛选出最佳的引物组。进而设计了这些最佳引物的环引物,以缩短反应时间,继续筛选出最佳的环引物后,系统优化、获取了RT-LAMP检测体系。并在特异性、最低检测限、抗干扰能力和最佳反应时间实验中,经检测标准物质,结果与预期相符,证实了该检测体系的可行性。
本研究所建立的新冠病毒RT-LAMP的方法依然存在一些局限性,例如检测结果虽然可以通过颜色变化来断定,但这种判断具有一定主观性,而且肉眼观察的颜色变化的敏感性相对较差[14],如采用荧光方法进行检测将明显提升检测的敏感性,同时采用仪器进行检测可避免肉眼判断结果的主观性,但是我们的体系是针对的是条件有限的边境地区,因此用肉眼观察适用性更强。此外,本研究建立的方法的灵敏度还不够理想。提高灵敏度可考虑扩大反应体系,增加提取核酸的量、增大模板量等,但是这将增大试剂成本。
总之,笔者建立的新冠病毒RT-LAMP方法已达到了研究目的,基于此方法的高特异性,高灵敏度,低成本的特性,非常适合在条件有限的边境地区开展利用。
