硫嘌呤类药物的遗传药理学研究及其在儿科相关疾病中的正确应用
2021-10-19郭宏丽胡雅慧龙佳奕
郭宏丽,胡雅慧,夏 颖,龙佳奕,2,陈 峰*
1南京医科大学附属儿童医院药学部药学研究中心,江苏 南京 210008;2中国药科大学基础医学与临床药学学院,江苏 南京 211198
硫嘌呤类药物包括硫鸟嘌呤(thioguanine,6⁃TG)、巯嘌呤(6⁃mercaptopurine,6⁃MP)及其前体药物硫唑嘌呤(azathioprine,AZA),是常用的免疫抑制药物,在儿童急性淋巴细胞白血病(acute lymphoblas⁃tic leukemia,ALL)、炎症性肠病(inflammatory bowel diseases,IBD)、自身免疫性肝炎(autoimmune hepati⁃tis,AIH)等疾病的治疗中发挥重要作用。该类药物主要通过干扰嘌呤代谢进而抑制细胞DNA、RNA以及蛋白质的合成发挥免疫抑制作用。然而,硫嘌呤类药物选择性较差,对正常细胞也有很强的抑制作用,常出现以白细胞减少为主的骨髓抑制导致治疗的中断或感染等并发症,尚有肝损伤、流感样症状、胰腺炎等不良反应,严重者甚至威胁生命。临床实践证明硫嘌呤类药物的不良反应具有明显的个体差异和种族差异,药物基因组学的研究揭示了这种差异的部分原因。治疗药物监测(therapeutic drug monitoring,TDM)技术通过监测药物的浓度为硫嘌呤类药物的个体化用药提供一定支持。本文通过对硫嘌呤类药物体内代谢转化关键调控酶基因突变、活性代谢物的浓度与临床疗效和不良反应的相关性分析,探讨基于基因型和TDM 的剂量调整策略,为硫嘌呤类药物的精准用药提供参考。
1 硫嘌呤类药物的代谢及物质作用基础
硫嘌呤类药物本身没有活性或活性很低,在体内经过代谢转化成为活性代谢产物6⁃TGNs 而发挥药理作用。AZA 口服吸收后在谷胱甘肽硫转移酶的作用下生成6⁃MP。6⁃MP 进入在体内有3 种代谢途径(图1)[1]:①通过黄嘌呤氧化酶(xanthine oxi⁃dase,XO)代谢成无活性的6⁃硫尿酸;②通过硫嘌呤⁃S⁃甲基转移酶(thiopurine methyltransferase,TPMT)转化成无活性的6⁃甲基巯嘌呤(6⁃methylmercaptopu⁃rine,6⁃MMP);③依次在次黄嘌呤⁃鸟嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyl transferase,HG⁃PRT)、次黄嘌呤单磷酸脱氢酶(inosine monophos⁃phate dehydrogenase,IMPDH)及鸟苷酸合成酶(gua⁃nosine monophosphate synthetase,GMPS)的作用下代谢生成活性代谢产物6⁃硫鸟嘌呤核苷酸(6⁃TGNs),转运蛋白MRP4 将其转出细胞外。在此条途径中,6⁃巯基次黄嘌呤单磷酸盐(6⁃thioinosine monophos⁃phate,6⁃TIMP)可在TPMT的作用下甲基化后生成6⁃甲基硫嘌呤核糖核苷酸(6⁃methylmercaptopurine ri⁃bonucleotides,6⁃MMPR);同时,6⁃TIMP 在一磷酸激酶(monophosphate kinase,MPK)、二磷酸激酶(di⁃phosphate kinase,DPK)的催化下分别形成6⁃巯基次黄嘌呤 二磷酸盐(6⁃thioinosine diphosphate,6⁃TIDP),和6⁃巯基次黄嘌呤三磷酸盐(6⁃thioinosine triphosphate,6⁃TITP),后者在肌酐三磷酸焦磷酸酶(inosine triphosphate pyrophosphatase,ITPase)的催化下再次形成6⁃TIMP,形成一个循环。以上代谢途径中,代谢通路①和②为硫嘌呤类药物在体内的主要转化过程,而通路③为次要的代谢途径,但该途径可产生活性代谢产物。
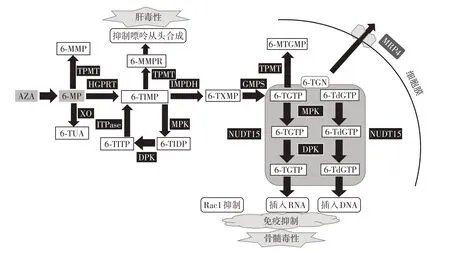
图1 硫嘌呤类药物的代谢和转运[1]Figure 1 The metabolism and transformation of thiopurine drugs
在所有代谢产物中,6⁃TGNs 结构与鸟嘌呤类似,是硫嘌呤类药物产生生物学作用的主要活性物质,包括6⁃硫鸟嘌呤单磷酸盐(6⁃thioguanine mono⁃phosphate,6⁃TGMP)、二磷酸盐(6⁃thioguanine di⁃phosphate,6⁃TGDP)和三磷酸盐(6⁃thioguanine tri⁃phosphate,6⁃TGTP),以及6⁃脱氧硫鸟嘌呤单磷酸盐(6⁃thio⁃deoxyguanine monophosphate,6⁃TdGMP)、二磷酸盐(6⁃thio⁃deoxyguanine diphosphate,6⁃TdGDP)和三磷酸盐(6⁃thio⁃deoxyguanine triphosphate,6⁃TdGTP)等在内的6 种物质。此6 种物质可在MPK、DPK 以及裸子水解酶(nudix hydrolase 15,NUDT15)的催化下,形成一个代谢循环。其中,6⁃TGTP 和6⁃TdGTP 被认为是最终发挥生物学功能的主要物质,可分别通过插入RNA 和DNA 进而干扰核苷酸的生物合成,产生免疫抑制作用[2]。另有研究显示6⁃TGTP可替代三磷酸鸟嘌呤与Rac1蛋白(Rho蛋白家族重要成员,参与细胞增殖过程)结合并通过调节T淋巴细胞中的Vav⁃Rac1信号通路使其失活,诱导T淋巴细胞凋亡,发挥免疫抑制作用[3]。
硫嘌呤类药物的主要不良反应与代谢产物密切相关,6⁃TGNs也被认为是产生骨髓毒性的主要物质,大量研究证实红细胞内6⁃TGNs的浓度增加与巯嘌呤所致的白细胞减少症密切相关[4]。另一方面,甲基化代谢产物6⁃MMPR能够抑制嘌呤的从头合成,是硫嘌呤类药物发挥抗增殖活性的原因之一[5]。研究认为红细胞内6⁃MMPR 与6⁃MMP 的水平过高与硫嘌呤类药物导致的肝毒性有一定相关性[6]。因此,代谢转化中的关键酶(如TPMT、ITPase、NUDT15)的遗传变异将对硫嘌呤类药物的药代动力学、药效动力学以及不良反应产生重要影响。
2 硫嘌呤类药物的遗传药理学研究
2.1 TPMT
TPMT 在硫嘌呤类药物代谢过程中发挥关键作用,也是研究最早也最为全面的代谢酶。TPMT 功能缺失将导致活性代谢产物6⁃TGNs水平的升高,进而显著增加白细胞减少症发生的风险。1980 年,Weinshiboum 和Sladek 首次报道了TPMT 的酶活性存在个体差异,可分为高、中和缺失3 种水平,在高加索人群中,89%是高活性群体,11%是中间活性,只有0.3%的人TPMT酶活性缺失[7]。此后这种分类方式被广泛使用,越来越多的研究发现基因多态性是引起TPMT 酶功能缺失的原因之一[8]。目前虽有超过40 个位点的突变(TPMT*2⁃*41)与TPMT 酶活性降低相关[9],但绝大部分(约90%以上)TPMT酶活性的缺失可归因于TPMT*2(238G>C),*3A(460G>A,719A>G),*3B(460G>A)和*3C(719A>G)几个位点的突变,TPMT 基因分型通常由以上几个突变位点决定[10]。其中,全基因组关联分析(genome⁃wide association studies,GWAS)显示*3A和3C的基因多态性与巯嘌呤的不良反应间有着最强的相关性[11]。基因多态性引起的TMPT缺陷是硫嘌呤诱导的白细胞减少症的可靠标志[12],因此多项指南推荐在服用硫嘌呤类药物之前检测TPMT的基因多态性以选择合适的剂量。临床药理学实施联盟(Clinical Pharma⁃cogenetics Implementation Consortium,CPIC)在2011版指南中推荐[13]:TPMT杂合突变的患者(中间代谢型,*1/*2,*1/*3A,*1/*3C等)按照标准剂量的30%~70%服药[6⁃MP,50 mg/(m2·d)或0.75 mg/(kg·d);AZA,1.0~1.5 mg/(kg·d)];纯合突变患者(活性缺失,*3A/*3A,*2/*3A,*3A/*3C,*2/*3C 等)只需要服用不超过10%标准剂量的药物,同时减少给药频次。
然而,TPMT 基因多态性的检测临床应用仍存在诸多问题。首先,TPMT 的酶活性不是由单一单核苷酸多态性(single nucleotide polymorphisms,SNP)决定,在编码区及非编码区均存在可能引起TPMT 酶功能改变的变异,但商业化测试通常只能检测部分SNP,无法检测稀有或未发现的变异,很难确定患者的确切基因型。另外,环境因素亦会影响TPMT的表达,研究表明巯嘌呤治疗期间TPMT的表达有所增加,而年龄和肾功能不全则会导致TPMT表达降低。由此可见,与TPMT 基因分型相比,TP⁃MT酶活性的检测是预测硫嘌呤合适剂量的更准确策略,但目前尚无合适的酶活性检测方法,难以用于临床实践。更加值得注意的是,TPMT 各位点的突变频率存在明显的种族差异(表1,https://www.pharmgkb.org),TPMT*2,*3A,*3B 和*3C 在欧洲及非裔人群中均有一定的突变频率,但亚裔人群仅以TPMT*3C 可见[14]。在两项共3 554例日本个体参与的全基因组分析研究显示,等位基因*3A和*3B并不存在(未观察到),而*3C 的存在也仅有0.96%[15-16]。同样,在一项包括253 例中国汉族人的研究中[17],TPMT*2,*3A 和*3B 的突变也未观察到,*3C 的突变频率为1.6%,但巯嘌呤所致的白细胞减少的发生率高达25.7%,二者之间未见明显相关性。显然,TPMT 基因在东亚人群中的较低突变频率(<2%)并不能解释该人群服用硫嘌呤类药物后较高的不良反应发生率(>20%),提示推荐的TPMT 基因检测并不适合亚洲人群,更加深入的研究仍需进行。
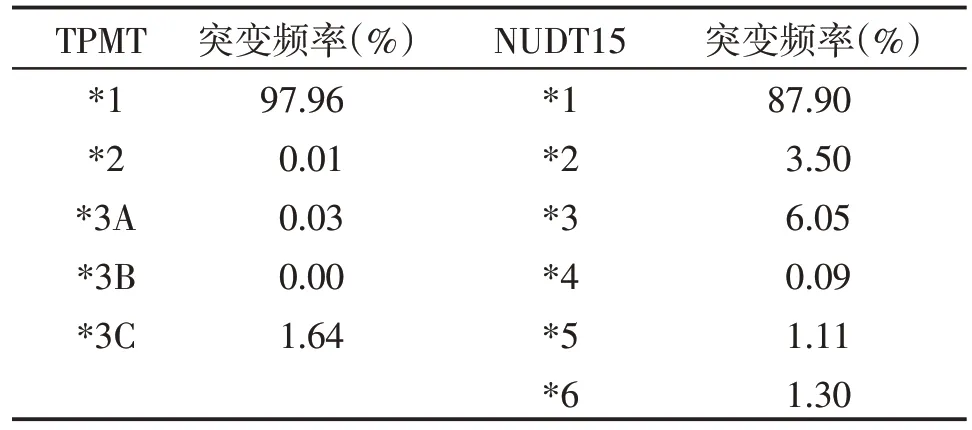
表1 TPMT 和NUDT15 各位点在东亚人群中的突变频率及表型频率Table 1 Mutatim frequencies of TPMT and NUDT15 in the East Asian population
2.2 NUDT15
2014年,Yang等[18]在韩国克罗恩病患者群体中首次发现NUDT15 p.Arg139Cys(R139C)位点的突变与该群体服用AZA 所致的早期白细胞减少症的发生显著相关(OR=35.6;P=4.88×10-94),巯嘌呤的药物基因组学研究取得了重大突破,随后这种相关性也在中国[17]、印度[19]IBD 人群中被证实。同样,在ALL患者群体中的研究也发现NUDT15基因多态性与巯嘌呤导致的骨髓抑制密切相关[20-21]。基于以上研究,CPIC 在2018 年更新了巯嘌呤的剂量调整指南,建议ALL患者根据TPMT和NUDT15二者的基因多态性共同指导巯嘌呤类药物的初始剂量选择[22]。
NUDT15 是一种裸子水解酶,隶属于NudiX 家族,可以将巯嘌呤的活性代谢产物6⁃TGTP 和6⁃TdGTP分别水解为相应的无活性的单磷酸盐形式6⁃TGMP和6⁃TdGMP。因此,NUDT15功能缺陷导致活性代谢产物6⁃TGTP和6⁃TdGTP蓄积,使得更多的6⁃TGTP 有机会插入DNA(DNA⁃TG,主要的抗白血病代谢产物[23]),从而导致DNA 损伤和细胞凋亡[21]。以往的大部分研究认为,巯嘌呤诱导的白细胞减少与升高的6⁃TGNs 水平相关。然而,NUDT15各基因型患者之间的6⁃TGNs 水平却无明显差异[24],但NUDT15 基因突变患者DNA⁃TG 水平显著增加[21]。因此,根据NUDT15 基因分型调整巯嘌呤服药剂量时,相比于6⁃TGNs 水平,代谢物DNA⁃TG 水平更具有参考意义[25]。
引起p.Arg139Cys 突变的SNP(rs 116 855232;c.415C>T)是第一个与硫嘌呤毒性有关的NUDT15突变,体外研究表明这种精氨酸到半胱氨酸的改变导致酶活性和蛋白质稳定性几乎完全丧失[26]。在ALL 患儿中,p.R139C 等位基因纯合突变的患者仅耐受8%标准剂量的巯嘌呤,而杂合突变和野生型的患者耐受的剂量强度分别为63%和83.5%[27]。Moriyama 等[21]研究亦表明,携带该等位基因的患者显示出过量的DNA⁃TG水平及严重的骨髓抑制。在此研究中,Moriyama 等学者共鉴别了p.Arg139Cys、Arg139His、Val18Ile、p.Val18_Val19insGlyVal 等4 个编码基因的突变,并定义了这4 个突变的6 种单倍型(*1~*6)。根据预期的酶活性将人群分为3 种表型:正常(*1/*1),中间(1/*2,*1/*3,*1/*4 和*1/*5)和低活性(*2/*3,*3/*3 和*3/*5)。此外,p.Arg34Thr,p.Lys35Glu,p.Gly17_Val18del等几种罕见突变也被报道[28],能够降低患者对巯嘌呤的耐受性,但是由于突变较少,临床可操作性比较低,其酶活性与巯嘌呤导致的不良反应间的相关性还未完全明确。
迄今为止的研究均表明,对于p.Arg139Cys纯合突变的患者,硫嘌呤类药物诱导的白细胞减少和严重脱发是不可避免的。因此,p.Arg139Cys位点的突变情况可作为预测服用巯嘌呤的患者发生严重白细胞减少和脱发等不良反应的可靠指标[1]。若仅检测p.Arg139Cys 位点,NUDT15 的活性可被分为正常(Arg/Arg),中间(Arg/Cys)或者低活性(Cys/Cys)。在此情况下,其他二倍型个体,如*1*5,*1*6,*3*5以及*2*6 则可能被漏检。在Chao 等[29]学者的研究中显示,NUDT15 p.Arg139Cys 位点检测的预测敏感性为49.2%,若是联合*5、*6 位点的检测,敏感性可提高至55.4%,但是二者突变频率较低(约1%,表1)。因此,临床应用中需要综合考虑这些位点的突变频率以及检测成本以辅助患者的合理用药,稀有突变位点与药物疗效及不良反应的临床相关性仍需大型队列研究进行证实。
2.3 三磷酸肌苷焦磷酸酶(ITPase)
ITPase 广泛存在于红细胞和白细胞内,可将6⁃TITP催化水解成为6⁃TIMP,减少代谢产物6⁃TITP在细胞内的堆积。6⁃TITP与6⁃T(d)GTP竞争核苷酸的作用相似,也可插入DNA 和RNA 分子,产生细胞毒性。研究显示,ITPA 94C>A 和IVS2+21A>C 两个位点的突变导致ITPase酶活性的降低,使得6⁃TITP水平增加,导致巯嘌呤所致的白细胞减少、流感样症状以及胰腺炎等不良反应风险增加[30]。另一方面,在ALL患儿的研究中发现,ITPA 94C>A突变型患者红细胞内6⁃MMPR 浓度显著高于野生型患者,肝毒性风险增加[31]。
目前为止,ITPA 共有多个SNP 位点被发现,其中G138A、G561A 以及G708A 是沉默的无意义突变,而C94A和IVS2+A21C则是导致酶活性降低的错义突变。ITPA 单倍型结构的分析表明,ITPA 94C>A(rs1127354)是决定ITPA 低酶活性中最相关的多态性[32]。ITPA 94C>A 等位基因的突变频率具有较大的种族差异性,在高加索和非裔人群中为5%~7%,西班牙裔为1%~2%,而在亚洲人群中高达19%[33]。有趣的是,在各种族中ITPA 94C>A 与TP⁃MT 的突变频率恰好相反。在日本服用AZA/6⁃MP的患者中,ITPA 基因多态性比TPMT 更能预测硫嘌呤药物的疗效和不良反应[34]。因此,相比于TPMT,亚洲人群中硫嘌呤类药物的不良反应可能受ITPA基因多态性的影响更大。
值得注意的是,ITPA基因多态性与硫嘌呤类药物的疗效和不良反应的相关性研究结论并不一致,有研究发现ITPA 94C>A 基因多态性与巯嘌呤不良反应间缺少相关性[35],无法有效预测使用AZA治疗的IBD 患者的不良反应,ITPA 基因多态性对6⁃MP的剂量也没有影响[36]。然而,Stocco 等[31]学者对St.Jude 儿童医院的患儿再次分析发现,在未根据TP⁃MT 基因型或者6⁃TGNs 浓度调整巯嘌呤剂量时,患儿的感染不良反应仅与TPMT相关,与ITPA基因多态性不相关;但在根据TPMT基因型调整剂量之后,ITPA 基因多态性与患儿的热性中性粒细胞减少症的风险则密切相关。因此,作者认为TPMT 基因分型不明确时就进行ITPA 作用的评价可能是前期研究结论不一致的原因之一。总之,ITPA基因多态性对临床的指导意义还需深入研究。
2.4 多药耐药相关蛋白(MRP4)
MRP4 属于ATP 结合盒转运蛋白家族,由ABCC4 基因编码,参与巯嘌呤的代谢转运,通过外排胞内的代谢物而发挥细胞保护作用[37]。动物实验发现,MRP4 基因敲除小鼠细胞内巯嘌呤代谢物浓度显著增加,毒性更大且生存期缩短[38]。MRP4⁃G2269A(rs3765534)位点的突变将导致MRP4 功能的缺失。研究发现,携带MRP4⁃G2269A等位基因的患者细胞内6⁃TGNs水平显著增加,白细胞减少风险亦显著增加[39]。另有研究证实ABCC4 rs2274407基因型(CCvs.AA+CA)与巯嘌呤所致的中性粒细胞减少症和白细胞减少症的较高风险显著相关[40]。然而,单独的MRP4 基因多态性难以解释亚洲人群中观察到的高频率巯嘌呤毒性。已有研究证实,MRP4 和NUDT15 间有基因⁃基因相互作用,二者等位基因均携带的患者白细胞减少的发生风险更高,需要减少巯嘌呤的使用剂量[41-42]。
2.5 其他基因多态性
PACSIN2 是“神经元蛋白家族中蛋白激酶C 和酪蛋白激酶底物”成员,在体外细胞实验及ALL 患者中均证实PACSIN2(rs2413739)基因多态性能够导致TPMT 酶活性下降,与巯嘌呤的不良反应风险有相关性[43]。此外,Alenka等[44]研究发现,PACSIN2等位基因携带者血液毒性风险增加,作者认为PAC⁃SIN2 是Rac1 的作用因子,其与Rac1 的相互作用导致细胞对6⁃MP的敏感性增加,进而增加患者发生血液毒性风险。
NT5C2(cytosolic 5’⁃nucleotidase Ⅱ)属于5’⁃核苷酸酶(5’⁃nucleotidase,5’⁃NT)家族,可将其天然底物单磷酸肌苷、黄嘌呤以及鸟苷酸脱磷酸化。研究显示,NT5C2可将硫嘌呤类药物代谢产物TIMP、TX⁃MP、TGMP 脱磷酸化,随后转运出细胞,进而减少可用于掺入DNA 的TGN 水平[45]。在ALL 淋巴母细胞中表达NT5C2突变蛋白后,细胞核苷酸酶活性增强且对6⁃MP 及6⁃TG 的化疗方案表现出耐药性[46]。Tulstrup 等[47]研究发现NT5C2 rs72846714⁃A 等位基因携带者细胞内TGN 浓度降低并且与ALL 早期复发相关。
S⁃腺苷甲硫氨酸(S⁃adenosyl methionine,SAM)的缺乏可通过导致TPMT 的错误折叠影响TPMT 功能[48],而叶酸途径对SAM 的合成至关重要。因此,有研究显示叶酸途径的遗传变异(DHFR,TYMS)与TPMT 之间的协同相互作用可能进一步增加6⁃MP介导的不良反应[49]。我国学者的研究还发现,在ALL 患者群体中,亚甲基四氢叶酸还原酶(methy⁃lenetetrahydrofolate reductase,MTHFR,rs1801133)基因变异患者的肝毒性风险是野生型患者的4.46倍[50]。
IMPDH1是将6⁃MP在TPMT甲基化后转变为6⁃TGNs 的关键酶。韩国学者研究51发现,IMPDH1 rs2278293 CT 基因型携带者比CC 型患者白细胞减少症风险显著增加,TT 型患者风险最低;此研究也证实转运蛋白SLC19A1、SLC29A1、SLCO1B1等的基因多态性与巯嘌呤所致白细胞减少症的高风险显著相关。
除骨髓抑制及肝毒性外,AZA及6⁃MP也会导致胰腺炎的发生,人群总体风险约为4%。Taha 等[52]研究发现HLA⁃DQA1⁃HLA⁃DRB 基因多态性与AZA导致的胰腺炎发生风险相关,在治疗开始前进行基因分型检测可以显著降低因主要不良反应而停止免疫抑制治疗的比率。
3 硫嘌呤类药物的治疗药物检测
在过去的20年间,硫嘌呤类药物的药效学和遗传药理学得到较大发展,除基因型⁃表型的相关研究在临床广泛应用外,长期临床实践证实巯嘌呤代谢物6⁃TGNs 及6⁃MMPR 水平是药物安全有效使用的关键,但代谢物浓度与临床疗效及不良反应的相关性在各研究中不尽相同。
在ALL患者群体中,早在80年代的研究中已经意识到红细胞内6⁃TGNs 的浓度与粒细胞减少及可耐受的巯嘌呤剂量具有相关性,但至今尚未有明确的有效浓度范围。后来的研究认为6⁃TGNs(骨髓抑制)与6⁃MMPR(肝毒性)浓度之间的平衡对于ALL的有效治疗有重要影响[53]。例如TPMT等位基因杂合子携带者的6⁃TGNs浓度虽然高于野生型,但也只有30%~60%的杂合子患者不能耐受标准剂量硫嘌呤类药物,因为部分杂合子患者甲基化的代谢产物6⁃MMPR水平较低,肝毒性风险低,可以耐受较高的6⁃TGNs水平[22]。研究显示,甲基化产物6⁃MMPR浓度超过5 000 pmol/8×108RBC(红细胞)时肝毒性风险增加[54]。近年来的研究发现,ALL患者维持治疗期间DNA⁃TG水平的增加以及较高DNA⁃TG浓度与较低复发频率之间的显著相关[23]。因此,DNA⁃TG浓度的测定可以作为未来个体化给药剂量选择的指导依据[55]。
对于IBD 患者而言,早期研究显示高加索人群中6⁃TGNs 的可接受临界治疗浓度为230~450 pmol/8×108RBC[56]。随后的研究发现,年龄和种族差异会导致产生临床益处所需的6⁃TGNs 临界浓度不同。一项包含15 个研究的Meta 分析证实,6⁃TGNs 浓度与儿童IBD 患者的临床结局存在正相关性,但无法确定具体的临界浓度[57]。Mao等[58]的回顾性研究显示较低的6⁃TGNs浓度为180~355 pmol/8×108RBC即足以使中国成年IBD 患者保持缓解,说明亚洲人对巯嘌呤更加敏感。此外,硫嘌呤类药物与抗肿瘤坏死因子(anti⁃tumor necrosis factor,TNF)药物(如英夫利昔单抗,阿达木单抗等)的结合已成为治疗IBD的常规疗法[59],有效的6⁃TGNs水平也会因同时进行的药物治疗而改变。有研究表明[60],使用巯嘌呤和英夫利昔单抗联合治疗的患者,6⁃TGNs 水平达到125 pmol/8×108RBC 临界值的患者黏膜愈合率更高,且产生抗英夫利昔单抗的可能性更低。
作为激素的节约剂,硫嘌呤类药物可以用于诱导和维持自身免疫性肝炎(AIH)的缓解。Hapreet等[61]研究发现,6⁃TGNs 浓度高于220 pmol/8×108RBC 时,AIH 患者的缓解率较高,OR 值为7.7。同时,AZA 导致胆汁淤积的患者红细胞内6⁃MMPR 浓度高于非胆汁淤积患者(14277vs.1416 pmol/8×108RBC),说明AZA导致的胆汁淤积与升高的6⁃MMPR水平相关。另外一项研究发现6⁃MMP/6⁃TGNs浓度比小于4的患者有更高的缓解率[62]。
总体而言,在不同疾病治疗中,硫嘌呤药物活性代谢物的有效浓度范围尚无统一标准;另一方面,与常规的基于体重的剂量给药方案相比,亦缺乏明确的证据表明基于硫嘌呤代谢产物的常规监测有益于指导的巯嘌呤的剂量选择[63]。因此,目前的各种指南并没有推荐常规监测巯嘌呤代谢物的建议。但是,由于硫嘌呤类药物及其代谢物具有非线性药代动力学过程,对于那些6⁃TGNs浓度较低的患者,在TDM指导下增加药物剂量是有意义的。同时,基于以往的研究,对于TPMT 高活性的个体,增加巯嘌呤剂量时甲基化产物6⁃MMPR增加的比例可能高于6⁃TGNs,肝毒性风险增加,此类患者活性代谢产物的监测意义重大。此外,活性代谢物监测在依从性差、剂量不足或者鉴定代谢异常的患者中亦发挥重要作用[64]。
4 结论与展望
硫嘌呤类药物在IBD、ALL、AIH 等疾病的治疗中占有重要地位,但此类药物导致的骨髓抑制及肝损伤等不良反应限制了临床应用,需要根据个体情况进行精准用药。药物相关基因多态性及TDM 技术在硫嘌呤类药物的精准用药过程中发挥重要作用,但仍有些问题亟需解决。
对于遗传药理学而言,虽然TPMT 和NUDT15基因变异对硫嘌呤药物体内处置过程的影响已被广泛证实,但仅以二者的基因多态性并不能完全解释硫嘌呤类药物较大的个体内及个体间变异,其他基因位点的变异也发挥一定作用。因此,综合考虑包括Mrp4、ITPA、NUDT15和TPMT多个基因在内的“MINT”测序方案,结合患者疾病类型及临床特征,将为硫嘌呤类药物的精准用药提供更加准确的信息。
在TDM方面,6⁃TGNs及6⁃MMPR等活性代谢产物在各类型疾病中尚缺乏明确治疗窗,对临床指导意义有待进一步探讨;同时,大部分研究以红细胞内的代谢物水平评价药物治疗效果,并不能代表淋巴细胞内的药物水平,可能是导致各研究结论不一的原因。与此同时,近年来研究发现细胞内DNA⁃TG的水平可能与硫嘌呤类药物的临床疗效和不良反应更加相关,是未来该类药物TDM监测的发展方向。
综上,包含多基因位点在内的“MINT”测序策略结合DNA⁃TG 活性代谢物水平的治疗药物监测,将对硫嘌呤类药物精准用药提供高级别的循证支持,更好地服务于临床。
