Bazedoxifene治疗SLE小鼠的疗效及对CD4+T细胞亚群的影响
2021-10-19张莹代春燕田吉来
张莹,代春燕,田吉来
(1.南京中医药大学中西医结合鼓楼临床医学院风湿免疫科,江苏 南京 210008;2.夏津县人民医院血液透析科,山东 德州 253200;3.南京中医药大学医学院,整合医学学院生物化学与分子生物学系,江苏 南京 210023)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种主要累及女性尤其是育龄期女性的自身免疫性疾病,以自身抗体产生、免疫复合物沉积和慢性炎症引发细胞因子激活和组织损伤为特征。白细胞介素-6(IL-6)是调节免疫和炎症的重要细胞因子,调控辅助T细胞(Th)1/Th2、Th17/Treg平衡,参与滤泡辅助T细胞(Tfh)辅助B细胞活化成熟[1];IL-6和IL-6受体表达异常,与SLE疾病活动相关,是治疗SLE的潜在靶点[2-4]。同时,雌激素-雌激素受体(ER)-α和ER-β在诱发和加重SLE方面发挥一定的作用。雌激素通过ER-α参与T细胞和B细胞活化、炎症和自身抗体产生[5]。
巴多昔芬(bazedoxifene,BAZ,结构式见图1)是一种新型的第三代选择性雌激素受体调节剂(SERMs),在不同的靶组织表现出雌激素的激动或拮抗作用。例如,BAZ能促进ER-α在子宫和乳房部位的降解,发挥抗雌激素作用;同时对骨骼系统的ER-β起到活化作用,从而增加脊椎与髋部的骨密度[6]。2013年BAZ被美国食品药品监督管理局(FDA)批准用于绝经后骨质疏松症的预防和治疗。2014年,Li等[7]利用计算机多配体同时对接技术发现BAZ的吲哚部分和七元氮杂环拟似IL-6的Trp157和Leu57基团,从而可与其受体gp130 D1区域进行有效结合,发挥拮抗IL-6的作用。在随后的细胞与动物实验中证实BAZ可通过抑制IL-6/gp130实现治疗胰腺癌[8]、横纹肌肉瘤[9]、结肠癌[10]、三阴性乳腺癌[11]的目的。

图1 巴多昔芬的化学结构式
BAZ作用于ERs和gp130,具有治疗SLE的可能性,本文拟利用MRL/lpr狼疮小鼠,评估BAZ对SLE小鼠的治疗作用及对脾脏CD4+T细胞亚群的影响。
1 材料与方法
1.1 实验动物 MRL/lpr小鼠(雌性,18周)购自中国上海SLAC实验室动物有限公司,并在南京鼓楼医院实验动物中心的无特定病原体(specific-pathogen-free,SPF)条件下饲养。所有动物实验均在南京鼓楼医院动物研究伦理委员会批准的规程下进行。醋酸巴多昔芬购于江苏正济药业股份有限公司。泊洛沙姆188(Kolliphor P188)购于巴斯夫(中国)有限公司。
1.2 药物配制 称取醋酸巴多昔芬和泊洛沙姆188分别为4 mg和3 mg,溶解在1 mL去离子水中,4 ℃下储存备用。
1.3 给药与动物实验 实验组给予18周龄MRL/lpr小鼠(n=6)醋酸巴多昔酚20 mg·(kg·d)-1灌胃,对照组给予等浓度的泊洛沙姆188灌胃,均连续给药4周。末次给药后代谢笼收集小鼠24 h尿液,考马斯亮蓝法检测尿蛋白含量。小鼠摘眼球取血,分离血浆,用鼠抗dsDNA ELISA试剂盒(Shibayagi,日本)对血浆中dsDNA抗体水平进行测定。麻醉处死小鼠,75%乙醇消毒腹部皮肤,切开腹腔,取出脾脏和肾脏,称取湿重并记录。根据下列公式计算小鼠脾脏指数。
脾脏指数=脾脏湿重(g)/小鼠体重(g)
1.4 分离小鼠脾脏淋巴细胞 脾脏称重后充分研磨,然后于200目筛网过滤制成单细胞悬浮液,1 300 r·min-1离心5 min,弃上清,加入10倍体积的红细胞裂解液,室温裂解3 min,再用PBS充分洗涤次后重悬计数,将脾细胞以5×106mL-1的密度悬浮在含100 U·mL-1青霉素、100 μg·mL-1链霉素,2 mmol·L-1谷氨酰胺和10%胎牛血清(GIBCO)RPMI 1640完全培养基中。
1.5 流式细胞检测脾脏CD4+T细胞亚群 为了鉴定Treg,取1×106个脾细胞加入FITC-anti-CD4室温避光孵育15 min,对照管加入同型对照,PBS洗涤两次后加入固定破膜剂200 μL,然后在4 ℃破膜1 h后,PBS洗一遍,加入anti-Foxp3-PE 4 ℃孵育30 min,PBS洗涤两次后上机检测,每个样本收集10 000个阳性细胞。对于Th1/Th2/Th17细胞亚群分析,取2×106个细胞种植于96孔板/孔,50 ng·mL-1phorbol 12-myristate 13-acetate(PMA)、1 μg·mL-1离子霉素和5 μg·mL-1布雷非德菌素A(BFA)刺激4 h。然后,FITC-anti-CD4室温避光孵育15 min;对照管加入同型对照,操作步骤同检测管,PBS洗涤两次后加入固定破膜剂200 μL,然后在4 ℃破膜1 h后,PBS洗一遍,加入APC-anti-IFN-γ(Th1),PE-anti-IL4和(Th2)以及APC-anti-IL17A(Th17)4 ℃孵育30 min进行标记, PBS洗涤两次后上机检测,每个样本收集10 000个阳性细胞。所有抗体、流式试剂均购eBioscience(San Diego,CA,USA)。通过流式细胞仪(Calibur,BD Biosciences,CA,USA)获取数据,并使用FlowJo软件(Tree Star,USA)进行分析。
1.6 肾脏的病理评估 处死小鼠后,切开腹腔,去除包膜,取出肾脏,沿冠状切面平均分开,浸泡于冰PBS。4%低聚甲醛固定12 h以上,脱水,然后石蜡包埋,切成4 μm薄片。每只小鼠选取2张切片进行苏木精和曙红(H&E)染色。每张切片随机选取3个200倍视野,按照Chan报道的评分方案[12],对每个隔室(肾小球、间质)使用 0-4+量表,将病理分级为不存在、轻度、中度或重度的半定量方法对肾炎和血管炎的严重程度进行分级和损伤指数评分。

2 结果
2.1 BAZ有效缓解MRL/lpr小鼠狼疮表型 与辅料对照组(vehicle,VEH)相比,BAZ治疗组并没有显著降低小鼠的体重(P=0.1243,见图2A),但MRL/lpr小鼠脾脏指数显著降低(脾重/体重,g·g-1)(P<0.05,见图2B)。抗双链 DNA(dsDNA)抗体是SLE的致病性抗体,但BAZ治疗组抗dsDNA抗体的含量与对照组无显著差别(P>0.05,见图2C)。肾脏是SLE最易累及的重要脏器,肾脏损伤后临床出现蛋白尿。与对照组相比,BAZ治疗显著降低SLE小鼠蛋白尿(P<0.01,见图2D)。

A.MRL/lpr小鼠的体重;B.MRL/lpr小鼠脾脏指数;C.血清抗dsDNA抗体含量; D.24 h尿蛋白图2 BAZ 显著缓解MRL/lpr小鼠的狼疮表型注:BAZ n=6,VEH(辅料组) n=6,*P<0.05,**P<0.01
2.2 BAZ减轻MRL/lpr小鼠肾脏损伤 我们进一步分析BAZ治疗对狼疮小鼠肾脏损伤的影响。肾脏病理发现,对照组肾小球系膜细胞、内皮细胞、系膜基质出现弥漫性增生,肾间质可见弥漫性炎症细胞的浸润,基本符合狼疮肾炎的病理表现。而BAZ治疗可显著减低肾小球增殖(P<0.05,见图3A、B),减轻肾小管间质炎症细胞浸润(P<0.05,见图3A、C)。
2.3 BAZ调节MRL/lpr小鼠Th2/Treg平衡 CD4+T细胞亚群在SLE发病中发挥重要作用,Th1和Th17分泌炎症因子,参与SLE重要脏器炎症,Th2辅助浆细胞分化成熟参与自身抗体产生。本研究进一步探讨BAZ治疗对狼疮小鼠脾脏CD4+T细胞亚群的影响。结果如图4所示,BAZ显著降低SLE小鼠脾脏Th2细胞比例(见图4 C、D),提高Treg比例(见图4 G、H),对Th1和Th17亚群没有显著影响(见图4A、B、E、F)。
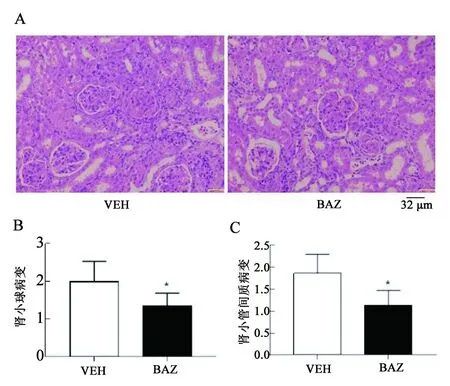
A.BAZ治疗组和对照组狼疮小鼠肾小球增生病变和肾小管间质炎症细胞浸润;B.肾小球病理损伤指数;C.肾小管间质损伤指数图3 BAZ减轻MRL/lpr小鼠肾脏损伤 注:*P<0.05,BAZ n=6,VEH n=6
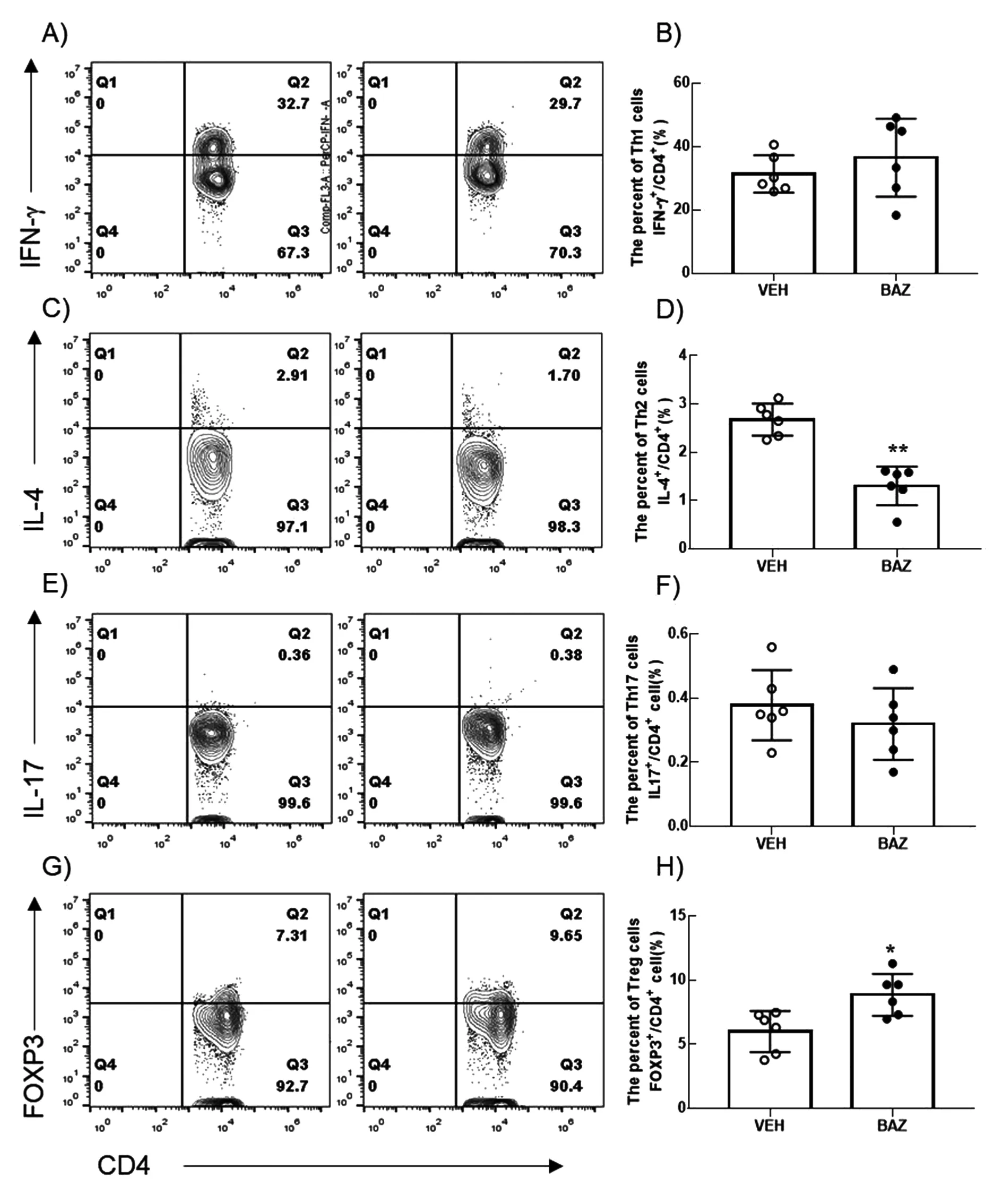
A.Th1细胞;B.Th1占CD4+T细胞比例;C.Th2细胞;D.Th2占CD4+T细胞比例;E.Th17细胞;F.Th17占CD4+T细胞比例;G.Treg细胞;H.Treg占CD4+T细胞比例图4 流式细胞术分析BAZ治疗组(图A、C、E、G右列)和对照组(图A、C、E、G左列)小鼠脾脏CD4+T细胞亚群 注:BAZ(n=6),VEH(n=6),*P<0.05,**P<0.01
3 讨论
本研究发现,BAZ治疗组MRL/lpr小鼠脾重指数显著减小,有效减弱因Fas基因突变致淋巴细胞增生而出现的脾脏代偿性肥大,说明BAZ具有改善小鼠淋巴细胞功能紊乱,调整免疫功能的潜能。BAZ治疗后,小鼠蛋白尿显著较少,且能显著缓解肾小球增生性病变,减轻肾小管间质炎症细胞浸润,提示BAZ可以降低MRL/lpr小鼠重要脏器的炎症损伤。
BAZ的治疗作用可能与IL-6/gp130信号通路相关。IL-6可通过经典信号(classic-signaling)或转移信号(trans-signaling)分别与膜结合型 IL-6 受体(mIL-6R) 或可溶型IL-6 受体(sIL-6R)结合,均可触发gp130 的二聚化,激活 JAK/STAT 信号通路从而表现出致病作用[12]。有报道SLE小鼠的血清 IL-6 升高及存在 IL-6R 的异常表达[13-15]。在其他小鼠品系中,外源性 IL-6 促进自身抗体的产生,并加速肾小球肾炎的进展[16];阻断 IL-6 或其受体可防止雄性小鼠的抗dsDNA抗体升高,减少蛋白尿并降低死亡率[17]。此外,SLE 患者血清 IL-6 水平升高[2-4,18-19],与疾病活动和抗 dsDNA 水平相关[3,18]。在体外,阻断 IL-6 可抑制免疫球蛋白和抗 dsDNA抗体的产生,提高巨噬细胞通过自噬途径降解[20]。SLE患者阻断 IL-6Rs 会降低体内B细胞和T细胞的活化[21]。评价IL-6单克隆抗体Sirukumab和IL-6R单克隆抗体托株单抗治疗SLE的多中心临床试验正在进行[22]。以上说明抑制IL-6/IL-6R成为治疗SLE的一项有效策略。
IL-6可调节Th1/Th2平衡,通过促进IL-4的自分泌,促进Th2分化[23]。本实验发现BAZ显著降低SLE小鼠脾脏Th2细胞的比例,可能与BAZ抑制了IL-6/gp130有关。IL-6可调节Treg/Th17平衡[24]。目前认为,Th17是自身免疫病发的关键角色,而Treg可抑制异常活化的效应T细胞反应。IL-6联合TGF-β可诱导初始T细胞向Th17分化; 相反,IL-6可抑制TGF-β诱导的Treg分化。本实验发现BAZ显著提高Treg的比例,说明了BAZ拮抗IL-6作用的可能性。尽管有报道IL-6可通过聚类信号模式(cluster-signaling)激活初始T细胞gp130,使之分化为致病性的Th17 细胞[25],本实验没有发现BAZ对脾脏Th17的显著影响。同样,Anderson等报道BAZ治疗胶原诱导小鼠关节炎不影响Th17细胞的比例[26]。
BAZ的治疗作用还不能避免与调节ERs相关。SLE具有显著的性别趋向性,女性多见,尤其是育龄期女性。雌激素作用于ER-α 和ER-β,分别发挥促炎和抗炎的作用。SLE 患者组外周血单核细胞(peripheral blood mononuclear cell,PBMC)中ER-α mRNA 的表达显著高于正常对照组,SLE病情活动组PBMC ER-α mRNA表达水平显著高于病情缓解期组[27]。研究者Inui A 观察到比健康对照相比,SLE疾病活动指数(SLEDAI)-2K评分≥6的SLE患者外周血T细胞ER-β的表达量显著降低;SLE患者PBMC ER-β-mRNA的表达水平与SLEDAI 评分呈负相关[28]。雌激素驱动Th1细胞应答依赖于ER-α介导的信号传导,在ER-α缺陷小鼠淋巴结中分泌IFN-γ的细胞减少[29]。同时ER-α通过与GATA3、Foxp3相互作用,可增加小鼠和人Th2、Treg的分化[30]。BAZ治疗后显著提高SLE小鼠脾脏Treg比例,减小Th2比例,可能和ER-α通路有关。
本研究初步证实BAZ治疗小鼠SLE有效,可减少SLE小鼠脾重、蛋白尿,减轻肾脏损害,调节SLE小鼠脾脏CD4+T细胞亚群。BAZ可能调控IL-6信号通路、ERs信号通路及作用机制有待更深入研究。
