Rho激酶抑制剂Y-27632对肝癌HepG2细胞株增殖的影响及机制探讨
2021-10-19姚汝铖
万 涛 姚汝铖 郑 军
(三峡大学 第一临床医学院[宜昌市中心人民医院] 肝胆脾胰外科 & 三峡大学 肝胆胰外科研究所, 湖北 宜昌 443003)
肝癌是一种高度恶性的消化系统肿瘤,该肿瘤发病率较高,且中晚期肝癌预后普遍较差,而大多数肝癌患者又对传统化疗药物敏感度低[1]。顺铂(cisplatin,CDDP)是一种肝癌临床化疗较为常见的基础药物,但该药副作用大,耐药性也较明显。因此,有关CDDP与其他药物联合应用来降低肝癌患者对化疗药物的抵抗作用、减少CDDP用量以及降低不良反应已经成为目前肝癌研究中的热点。Rho激酶(Rho kinase)是一种丝氨酸或苏氨酸激酶,其主要调控细胞生物功能以及维持心肌细胞存活[2]。近年来有研究者发现该酶也参与了肿瘤细胞的增殖、侵袭和转移,当应用Rho激酶抑制剂Y-27632降低该酶的表达水平后,能够有效阻断Rho信号的传导通路,降低细胞骨架中的蛋白收缩,从而有效抑制肝癌细胞的生长以及迁移[3]。然而Y-27632与常用化疗药物联用是否增强肝癌细胞的化疗敏感性尚未见报道。
本研究拟以肝癌HepG2细胞株为研究对象,分别观察Y-27632、CDDP以及两药联用对HepG2细胞增殖的影响,为Y-27632在肝癌治疗中的应用提供实验依据。
1 材料与方法
1.1 材料与仪器
肝癌HepG2细胞株购买于中国上海生科院;ScienCell 1640细胞培养基、噻唑兰(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulphoxide,DMSO)购自北京裕恒丰科技有限公司;胎牛血清购买于深圳市瑞沃德生命科技有限公司;Y-27632购买于上海恒斐生物科技有限公司;CDDP购买于江苏豪森有限公司;ZF-288全自动化凝胶成像分析系统购买于上海金鹏分析仪器有限公司;SpectraMax iD5多功能微孔板读板机购买于美谷分子仪器(上海)有限公司;BD全系列分析、分选流式细胞仪购买于北京北嘉美仪生物科技有限公司;PI购于北京凯瑞基生物科技有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购于上海锐赛生物技术有限公司;P53、Bcl-2、Bax、β-Actin引物由上海信帆生物科技有限公司合成。
1.2 实验方法
1.2.1 细胞培养
复苏后的肝癌HepG2细胞采用包含10%胎牛血清ScienCell 1640细胞培养液于37℃细胞培养箱中培养,0.25%的胰酶消化并传代,取对数生长期细胞进行该实验。
1.2.2 细胞增殖抑制试验
按照5×103个/孔接种96孔培养板(总体积100 μL)。分组如下:①Y-27632组,按50、25、12.5、6.25、3.125 μmol/L浓度梯度给药;②CDDP组,分别按2、1、0.5、0.25、0.125 μg/mL浓度给药;③联合用药组,取对细胞生长影响最小的Y-27632浓度与CDDP浓度为2、1、0.25、0.5和0.125 μg/mL进行组合。每组均设置3个复孔,同时设置调零孔(只含培养液,不包含细胞)和对照组(含细胞及培养液),当药物单用与联合用药作用24 h后,每孔再加入110 μL无血清培养液及MTT 25 μL,持续培养5 h,去除上清液,每孔加入200 μL的DMSO,摇床振荡使晶体充分溶解。采用酶联免疫检测仪测定波长490 nm处的吸光度值(optical density,OD),每组实验重复3次后取其平均值。细胞增殖抑制率计算公式:增殖抑制率(%)=(1-实验组孔OD/对照组孔OD)×100%。
药物协同效应使用金正均的Q值计算法[4]:Q=E(A+B)/[EA+EB-EA×EB],当计算的Q值>1.15时表明两药具有协同效应;当计算的Q值<0.85时代表两药互为拮抗;当计算的Q值位于0.85~1.15时,则表明两药为叠加作用。本公式中E(A+B)代表的是两药联用对细胞的抑制率,EA及EB则代表的是两种药物单独应用对细胞的抑制率。
1.2.3 流式细胞仪检测细胞凋亡
选取协同作用最强,即Q值最大的一组Y-27632、顺铂进行细胞凋亡率检测。首先制备密度为1×106/mL的悬浮细胞液,然后再接种于6孔板中培养24 h,每组离心后弃上清液,每孔加入195 μL的Annexin V-FITC结合液,重悬细胞后再加入PI 15 μL,混匀后立即检测HepG2细胞的凋亡率。结果分析:早期发生凋亡的HepG2细胞位于右下象限;晚期才凋亡的HepG2细胞则位于右上象限;坏死细胞位于左上象限;正常的活HepG2细胞不被染色则位于左下象限。
1.2.4 Western Blot
提取各实验组蛋白并定量后,取100 μg细胞蛋白样品上样,进行电泳及转膜。5%脱脂牛奶的PBST室温封闭1 h。一抗4℃孵育过夜。PBST反复清洗4次,每次5 min。二抗室温孵育1 h。PBST洗4次,每次5 min。后加入ECL底物进行反应,5 min后暗室显影,内参为β-Actin。
1.2.5 RT-PCR
培养48 h后收集HepG2细胞,采用Trizol法提取样品中的总RNA,测定适量的样品浓度、纯度,并逆转录成cDNA,于-80℃冰箱中妥善保存。取cDNA反应的原液2 μL,焦磷酸二乙酯水39 μL,dNTP 1 μL,10×PCR buffer 5 μL,上下游引物各1 μL(具体引物序列见表1),Taq聚合酶1 μL,总体积为50 μL。PCR的作用条件:94℃预变性4 min,58℃(P53)35 s、55℃(Bax)35 s、60℃(Bcl-2)35 s,总计30个循环,72℃延伸6 min。PCR扩增的产物使用电泳分离,以β-Actin作为内参,使用凝胶成像系统分析后得到目的基因以及β-Actin的灰度值,测得比值为目的基因的相对表达量。

表1 PCR扩增引物序列及退火温度
1.3 统计学方法

2 结果
2.1 MTT法测定肝癌细胞的增殖抑制率
不同浓度的Y-27632(3.125、6.25、12.5、25、50 μmol/L)和CDDP(0.125、0.25、0.5、1、2 μg/mL)作用于肝癌HepG2细胞,均产生较明显的体外抑制作用,其抑制率呈剂量-时间依赖关系(P<0.05)(见图1)。
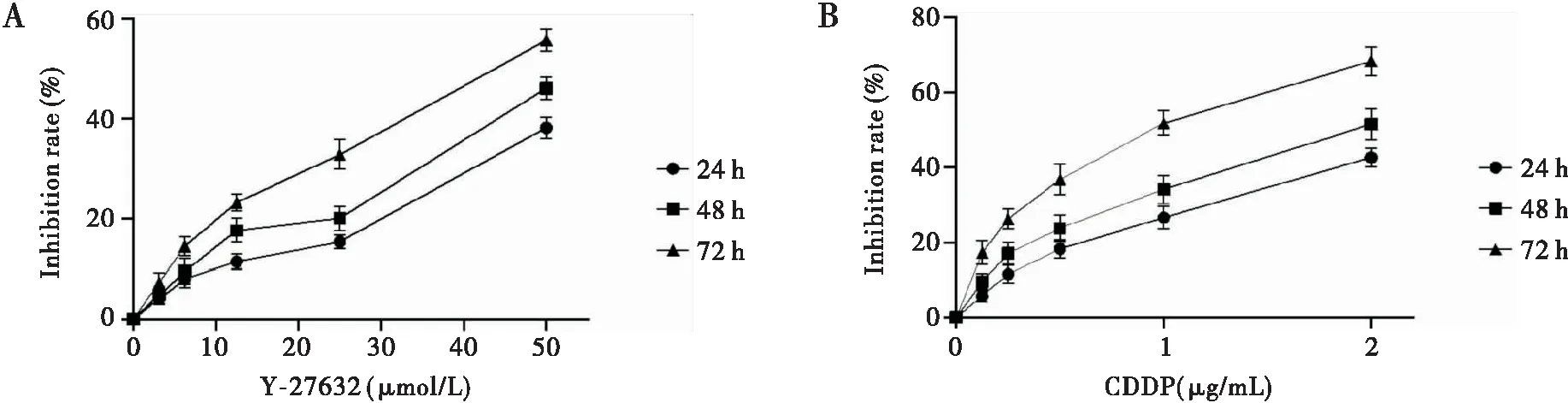
图1 Y-27632和CDDP对HepG2细胞的增殖抑制作用
2.2 Y-27632与CDDP联用对肝癌细胞增殖的影响
选取对肝癌HepG2细胞影响较小的Y-27632药物浓度3.125 μmol/L(抑制率<10%),与CDDP联用,对肝癌细胞的抑制率均明显高于单独用药组(均P<0.05)。并且联合两种药物时,Q值>1.15(见表2)。

表2 Y-27632与CDDP联用对肝癌细胞的抑制率
2.3 Y-27632与CDDP联用对肝癌细胞凋亡的影响
选取Q值最大的联合用药组,即Y-27632和CDDP浓度分别为3.125 μmol/L和0.5 μg/mL,采用流式细胞仪检测细胞凋亡率。单用Y-27632对肝癌HepG2细胞的凋亡影响不明显(1.55±0.44)%,CDDP可明显促进HepG2细胞凋亡(17.3±1.32)%;两药联用时,凋亡更明显(21.25±1.50)%,差异均有统计学意义(均P<0.05)(见图2)。

图2 流式细胞仪检测Y-27632与CDDP联用对HepG2凋亡的影响
2.4 Y-27632与CDDP联用对肝癌细胞Bax、P53、Bcl-2蛋白表达的影响
与对照组相比,Y-27632对Bcl-2的表达影响较小,但是能够明显增加P53和Bax的表达;CDDP能够增加P53和Bax的表达,降低Bcl-2的表达;Y-27632与CDDP联用后,P53和Bax上调、Bcl-2下调的效应更加明显(见图3)。

图3 Y-27632和CDDP联用对P53、Bax及Bcl-2蛋白表达的影响
2.5 Y-27632与CDDP联用对肝癌细胞P53、Bax、Bcl-2 mRNA表达的影响
培养48 h后,各组肝癌HepG2细胞P53、Bax、Bcl-2 mRNA的相对表达量见表3。与对照组相比,其余三组P53和Bax mRNA均上调,Bcl-2 mRNA下调,联合用药组较单独用药组效应更明显(均P<0.05)。

表3 各组肝癌细胞Bax、P53、Bcl-2 mRNA比较
3 讨论
肝癌由于恶性程度高,早期易转移,切除后易复发等因素,导致其死亡人数逐年递增[5]。故抑制肿瘤的生长,防止肿瘤转移,提升患者远期预后成为亟需解决的临床问题。从肝癌治疗方面来看,由过去的手术+传统化疗药物的治疗方法转变成手术+分子靶向药物+传统化疗药物的综合治疗策略[6]。恶性肿瘤的靶向治疗已然成为近年来临床治疗方案中新的突破口。而选择一个精准的分子靶点,成为诸多恶性肿瘤安全而有效治疗的关键。
Rho激酶是近些年来广泛认可的一种与肿瘤关系密切的分子靶点。研究表明,Rho激酶主要通过磷酸化作用于下游靶分子,从而引起细胞周期的改变,并且能够明显促进恶性肿瘤细胞粘附、迁移及浸润[7]。Jeong等[8]发现,Rho激酶在卵巢癌细胞中高表达,当应用Rho激酶抑制剂Y-27632抑制该酶的表达后,肿瘤细胞凋亡率升高的同时卵巢癌细胞的迁移能力也明显下降。本研究使用Y-27632处理肝癌HepG2细胞后发现,HepG2细胞的增殖明显受到抑制,且呈剂量-时间依赖关系。该结果与Takeba等[9]使用Y-27632显著抑制肿瘤细胞增殖、侵袭和转移的结果相吻合。CDDP在临床中常被用于恶性肿瘤的化疗,但该化疗药具有严重的全身毒副作用,并且对于大部分恶性肿瘤不敏感。有文献报道Rho激酶在肝癌中的表达明显高于正常肝组织,当敲低Rho激酶的表达后,肝癌细胞的生长被显著抑制,而凋亡的发生率却明显升高,同时还能增加肝癌对CDDP治疗的敏感性[10,11]。本研究结果显示,当使用Y-27632联合CDDP处理肝癌HepG2细胞后,协同效应Q值均大于1.15,这表明两药联用可产生协同效果。另外,还发现Y-27632单独用药效果并不明显,但两种药物联合处理诱导HepG2细胞凋亡的能力明显增强。这表明Y-27632和CDDP联用可通过促进肿瘤细胞凋亡和抑制其增殖发挥协同抗肝癌的作用。提示Rho激酶靶点抑制剂Y-27632和CDDP联合使用时,能够有效地提高肝癌对化疗药物的敏感性,降低化疗抵抗,提升治疗效果。
细胞凋亡是细胞的程序性死亡,而大多数恶性肿瘤对化疗药物耐药的关键原因是其对凋亡的抵抗,调控凋亡信号通路是提高肿瘤治疗水平的关键。P53和Bcl-2均是调控恶性肿瘤细胞凋亡过程中的关键蛋白。P53主要通过Bax/Bcl-2信号蛋白发挥肿瘤细胞凋亡的调控作用。P53除了促进细胞凋亡,也是细胞周期检查点蛋白,与DNA损伤后修复密切相关。研究表明,Rho激酶抑制剂Y-27632通过促进P53和Bax蛋白的表达,抑制Bcl-2蛋白的表达来诱导乳腺癌MCF-7细胞凋亡,抑制其增殖,从而发挥体内抗乳腺癌作用[12]。Bax、Bcl-2则可通过线粒体上的相关离子通道,与细胞色素C(cytochrome C,Cyt C)相互作用,调控Cyt C从细胞内的释放,从而调控细胞凋亡[13]。有研究发现,在肿瘤细胞中Rho激酶功能的发挥主要通过调控P53、Bax及Bcl-2表达而实现[9,14]。本研究结果显示,Y-27632与CDDP联用可诱导P53、Bax表达含量显著增加,而Bcl-2的表达含量明显降低。
综上所述,Rho激酶抑制剂Y-27632能够安全且高效的抑制肝癌HepG2细胞的增殖,当与CDDP联合用药时,不仅增殖抑制效果更加显著,还能促进凋亡,且具有协同效应,该作用机理与P53上调Bax、下调Bcl-2有关。因此,Rho激酶抑制剂Y-27632能够显著提高肝癌HepG2细胞株对CDDP的化疗敏感性。
