卵黄抗体饲料添加剂在畜牧及水产养殖病害防控中的研究进展
2021-10-18徐永平李纪彬李彩霞李晓宇王丽丽李淑英
■徐永平 徐 乐 李纪彬 李彩霞 李晓宇 王丽丽 李淑英
(1.大连理工大学生物工程学院,辽宁大连 116024;2.教育部动物性食品安全保障技术工程研究中心,辽宁大连 116600;3.大连赛姆生物工程技术有限公司,辽宁大连 116620;4. 内蒙古自治区乌兰浩特市畜牧工作站,内蒙古乌兰浩特 137400)
现代养殖业为提高生产效率常采用集约化高密度养殖模式,这种模式的弊端就是会造成疫病高发以及疾病传播加速。为解决这一问题往往在饲料中添加亚治疗剂量抗生素,虽然在一定程度上能够有效防控疫病并可提高饲料利用率,但长期使用甚至是滥用也造成了肉类产品抗生素残留、养殖废弃物成为环境中抗生素污染重要来源的现状[1-2]。据统计,2013 年我国抗生素总使用量约为16.2万吨,其中52%用于养殖业[3],这种无差别不加节制的使用抗生素,致使耐药菌广泛出现,其抗性基因通过食物链进入人体后,或可引发难愈性细菌感染,使人类重回对多种感染无药可用的黑暗时代[4-5]。
为缓解养殖业因过度使用抗生素而造成的日益严重的细菌耐药性威胁,全球范围内对于限用或禁用饲用抗生素早已形成共识。1986年,瑞典通过立法成为世界上第一个禁抗国家,禁止在畜禽饲料中使用抗生素作为生长促进剂。欧盟自2006 年1 月1 日起全面禁止使用抗生素作为生长促进剂,美国和加拿大也通过发布行业指南要求从2014年逐步停止使用具有重大医学价值的抗生素作为生长促进剂[6]。我国作为养殖大国,也是世界上最大的抗生素生产和消费国,同样面临着因饲用抗生素滥用引发的耐药菌增多和食品安全等诸多问题。为此,农业农村部发布第194号公告,要求自2020 年7 月1 日起,全面停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料,标志着我国“饲料禁抗”时代的到来。如何在此背景下,防控畜牧及水产养殖业依旧存在的感染性疾病,开发绿色、高效的抗生素替代品迫在眉睫。
卵黄抗体(Egg yolk immunoglobulin, IgY)是一类广泛存在于鸟类、爬行类及两栖类动物体内的免疫球蛋白[7],当母体受到外界抗原刺激后,由B淋巴细胞分泌到血液再蓄积到卵黄内,保护发育中的胚胎免受潜在病原微生物的侵袭,对幼体起到天然被动免疫保护作用[8]。基于这一生理特性,现代生物技术将禽类作为“生物反应器”,对其接种特定抗原,从收集到的高免蛋中连续、大量获得特异性卵黄抗体。近年来,因其具有绿色高效、不产生耐药性和获取时无需宰杀动物等优势,将卵黄抗体作为抗生素或其他化学药物替代品,用于防控动物疾病的研究及应用越来越广泛。其中,口服施用可操作性强且不易引起动物应激反应。对此,本文综述了卵黄抗体饲料添加剂在畜牧及水产养殖病害防控中的研究进展,以期为促进我国养殖业绿色发展提供参考。
1 卵黄抗体的基本特点
1.1 卵黄抗体的结构
IgY作为哺乳动物IgG的进化前体[7],相对分子质量约为180 ku,由两条重链(67~70 ku)和两条轻链(22~30 ku)组成。IgY的轻链结构与IgG相似,均由一个恒定区(CL)和一个可变区(VL)组成。二者在重链结构上则差异较大,IgY 的重链结构(VH、Cυ1~Cυ4)较IgG(VH、Cγ1~Cγ3)多出一个恒定区,且Cυ2 与Cυ3 区存在三个重链间二硫键[9-10]。此外,IgY 的Cυ3 与Cυ4区与IgG 的Cγ2 与Cγ3 区相似[11],但Cυ1 与Cυ2 区之间缺少IgG 具有的铰链结构(见图1)。研究推测IgY 的Cυ2区进化为IgG 的铰链区[7,12],正是铰链区的缺失使得IgY 分子Fab 片段摆动性较IgG 下降,刚性上升,导致二者的抗原识别和结合能力不同。上述结构上的差异,也赋予IgY 不激活哺乳动物补体,不与哺乳动物细胞Fc 受体、类风湿因子结合,不与蛋白G 和蛋白A发生特异性偶联,因而避免了在哺乳动物中施用时可能出现的炎症症状[13],以及在免疫检测中存在的假阴性或假阳性反应[14]。
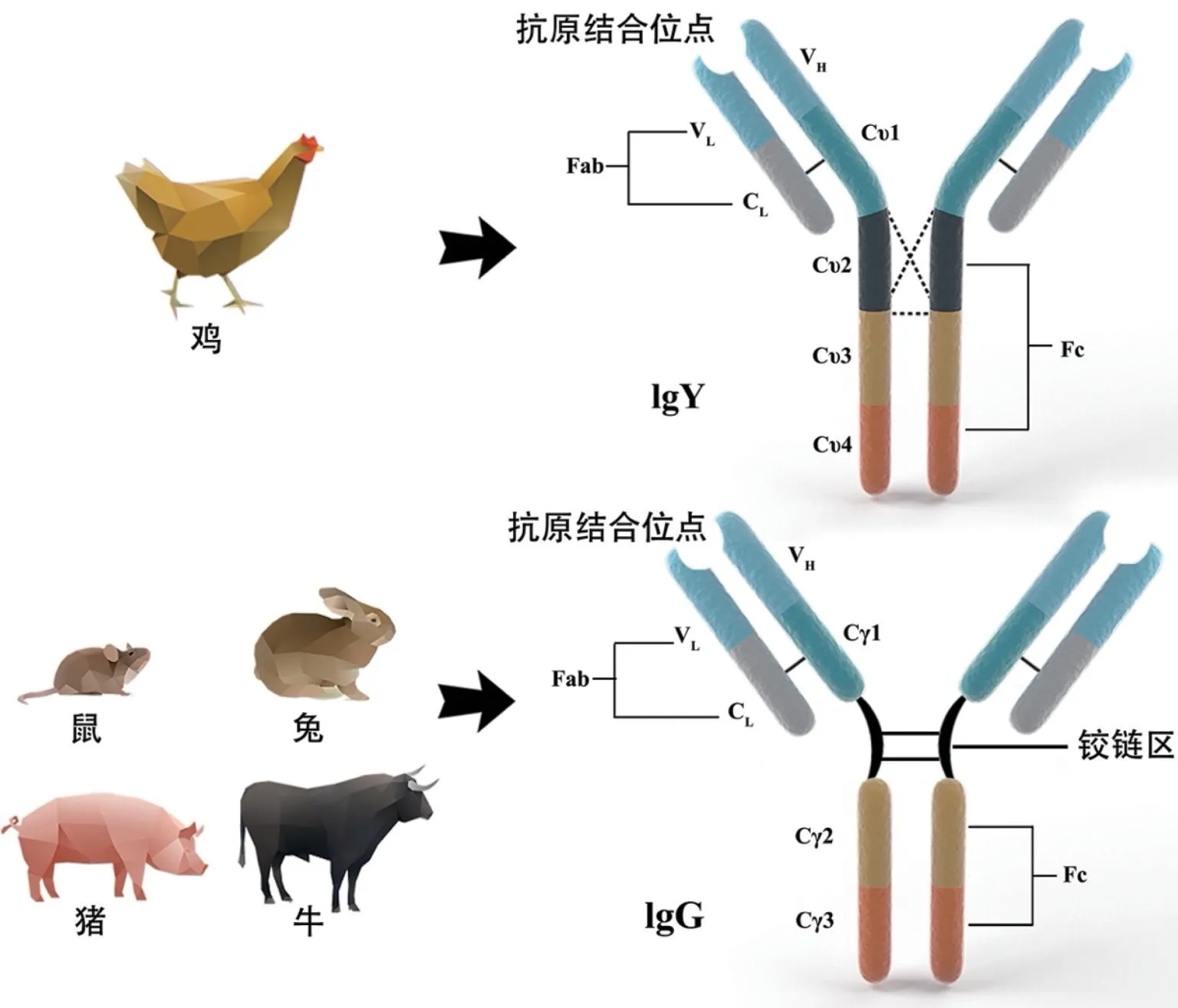
图1 IgY和IgG结构示意图
1.2 卵黄抗体的理化特性
IgY 的耐热、耐酸碱及抗酶解等理化特性直接影响其在制备、贮藏以及免疫防治过程中使用方式的确立。研究表明,在低于70 ℃条件下,IgY 具有较强的热稳定性,高于75 ℃加热15 min,其活性几乎全部丧失[15-16],而添加30%~50%(W/V)的蔗糖或转化糖(in⁃vert sugar)可提高其耐热性能[17]。通过喷雾干燥法规模化生产高免蛋粉时,添加比例为37.5%的甘露醇、山梨醇或微晶纤维素作为保护剂,进口及出口温度最高可提升至100 ℃和80 ℃,也可显著提升IgY热稳定性[18]。此外,在生产含特异性IgY抗体的颗粒饲料时,为避免制粒过程中高温造成IgY失活,可将特异性IgY或高免卵黄液后喷涂至颗粒饲料表面,完成工业化生产。值得注意的是,IgY在-20 ℃或4 ℃条件下可实现长期贮藏[19],抗体活性无显著变化。在37 ℃条件下,抗体活性可在1个月内保持不变,且12个月后活性仍剩余20%[20]。
IgY在pH为4~11的范围内具有相对稳定的抗体活性[15,21],过低或过高的pH均可迅速破坏包含抗原结合位点在内的Fab 片段构象,发生不可逆失活,而添加浓度高于30%的山梨醇可有效提高IgY 的酸稳定性[22]。例如,在pH 为3 时,50%山梨醇可完全抑制酸诱导的IgY 失活。此外,IgY 溶液中添加浓度大于30%的蔗糖、转化糖或浓度大于20%的葡聚糖也观察到相似的酸稳定性[17]。
作为一种7S免疫球蛋白,IgY同样可被蛋白酶水解。其中,对胃蛋白酶的敏感性依赖于pH 和酶与底物的比例。Shimizu 等[23]研究发现,在pH 高于5、IgY与胃蛋白酶比值为1∶20时,抗E.coliIgY可完全耐受胃蛋白酶降解,其抗体结合和菌体凝集活性无损失。Hatta等[24]报道,当pH为4、胃蛋白酶与IgY比值为1∶200 时,经过1 h 和4 h 孵育,抗HRV IgY 分别保留91%和63%的初始活性;而当pH 下降至2,相同胃蛋白酶与IgY 比值,仅孵育1 h 后IgY 活性即完全丧失。Yi 等[25]同样得到类似结果,在pH 为2 时,此时胃蛋白酶可将抗RGNNV IgY彻底降解为无活性的小分子片段,失去与病毒的中和能力;在pH为4~10时,胃蛋白酶对IgY生物活性无显著影响。相较于胃蛋白酶,IgY对胰蛋白酶和胰凝乳蛋白酶具有较强的酶解抗性[24],孵育8 h后抗体活性仍分别保留39%和41%。
结合上述IgY 的酸碱稳定性及酶解抗性,口服免疫面临的首要难题就是解决其通过胃部时可能出现的活性损失。现有研究证实,使用脂质体[26]、pH敏感型甲基丙烯酸共聚物[27]、壳聚糖-海藻酸钠[28]、pH响应型水凝胶[29]及水凝胶-碳纳米管[30]对IgY 进行包被可显著改善这一问题,提升IgY 在胃液中的稳定性。但是,对IgY 进行包被处理也存在着生产工艺变复杂和生产成本上升的现实问题,不利于在养殖业中规模化应用。而采用喷雾干燥法生产高免卵黄粉被认为是IgY最经济的制备方式[18],无需提取及包被处理,卵黄中丰富的脂质使得卵黄粉呈现碱性,可在一定程度上中和胃酸,保护IgY不被降解[31]。但是,成年动物胃部pH普遍较低,且存在高活性的胃蛋白酶,为进一步增强卵黄粉中特异性IgY 在胃部时的稳定性,在卵黄液中添加比例为37.5%的甘露醇进行喷雾干燥,可显著提升IgY抗胃酸及抗胃蛋白酶酶解能力[18]。
1.3 卵黄抗体作用机制
卵黄抗体已成功用于防治细菌、病毒及寄生虫感染,但其抗病原微生物作用机制不尽相同,现有研究显示可能与以下途径有关(见图2)。

图2 IgY抗病原微生物作用机制
1.3.1 破坏微生物表面结构,直接抑制其生长
Lee 等[32]通过透射电镜观察到特异性IgY 与沙门氏菌孵育后,细菌表面结构发生改变。相似现象也出现在大肠杆菌O157∶H7与特异性IgY结合后[33],但是作者并未确定IgY 干扰了何种抗原表位的功能,导致其结构受损、生长受到抑制。根据革兰氏阳性及阴性菌细胞壁的结构特点,隋建新[34]及张茜[35]通过电镜观察并结合核磁、气相质谱分析,分别从分子水平上明确了特异性IgY 的结合位点为单增李斯特菌和腐败希瓦氏菌细胞壁中的磷壁酸及脂多糖,该结合可影响上述两种抗原表位的生物功能,进而破坏细胞壁结构,直接抑制病原菌生长。IgY 防控寄生虫感染的研究中同样发现,特异性IgY 可破坏微小隐孢子虫子孢子表面结构,使其丧失活力[36]。此外,王圆圆[37]通过延长特异性IgY 与钩蚴共培养时间发现,随着虫体表面免疫复合物数量增多,其表膜结构损伤加剧且运动性下降,导致幼虫死亡率显著上升。
1.3.2 黏附阻滞作用
特异性IgY 可识别并结合病原菌表面多种影响其定植的关键组分,例如外膜蛋白、脂多糖、鞭毛和菌毛等[38],阻断其对细胞或组织的黏附及侵袭,从而达到降低发病率的目的。Chalghoumi 等[39]研究显示,31.25、62.5 μg/mL 的抗沙门氏菌外膜蛋白IgY即可有效抑制肠炎沙门氏菌和鼠伤寒沙门氏菌对Caco-2细胞的黏附,且阻滞作用呈现剂量依赖性。Marquardt等[40]、Wang 等[41]均报道了菌毛特异性IgY 可显著抑制大肠杆菌K88黏附到仔猪小肠黏膜,降低其在小肠中的定植量并减少肠毒素表达,从而减轻腹泻症状。Nilsson等[42]首次证实特异性IgY的主要结合位点为铜绿假单胞菌的鞭毛蛋白,这种结合可影响菌体运动性、趋化性并降低其对上皮黏膜的黏附力。此外,应用IgY防控流感病毒的研究中发现[43-44],特异性IgY能够与病毒包膜蛋白——血凝素结合,阻止病毒颗粒识别宿主细胞表面唾液酸(N-乙酰神经氨酸)受体,抑制病毒附着,使其丧失感染活性。
1.3.3 吞噬调理作用
由于IgY不与哺乳动物细胞Fc受体结合,因此其增强吞噬作用无法通过受体介导实现,需借助其他机制完成。本课题组甄宇红[45]研究发现,特异性IgY 能够显著增强牛乳中嗜中性粒细胞和单核巨噬细胞对金黄色葡萄球菌和大肠杆菌的吞噬率。对此,研究者将原因归结为特异性IgY 破坏了菌体表面构象,引起表面电场发生变化,更利于吞噬细胞接近和吞噬[32]。近年来部分研究证实,特异性IgY 可通过凝集作用使铜绿假单胞菌形成较大的吞噬靶标并增强菌体表面疏水性,使其更易于被嗜中性粒细胞黏附捕获,从而加速对病原菌的清除[46-47]。
1.3.4 毒素中合作用
来源于细菌的大分子蛋白毒素往往需借助受体,内化进入宿主细胞发挥毒性作用,特异性IgY 通过阻断毒素与细胞表面受体结合,减少毒素摄入,对细胞起到保护作用。肠出血性大肠杆菌(EHEC)产生的两种志贺毒素(Stx-1、Stx-2)具有典型的A-B亚基结构,其中B 亚基是受体结合区,可介导毒素分子内化,导致出血性结肠炎、中枢神经系统疾病和溶血性尿毒症综合征。Neri 等[48]研究证实,抗Stx-1 IgY 和抗Stx-2 IgY 通过结合B 亚基,阻断毒素与受体Gb3结合,以此中和Stx对HeLa 229细胞的毒性并提高EHEC攻毒后Balb/c 小鼠的存活率。艰难梭菌毒素A是导致艰难梭菌相关性腹泻的主要毒力因子,其C端受体结合区可介导毒素进入肠壁细胞引发细胞死亡。郭桂萍等[49]通过制备针对艰难梭菌毒素A的C端结构域IgY并进行抗体保护实验发现,IgY 可有效中和重组肠毒素A,减轻其造成的兔肠管肿胀及肠液蓄积现象。除防控细菌毒素外,特异性IgY 相较传统马源抗蛇毒血清具有生产成本低、生产周期短、安全性好等优点,将其作为新型蛇毒解毒剂的研究正广泛开展[50]。例如,Liu等[51]研究发现,抗尖吻蝮蛇毒IgY可有效中和蛇毒中主要免疫原(丝氨酸蛋白酶和金属蛋白酶)活性,阻断毒素引起的小鼠血液和肌肉系统紊乱,其对小鼠的半有效保护剂量(ED50)为14.14 mg/kg IgY。
2 应用卵黄抗体防控畜牧及水产动物疾病
2.1 猪病防治中的应用
仔猪由于肠道内尚未建立稳定的微生态系统,加之机体免疫力较弱,极易受到肠道病原微生物的侵害,由此造成的仔猪腹泻已经成为影响养猪业发展的重要疾病。其中,产肠毒素大肠杆菌(EnterotoxigenicEscherichia coli, ETEC)是导致新生和断奶仔猪腹泻的主要病因之一[52],可引起仔猪黄白痢。受腹泻影响的仔猪典型症状有:虚弱脱水、精神沉郁、食欲减少等,腹泻加重后可迅速导致仔猪死亡。Alustiza等[30]利用水凝胶-碳纳米管(hydrogel-carbon nanotubes, HCNT)作为IgY 活性保护剂,探究口服特异性IgY 对感染产肠毒素大肠杆菌(F4+,STb+,LT+)的2日龄新生仔猪的被动免疫效果。研究发现口服H-CNT保护的特异性IgY 后,仔猪在整个实验周期内均未出现腹泻、脱水及发烧症状。未治疗组仔猪在细菌攻毒后第4 d,体温升高,并伴有白细胞及中性粒细胞数量显著增多,肠绒毛尖端出现病变灶,提示出现严重细菌感染。Wang等[41]在21日龄断奶仔猪日粮中添加含量为400 mg/kg的抗大肠杆菌K88菌毛蛋白IgY,并于饲喂第3 d对仔猪攻毒。实验结果显示特异性IgY能够有效阻断大肠杆菌K88在空肠和回肠黏膜上的定植,使得该组仔猪在攻毒早期的肠道炎症因子基因(TNF-α、IL-22、IL-6)表达量显著低于非特异性卵黄粉饲喂组,且攻毒72 h 后腹泻症状全部消失,说明用特异性IgY作为饲料添加剂饲喂仔猪能够抑制大肠杆菌诱导的肠道炎症反应,对仔猪产生有效的被动免疫保护作用。
除产肠毒素大肠杆菌导致的细菌性腹泻外,最常检测出引起仔猪腹泻的病毒类型有猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)、猪传染性胃肠炎病毒(transmissble gastroenteritis virus, TGEV)以及猪轮状病毒(porcine rotavirus, PoRV)[53]。在实际养殖过程中,特别是新生仔猪往往因初乳摄入不足或母源抗体含量过低导致病毒感染,病死率可达100%[54-56]。目前,应用卵黄抗体防控上述三种病毒已见诸多报道。Lee 等[57]制备了抗PEDV 及抗PEDV 刺突蛋白S1两种特异性IgY,分别考察了口服施用对新生仔猪感染PEDV 后的治疗效果。研究发现,在攻毒后的5 d内,两个特异性IgY 组相对于安慰剂组仔猪腹泻症状显著改善,粪便中病毒滴度分别下降42.6%和29.6%。组织切片也显示特异性IgY组仔猪肠道仅呈现轻度病变,而安慰剂组仔猪小肠呈现中度至重度绒毛萎缩及损害。Zou 等[58]用仔猪肠道内分离得到TGEV 毒株HB06 免疫蛋鸡制备特异性IgY 并探究口服IgY对仔猪抵抗TGEV感染的预防作用。实验结果显示3日龄新生仔猪口服抗TGEV卵黄抗体后再人工感染TGEV,存活率达87.5%,而对照组仅为42.9%。随后,研究者在两个暴发TGEV的猪场进行的治疗试验同样证实了仔猪口服卵黄抗体对抗TGEV 感染的有效性,特异性IgY 组相比对照组死亡率显著下降45.6%。此外,考虑到生猪养殖中时常发生PEDV、TGEV 以及PoRV 混合感染,制备针对单一病毒的特异性卵黄抗体防控仔猪腹泻效果可能不佳。对此,崔焕忠等[59]考察了新生仔猪口服抗PEDV 及TGEV 二联卵黄抗体对人工感染PEDV 及TGEV 后的治疗效果。结果显示,仔猪口服特异IgY 5 d 后治愈率达100%,而未治疗组仔猪全部死亡。同时,临床应用研究显示,55 例PEDV 和TGEV 检测阳性的腹泻仔猪口服IgY治疗后,痊愈率为88%,且病猪越早期使用效果越好。秦文[60]通过制备的抗猪PEDV、TGEV、PoRV三联高免卵黄抗体,治疗三家不同猪场暴发的以PEDV感染为主的仔猪腹泻,治愈率分别为100%、100%和90.48%。此外,预防实验结果显示,仔猪灌服高免卵黄液后猪流行性腹泻发病率和死亡率较对照组仔猪分别下降30.81%和18.0%。
本课题组前期融合重组抗原与壳聚糖-海藻酸钠包被技术,联合相关企业成功转化出特异性卵黄抗体咀嚼片,可实现对仔猪细菌及病毒性腹泻的有效控制。
2.2 牛病防治中的应用
牛轮状病毒(Bovine Rotavirus, BRV)属呼肠弧病毒科、轮状病毒属,于1963年首次发现。
据统计,约有50%初生犊牛腹泻与该病毒感染有关,具有流行广、发病率高及死亡率高的特点,已对世界范围内养牛业造成重大危害[61]。Vega 等[62]对出生36 h 的新生犊牛人工感染剂量为105.85FFU(Focus Forming Units)的A群牛轮状病毒(RVA),在腹泻发生后,组1 犊牛连续7 d 饲喂富含抗RVA 特异性卵黄粉的牛乳,组2 犊牛饲喂普通牛乳。结果显示,特异性卵黄粉可显著减少犊牛腹泻持续时间、发热天数以及粪便中RVA 检出时间,分别由7.6、12、11.6 d 下降至3.2、2.5 d以及4.5 d。同时,饲喂特异性卵黄粉可进一步激活肠道固有层抗体分泌细胞(ASC),上调IgA 和IgG2的分泌量,增强犊牛肠道免疫力。由于实验所用特异性蛋黄粉为喷雾干燥获得,易于制备,并可在室温下储存12~16个月保持活性不变,其可作为一种潜在的商品化绿色添加剂用于防控犊牛轮状病毒感染。杨春涛等[63]探究了基础饲粮中日添加45 mg/kg BW复合特异性IgY(细菌性抗原:F4、F5、F6、F18、F41+SLTIIv+Sta-LTb;病毒性抗原:TGEV+PEDV+RV)对18 日龄犊牛生长、腹泻率及机体免疫力的影响,研究发现复合特异性IgY 对犊牛平均日增重及料重比无显著影响,但犊牛腹泻率显著下降10%,且血清中免疫球蛋白浓度及抗氧化能力显著提高,对犊牛的健康状况显示出积极影响。
2.3 水产动物疾病防治中的应用
我国作为渔业大国,2019 年水产品养殖产量达5 079.07万吨,养殖及苗种产值过万亿[64]。然而,集约化养殖带来的病害问题同样制约我国水产养殖业健康发展,每年造成的经济损失达100~200 亿元[65]。与哺乳动物相比,水生生物多属于无脊椎或低等脊椎动物,缺乏特异性免疫系统或特异性免疫系统发育不完善,无法产生特异性抗体或产生周期较长,因而不能及时清除侵入机体的病原微生物。饲喂禽源卵黄抗体作为一种人工被动免疫方式,可使水生生物快速获得抗感染能力,有效避免水体中病原微生物的快速传播而造成的巨大养殖损失。卵黄抗体饲料添加剂用于替代抗生素及化学药物防控水产动物疾病的部分研究进展(见表1)。
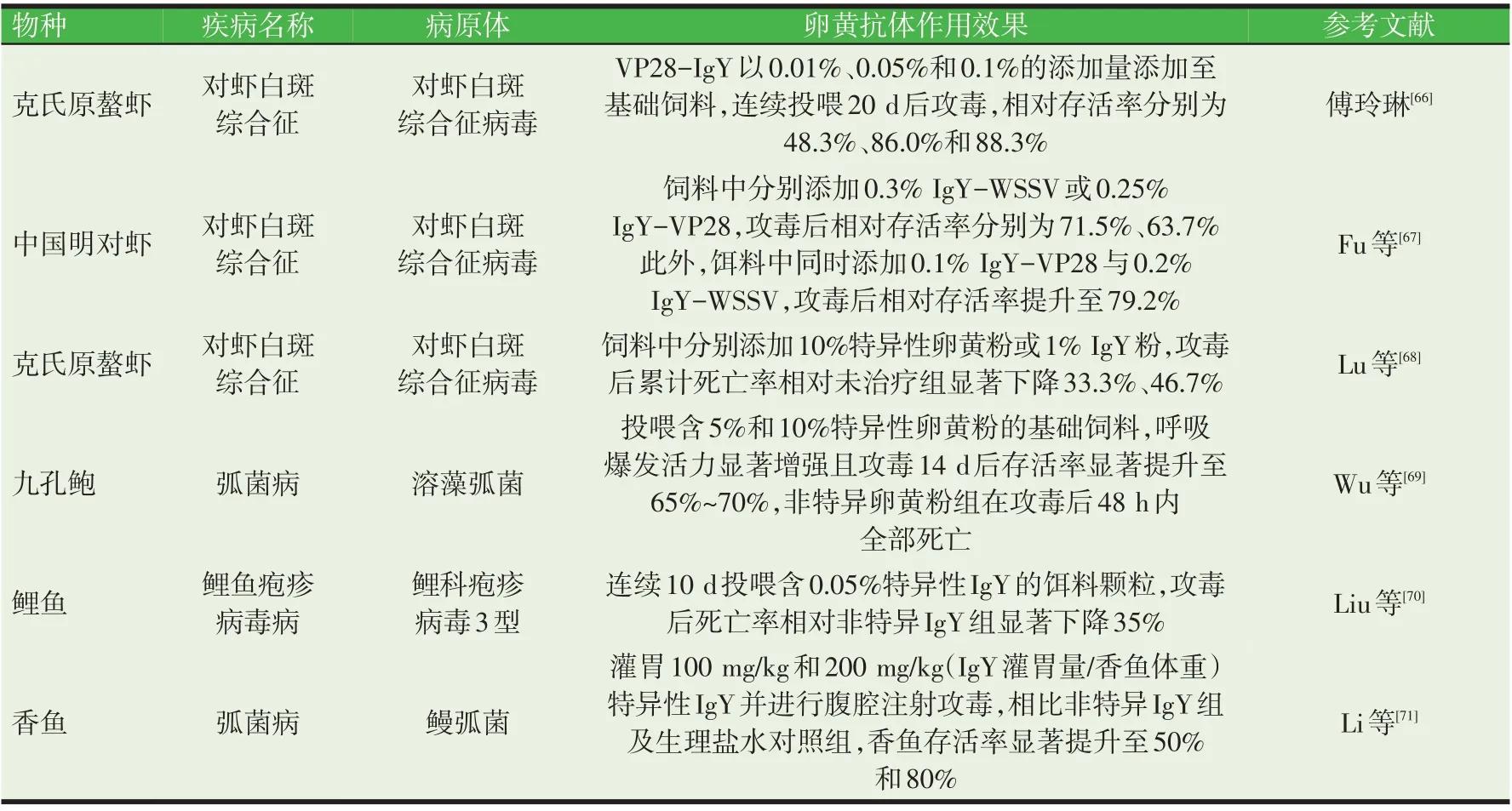
表1 卵黄抗体饲料添加剂用于替代抗生素及化学药物防控水产动物疾病(部分)

表1(续) 卵黄抗体饲料添加剂用于替代抗生素及化学药物防控水产动物疾病(部分)
副溶血弧菌导致的凡纳滨对虾急性肝胰腺坏死综合征(AHPNS),已成为对虾养殖受损原因。患病对虾典型症状为肝胰腺发生明显萎缩,且呈现苍白色或糜烂发红。闫茂仓等[79]将抗高致病性副溶血弧菌特异性卵黄粉作为饵料投喂,探究其对凡纳滨对虾幼体的被动免疫效果及育苗成活率的影响。研究发现,连续投喂特异性IgY至仔虾P4期,此时人工感染高致病性副溶血弧菌,0.1、0.2 g/m3特异性IgY组仔虾存活率分别为53.9%和69.3%,而空白对照仅为28.3%。此外,试验结束时特异性IgY 组育苗成活率分别达到50.8%和57.2%,相比对照组显著提升19.1%和25.6%,为对虾育苗抗病提供了新的思路。此外,部分副溶血弧菌质粒中携带有发光杆菌同源的昆虫相关毒素基因(pirA、pirB),其编码的PirA和PirB毒素是引起AHPNS 的关键。Nakamura 等[80]在对虾基础饲料中以20%的比例分别添加抗重组PirA 和PirB 毒素特异性卵黄粉,连续饲喂3 d后浸浴攻毒发现,PirA组对虾死亡率为14%,而PirB组和基础饲料组对虾死亡率达86%和100%。随后,作者针对抗PirA 毒素特异性卵黄粉显示出的良好被动免疫效果,提高PirA毒素免疫蛋鸡的接种量以此制备高效价卵黄粉,并将饲料中特异性卵黄粉添加量减半。攻毒实验显示,对虾死亡率相较对照组显著降低75%,进一步证实了饲料中添加抗PirA毒素特异性卵黄粉是预防对虾感染AHPNS的有效方法。
本课题组前期多项研究表明,特异性IgY 可通过破坏细菌表面构象,直接产生抑菌作用。其次,抗体介导的菌体凝集现象可显著提升吞噬细胞吞噬率,加速病原菌清除。饲喂实验显示,基础饲料中分别添加10%、5%及10%抗黄海希瓦氏菌AP629、迟缓爱德华氏菌及哈维弧菌特异性卵黄粉,可对刺参、大菱鲆及红鳍东方鲀产生积极的被动免疫保护作用,相应病原体攻毒后,累计存活率相对阳性对照组显著提升30%、63.3%及50%,可有效预防刺参腐皮综合征、大菱鲆爱德华氏菌病及红鳍东方鲀哈维弧菌病[77,81-82]。
3 存在问题及展望
近年来,应用卵黄抗体替代抗生素等化学药物防控畜牧及水产动物疾病的研究均取得成功。然而,进一步推动卵黄抗体饲料添加剂在养殖业中的应用还需重点解决以下问题。
3.1 制备多联多价卵黄抗体
当前动物发病多为细菌和病毒混合感染,或者是细菌引发的病毒继发感染,混合感染是动物疫病流行的一个重要特点。此外,不同血清型病原体同时流行会为疫病防控带来更大难度。因此,针对单一病原体的卵黄抗体作用效果往往不佳,这就需要研发多联多价卵黄抗体,降低治疗成本及周期。但是,多种免疫原免疫蛋鸡是否会产生交叉反应,抗体效价是否变低,免疫程序是否需要变更等问题都需深入研究与探讨。
3.2 筛选及应用新型佐剂提升卵黄抗体效价及产量
如何增强抗体效价及产量是卵黄抗体工业化生产中面临的关键问题,而免疫佐剂的选取可直接影响上述两种免疫指标。长期以来,弗氏佐剂是被用作蛋鸡免疫的标准佐剂,能够对体液和细胞免疫产生有效的免疫激活作用。随着现代生物技术的发展,例如免疫刺激性寡聚脱氧核苷酸(CpG-ODN)佐剂、脂质体佐剂、纳米化铝佐剂、纳微颗粒佐剂等在禽用疫苗制备中已取得诸多进展。本课题组前期自行设计不同序列的CpG-ODN 佐剂,并制备出ETEC K88 全菌疫苗免疫蛋鸡[83]。其中,CpG-ODN S2 佐剂在整个实验周期中对蛋鸡细胞及体液免疫水平的激活作用,在强度和持久度上均显著优于弗氏佐剂,对脾脏淋巴细胞刺激指数可高达3.64。今后在规模化制备卵黄抗体过程中,可考虑针对不同抗原匹配最优佐剂,减少抗原用量、免疫次数、提高免疫功效及免疫持久度,以此降低卵黄抗体生产成本。
3.3 加快制定卵黄抗体饲料添加剂标准化生产规程及质量标准
当前,受限于高纯度卵黄抗体提取工艺的成本限制,已上市的卵黄抗体饲料添加剂主要以全蛋粉和卵黄粉为主。但是,行业内尚未制定标准化生产规程及质量标准,如免疫蛋鸡品系、日龄和饲养方式的选择,免疫途径、间隔等免疫程序的制定,高免蛋粉或蛋黄粉中特异性卵黄抗体含量和效价的要求。今后,只有联合相关科研院校与龙头企业,解决生产工艺难题,完善生产和质量标准,才能进一步推动卵黄抗体饲料添加剂在无抗养殖中的应用,促进我国养殖业健康、可持续发展。
