构建认知模型 突破结构难点
2021-10-17杨伟勇
杨伟勇


[摘 要]基于认知模型的构建,帮助学生认识杂化轨道的类型及杂化轨道延伸的知识点(空间结构)、化学键的类型(σ键和π键)等,使抽象的问题变得更具体、更有条理,帮助学生掌握重点、突破难点。
[关键词]认知模型;空间构型;杂化轨道理论
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2021)29-0060-03
杂化轨道理论是化学选修3《物质结构与性质》的重难点内容,是化学学科核心素养“宏观辨识与微观探析”“证据推理与模型认知”的具体呈现。杂化轨道理论本身是很精深的理论,高中化学教学要求学生了解杂化轨道理论,能从微观的角度理解中心原子的杂化轨道类型(sp、sp2、sp3);能用价层电子对互斥理论或杂化轨道理论推测简单分子或离子的空间构型、理论模型(VSEPR构型)以及分子的性质(如键角、分子的稳定性等),这些内容对学生来说很抽象,难以理解。《普通高中化学课程标准》明确要求:教师应该能运用多种认知模型来描述和解释物质的结构、性质和变化,建立解决复杂化学问题的思维框架。可见,教师需要帮助学生建立杂化轨道和分子空间构型关联的思维模型,从而化解学生学习过程中遇到的疑难问题,使学习更有成效。
一、构建模型,厘清类型
1.知识储备
(1)理论要點
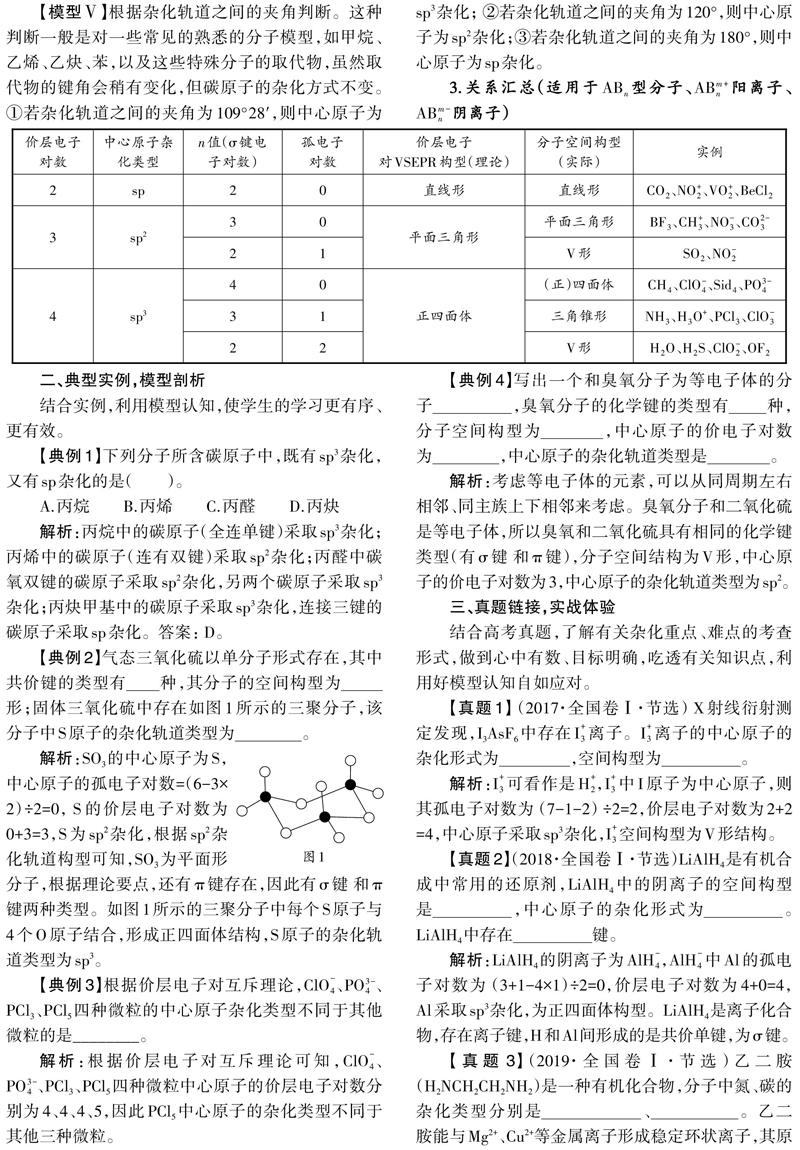
当原子成键时,原子的价电子轨道相互“混合”,形成与原轨道总数相等且能量相同的等同杂化轨道。虽然杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同,但都尽可能采取对称的空间构型。杂化轨道成键时都是σ键,π键是由两个p轨道从侧面重叠而形成的,连接一个双键、一个三键的原子分别有一个、两个π键,大多数多元含氧酸根(或酸性氧化物)都含有π键。
综上,杂化轨道理论是高中化学的一个重要内容,在教学中,教师通过构建模型认知,引导学生理解并熟记常见的认知模型,通过有序的训练,形成一些固有的、良好的认知习惯,更快、更好地进入有效的思维状态,最终突破重难点。
[ 参 考 文 献 ]
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018.
[2] 王祖浩.普通高中课程标准实验教科书·化学:物质结构与性质[M].南京:江苏教育出版社, 2009.
[3] 化学课程教材研究开发中心.普通高中课程标准实验教科书·化学:物质结构与性质[M].北京:人民教育出版社,2019.
(责任编辑 罗 艳)
