不同水文情形下巢湖有色可溶性有机物来源及分布特征
2021-10-17李宇阳郭燕妮朱俊羽周永强胡春华
李宇阳, 郭燕妮, 朱俊羽, 周 蕾, 3, 周永强, 3, 胡春华
1. 南昌大学资源环境与化工学院, 鄱阳湖环境与资源利用教育部重点实验室, 江西 南昌 330031 2. 中国科学院南京地理与湖泊研究所, 江苏 南京 210008 3. 中国科学院大学, 北京 100049
引 言
湖泊蓄调水源、 维持区域生态、 极大地促进了城市旅游发展、 居民生活、 工业生产、 水产养殖等, 是较为宝贵的自然资源。 自然湖泊水源供给一般为区域降水, 由上游河道汇入湖泊, 因而对流域内产生的碳有着强烈的汇集。 湖泊碳循环是全球碳循环过程中较为重要的一环, 在生态系统物质交换中也扮演着重要角色, 但随着人类活动导致的湖泊富营养化的加剧, 其物质流循环与碳循环过程也愈发复杂。 巢湖是长江中下游半封闭式湖泊, 为我国五大淡水湖之一, 在供给城乡用水、 提供航道交通、 保护地区生态、 发展渔业资源等方面发挥着重要作用。 巢湖作为重要的水源供给地哺育了周边合肥及巢湖市近千万人口, 极大地支撑了社会经济发展及文明进步。 但由于城市化开发导致的人为过量营养盐输入而导致水质污染, 近三十年来巢湖藻华频发, 生态环境退化显著。 目前巢湖是我国“三湖三河”治理的重点和难点之一。
有色可溶性有机物(chromophoric dissolved organic matter, CDOM)结构复杂, 由腐殖酸、 富里酸、 脂肪类及芳香烃类等组成。 一般而言, 自然湖泊中的CDOM主要来源于地表径流夹杂的大量陆源土壤有机质输入以及陆源腐殖质淋溶; 大型富营养化浅水湖泊中, 藻华颗粒死亡降解过程中也会释放大量内源性CDOM。 较高浓度的CDOM会使水体自净能力减弱, 发黑发臭, 且在水质净化与治理过程中产生大量致癌伴生产物, 其来源组成直接影响水处理工艺与流程。 湖泊中CDOM能降解矿化为无机盐及可生物利用小分子CDOM, 维持藻类大量繁殖, 使得湖泊生态失衡, 从而直接危害人类生产生活[1]。
CDOM为水体溶解性有机物中可强烈吸收紫外和可见光的重要组分。 相关研究表明, 光降解可消解自然水体中约50%的CDOM, 此外, 微生物的摄取和降解也是CDOM消减的重要途径之一。 CDOM的动态变化关乎湖泊水生态健康, 其迁移转化过程也影响着全球碳循环, 所以关注其迁移转化尤为重要。
三维荧光光谱(EEMs)结合平行因子(PARAFAC)是表征不同荧光物质组成特征的先进技术之一, 与传统技术相比, 高分辨率荧光光谱可以更加清晰有效地揭示CDOM荧光组分峰团信息, 近年来被广泛运用于揭示不同水体中有色可溶性有机物来源与转化[2]。 刘兆冰等利用三维荧光光谱探讨了渤海和北黄海海域CDOM分布特征、 影响因素和季节变化[3]。 石玉等也用此法分析了太湖水体CDOM在不同水文条件下的迁移转化[4]。 而近几年对巢湖CDOM动态变化的研究相对较少, 本文通过分析不同水文条件下巢湖CDOM组成结构及分布特征, 旨在为研究巢湖碳循环及为湖泊水治理提供参考。
1 实验部分
1.1 样品采集
巢湖位于安徽省中部, 入湖河流众多。 东西长55 km、 南北宽21 km, 湖岸线周长176 km, 水面面积780 km2, 平均水深2.89 m, 流域总面积13 486 km2。 湖水多以地面径流补给, 主要河流为南淝河、 十五里河、 杭埠河、 白石天河、 兆河、 裕溪河, 其中杭埠河年平均流量最高, 其次为南淝河和兆河。
在巢湖主湖区均匀设置13个采样点(图1)。 分别在2018年1, 4和7月开展野外采样, 采集完成后, 通过聚乙烯瓶装存再转移至实验室, 共计39个水样。 取0.7 μm的Whatman GF/F玻璃纤维滤膜过滤水样, 滤后水以测定溶解性有机碳(dissolved organic carbon, DOC)浓度, 留存滤膜萃取后以测定叶绿素Chl-a。 取0.22 μm孔径Millipore滤膜处理水样, 留存100 mL滤后水进行光谱吸收和三维荧光的测定。

图1 巢湖采样点位置
1.2 水文数据
本研究全部水文数据来源于水利部长江水利委员会, 包括巢湖流域2018年1月、 4月和7月的降雨量、 河道流量及相应巢湖平均水位。
1.3 主要水质参数测定
叶绿素Chl-a测定时, 取90%乙醇对留存滤膜高温萃取, 再用分光光度计分别测定波长在665和750 nm处的吸光度值以对Chl-a浓度进行计算。 用Shimadzu TOC-L总有机碳分析仪, 采用NPOC扫吹模式, 温度设定为680 ℃对水样中溶解性有机碳(DOC)进行测定, 单位mg·L-1。 用岛津公司UV-2250紫外分光光度计对总氮(total nitrogen, TN)、 总磷(total phosphorus, TP)进行测量, 测量方法参照(GB11894—89)与(GB11893—89)[5]。
1.4 CDOM紫外可见吸收光谱参数的测定
CDOM吸收光谱选用5 cm比色皿, 用Shimazdu UV-2550 UV-Vis进行扫描, 扫描条件为波长200~800 nm, 且间隔为1 nm, 测量时以超纯水Milli-Q作为空白计算CDOM吸光度。 通过减去700 nm处吸光度以去除样品中潜在的细微颗粒散射, CDOM吸收系数的计算公式为[6]
江边久望,白雾茫茫,多年前的那个少年似乎重新回来,这条中国的大江曾经给过她多少慰藉,深深印刻于脑海,永生不灭。
aλ=2.303×Aλ/r
(1)
式(1)中,aλ为波长设定在λ时CDOM的吸收系数(m-1),Aλ表示校正后波长设定为λ的吸光度数值,r即光程路径(m)。
a350为水样中CDOM在350 nm处的吸收系数, 吸收系数可以用来表示天然水体中CDOM的分子量、 腐殖化程度和来源的差异, 一般高分子量CDOM在较长的波段有较高的吸收, 而分子量较低CDOM在较低波长吸收更强[7]。 本研究以a350表征CDOM的相对浓度,a350越大, CDOM含量越高。S275~295表示CDOM的光谱斜率, 是在波长在275~295 nm之间, 通过非线性拟合得出, 其值越小, CDOM的陆源性腐殖酸所占比重越大[3]。
光谱斜率计算公式为
aλ=aλ0×exp[S(λ0-λ)]
(2)
式(2)中:S为光谱斜率,λ为测定波长,λ0为参照波长440 nm。
1.5 荧光光谱的测定与平行因子分析
采用Hitachi F-7000荧光光度计测定水样中CDOM激光发射三维荧光光谱EEMs, 以Milli-Q超纯水为空白, 光源为700 V氙灯, 激发波长与发射波长分别设定为200~450与250~600 nm, 间隔分别为5和1 nm。 测量完成后, 通过EEMs扣除空白消除拉曼散射, 瑞利散射峰通过drEEM工具包计算消除, 内滤波效应校正采用EEMs对应激发发射波长的吸光度, 校正完成后通过将所有EEMs定标为当日超纯水空白拉曼信号, 使所得EEMs转化为拉曼单位(R.U.)。 将所得的光谱数据转入MATLAB软件, 利用三维矩阵对其进行平行因子分析计算。
1.6 数据处理
用ArcGIS 10.2进行采样点与空间分布图的绘制, 平均数、t检验和标准差以IBM SPSS Statistics 23进行统计分析, CDOM荧光组分与TN, TP, Chl-a和DOC浓度的相关性拟合采用Origin 2018。
2 结果与讨论
2.1 水文条件的划分
根据巢湖流域年均逐月降雨量(1961—2018)见图2, 将三次野外观测分别划分为枯水期(1月, 降雨量为35.64 mm)、 平水期(4月, 降雨量为90.88 mm)、 丰水期(7月, 降雨量为173.77 mm)。

图2 巢湖流域年平均逐月降雨量
2.2 不同水文条件下巢湖CDOM光学特性和DOC的响应

图3 巢湖枯水、 平水和丰水期a350, DOC, S275~295空间分布

表1 巢湖CDOM光学组成指标在枯水期和丰水期均值对比及t检验结果
2.3 平行因子分析结果
用PARAFAC模型对巢湖水样的三维荧光光谱矩阵进行解析和对半检验, 计算得出了四种荧光组分(见图4)。 波长在250/410 nm处的短波类腐殖质C1组分, 一般可归为土壤有机质或陆生植物残体, 通常由地表径流带入湖泊[8]。 一个发射波长在330 nm, 两个激发波长在230和285 nm处的是类色氨酸组分C2, 一般为藻源性DOM经生物降解或者生活污水产生。 类酪氨酸组分C3波长为275/315 nm处, 一般为具有多芳香性的类蛋白组分, 通常是生物降解或者微生物矿化产物。 发射波长在235 nm, 两个激发波长在265和460nm处的是长波类腐殖质C4, 一般为陆生源, 亦即土壤及地表有机碎屑淋溶输入。

图4 平行因子分析得到的3个荧光组分激发发射荧光图谱和对半检验
2.4 荧光组分空间分布
由表1可知, 丰水期荧光组分C2显著低于枯水期(t检验,p<0.001); 组分C4显著高于枯水期(t检验,p<0.05); 组分C1、 C3在丰水期、 枯水期并无显著差异(t检验,p>0.05)。 从空间分布(图5、 表2)来看, 各组分荧光强度因水文条件改变而有所不同, 陆源类腐殖质组分C1和C4高值主要分布于十五里河、 南淝河入湖口, 且随着来水量的增大其荧光强度不断提高, 这可能是因为地表径流所携带的大量陆源类腐殖质通过十五里河、 南淝河汇入巢湖湖区, 且南淝河常年流量较大, 流速较快, 较高的流速对河岸进行冲刷也会使更多的类腐殖质物质进入湖区, 这也与2.2中DOC和CDOM吸收系数a350结果相吻合。 组分C2高值主要分布于西部湖区东沿岸, 这可能与当地排放工业废水和生活污水有关, 且随着水量增加的稀释作用, 其荧光强度逐渐降低。 组分C3高值出现在平水期, 分析认为随着季节变化, 温度逐渐升高, 加之氮磷营养盐的浓度的提升, 湖内藻类开始生长繁殖致使组分C3荧光强度升高。

图5 巢湖枯水、 平水和丰水期四种荧光组分的空间分布
2.5 水质参数的空间分布及与荧光组分的相关性分析
采样期间, Chl-a值从枯水的6.2~23.7 μg·L-1增大到丰水期的25.0~2860.6 μg·L-1。 从空间分布来看, Chl-a高值主要分布于十五里河、 南淝河入湖口, 且由入湖口向主湖区逐步扩散, 与TP和TN的分布相类似, 也意味着湖区藻类爆发主要源于十五里河、 南淝河氮磷的输入。
在杭埠河入湖口出现了较明显的低值, 可能是因为杭埠河流量较大, 入湖口流速较快, 较强的水力扰动抑制了藻类生长, 且随着来水量的增大, 稀释了水体中的氮磷。
在本研究中, DOC与短波类腐殖质C1相关性最好(r2=0.60,p<0.001); TN, TP与短波类腐殖质C1也有较显著的相关性(r2=0.33,p<0.001;r2=0.26,p<0.01); DOC与类色氨酸C2显著正相关(r2=0.13,p<0.05); TN, TP与长波类腐殖质C4显著正相关(r2=0.48,p<0.001;r2=0.50,p<0.001), 见图6与表2。
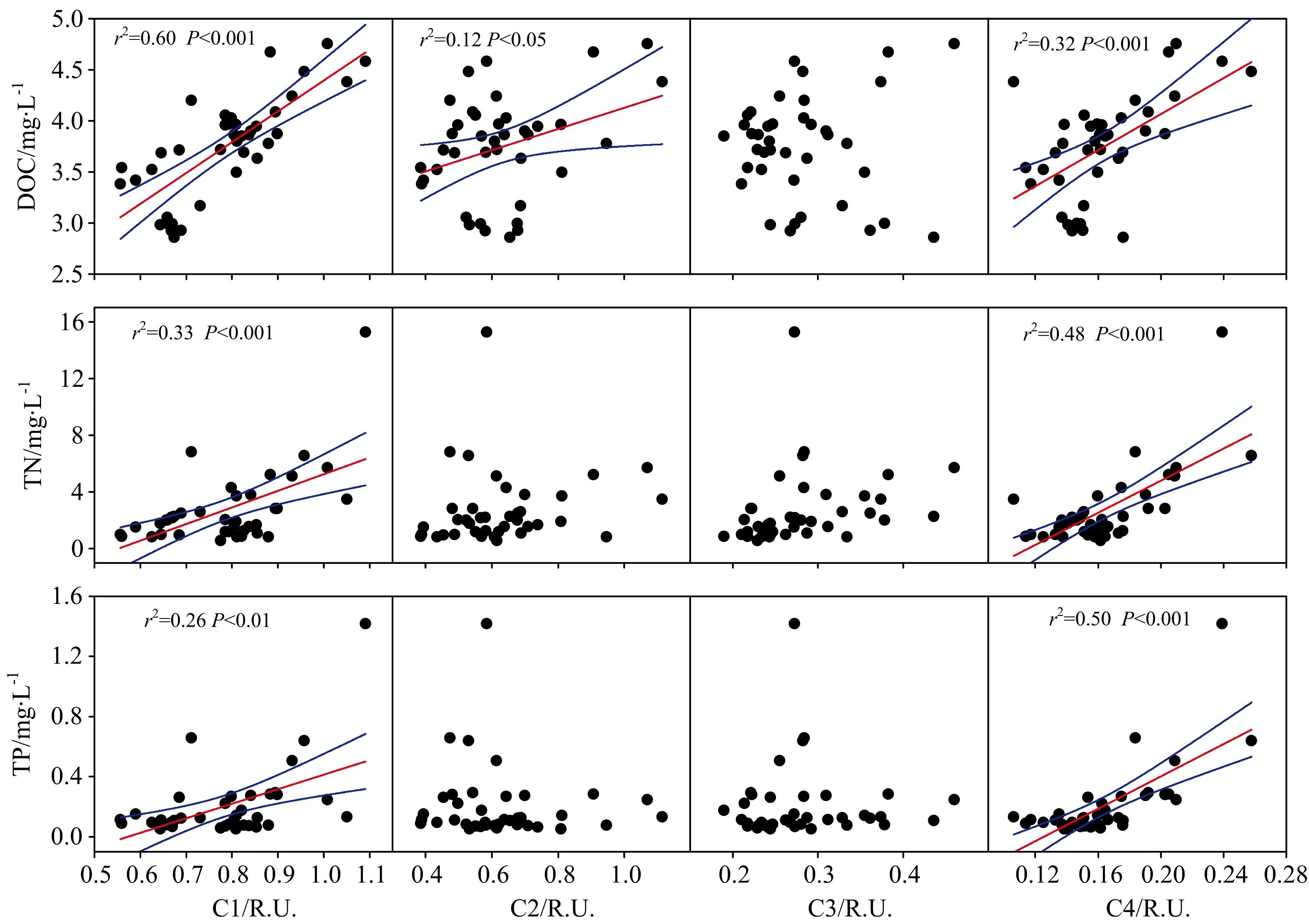
图6 DOC, TN, TP与短波类腐殖质组分C1、 类色氨酸组分C2、 类酪氨酸组分C3、 长波类腐殖质C4的相关性

表2 短波类腐殖质C1、 类色氨酸C2、 类酪氨酸C3、 长波类腐殖质C4与水质参数的皮尔逊相关系数
自然湖泊的CDOM主要来源于有机质的外源输入以及水生植物生命活动的内源产生。 由于不同湖泊地理的独特性以及入湖水源的不同, 自然湖泊水系中的CDOM的组成和水平可能会发生变化[9]。 姚昕等的研究表明东平湖丰水期 CDOM 同时受外源和内源输入的影响, 但以内源输入为主, 主要来源于浮游植物降解产物[10]。 有研究显示丰水期入湖河流输入是洪泽湖、 骆马湖两湖泊CDOM的主要贡献源, 且不同水文条件下洪泽湖CDOM陆源类腐殖质占主导地位。
巢湖是长江中下游五大淡水湖之一, 湖水主要靠地面径流供给, 由十五里河、 南淝河、 杭埠河等河流从南、 西、 北三面汇入湖区, 然后经裕溪河流入长江。 由于巢湖流域入湖河流较多, 湖区内CDOM组成成分较为复杂。 已有研究表明, 巢湖入湖河流主要污染来源为有机污染, 且南淝河、 十五里河流经市区, 其污染等级最高。 耿世雄等利用三维荧光光谱分析了巢湖入湖河流南淝河水体水样, 结果表明南淝河腐殖酸和类蛋白成分较为显著, 即南淝河有机物主要为人为输入[11]。 在本研究中枯水期CDOM高值主要位于兆河入湖口, 丰水期高值位于十五里河、 南淝河入湖口, 并且在入湖口得到了较强的陆源CDOM特征, 且随着来水量的增大表现出从入湖口向主湖区扩散的趋势, 此时外源有机质输入是巢湖西部湖区CDOM的主要贡献源, 这一点在S275~295分布上也有所体现。 在平水期, 随着季节变化, 温度的升高与外源N和P的输入, 湖区内藻类开始生长繁殖, C3类酪氨酸组分达到高值, 且在分布上也与Chl-a, TP和TN有一定的相似性, 此时巢湖湖区CDOM作要贡献源为藻类的降解产生, 这也证实了不同水文条件对巢湖的CDOM来源有着显著的影响。
巢湖水体中两种陆源类腐殖质和两种类蛋白组分也有显著季节性变化, 陆源类腐殖质组分C1和C4均受入湖河流影响较大, 在分布上有一定的相似性, 高值主要分布于西部湖区十五里河、 南淝河入湖口, 且随着来水量的增大, 荧光强度不断升高, 由枯水期到平水期再到丰水期有向主湖区扩散的趋势, 这可能是由于季节更替, 流域内雨量增加, 难降解的陆源类腐殖质随地表径流不断向湖区输入。 相比之下, 类蛋白组分C2荧光强度由枯水期到平水期再到丰水期不断降低, 在丰水期荧光强度最低, 这可能是因为类蛋白组分C2与污水水质有关, 枯水期巢湖水位低, 降解污染物能力不足[12], 组分C2受合肥市区生活污水影响较大, 而丰水期, 来水量增大, 对巢湖污染物有一定的稀释作用, 且丰水期光照较强, 类蛋白组分易光解。 由此可见, 类腐殖质组分与类蛋白组分来源具有差异性, 不同的水文条件巢湖CDOM组成也有所不同。
降水, 农业灌溉, 生活污水排入和水生植物的生命活动都会影响湖泊CDOM的组成与来源。 在现有的研究中, DOC浓度与水温, Chl-a, 无机氮息息相关, 也表现出明显的季节差异性。 叶琳琳在研究中指出, 温度的升高可以促进藻类的光合作用过程, 加快产物的生成增加内源性DOC, 也可以促进土壤DOC循环释放增加外源DOC的输入[13]。 在本研究中, DOC浓度与陆源短波类腐殖质C1的相关性较之于其他组分来说最好, 这可能是由于巢湖入湖河流南淝河的年平均流量较大, 且污染较为严重, 含高浓度DOC的河水汇入导致巢湖DOC有明显的自西向东扩散趋势, 这一点也与叶琳琳的研究相吻合。
目前巢湖已出现湖泊生态系统失衡、 水体自我调节能力弱、 供给饮用水水质不达标等问题。 从本文数据来看, 为应对巢湖水质恶化, 应主要对流经合肥市区的河流进行治理和监测(特别是在降雨量较大的月份)。 随着上游河流的污染, 外源CDOM的输入量不断增加, 且由于氮磷等营养盐的输入而导致的富营养化, 也会让内源CDOM不断产生, 而蓝藻水华也会降低水体透明度进而影响CDOM的光降解。 CDOM作为光学上可测量的成分, 其陆源腐殖质成分C1、 C4分布与污染物的输入及其相似, 类酪氨酸组分C3也与藻类的生命活动息息相关, 基于此, 今后可从不同月份CDOM光学组分与水质要素的相关性入手, 以期对巢湖水质恶化和富营养化风险进行评估。 采样期间, 丰水期湖区藻类爆发, 水体浑浊, 由于南淝河和十五里河污染程度较严重, 且流量较高, 应当作为治理重点, 在河流上游排查污水暗管, 整治街道生活污水排放, 定时河道清污, 在适宜段放置生态浮岛, 尽可能改善河流水质, 减少汇入巢湖的污染。

图7 巢湖枯水、 平水、 丰水期的Chl-a, TP, TN空间分布
3 结 论
(1) 巢湖CDOM的组成与来源有明显的季节差异性, 枯水期与丰水期, 入湖口出现a350的高值与S275~295的低值, 且陆源类腐殖质C1、 C4有从入湖口向湖区扩散的趋势, 此时陆源输入是西部湖区主要贡献源; 平水期主湖区CDOM浓度不高但类酪氨酸C3组分显著大于其他荧光组分, 此时主要污染贡献源为藻类的降解。
(2) 本研究中巢湖TN, TP, Chl-a和DOC浓度均与陆源类腐殖质C1和C4均有很好的相关性, DOC与类色氨酸C2有较好的相关性。 即巢湖CDOM与N、 P元素的迁移转化密切相关, 与DOC定量相关。
(3) 巢湖TN, TP和DOC受外源输入影响较大, 且由于夹杂了大量高浓度有机物的河水汇入, 丰水期巢湖水质较差, Chl-a浓度高, 宜在南淝河和十五里河定期开展河道清污。
致谢:感谢邹伟、 施坤、 石玉、 李元鹏、 张柳青、 李娜及张成英等同志在野外及室内实验过程中给予的帮助。
