基于MICP方法固化采煤下行裂隙土体力学特性试验研究
2021-10-17张嘉睿夏玉成李殿鑫梅奥然
张嘉睿,李 涛,夏玉成,高 颖,李殿鑫,王 锐,3,梅奥然
(1.西安科技大学 地质与环境学院,陕西 西安 710000;2.六盘水师范学院 矿业与土木工程学院,贵州 六盘水 553004;3.陕西省一八五煤田地质有限公司,陕西 榆林 719000;4.贵州大学 资源与环境工程学院,贵州 贵阳 550000)
煤炭开采导致地下水资源流失及流域生态环境恶化,资源开采与生态保护矛盾突出,所以对潜水含水层的保护不容忽视[1]。采动造成的下行裂隙是潜水流失的主要通道之一,导水裂隙带与水体之间应具备合理的保护层厚度[2-3]。隔水层内下行裂隙带的存在,实质上降低了隔水层的有效厚度,造成浅表土壤水分流失、土壤结构破坏等一系列后果[4-5]。对于下行裂隙一般采用填充水泥、高水材料等手段进行修复[6-7],而化学材料的使用造成了生态进一步退化,因此亟需开发有利于环境保护和能源节约的修复材料及配套技术[8]。
近年来,微生物诱导碳酸钙结晶(MICP)技术已应用在多种工程领域,包括砂土改良、污染土修复、古建筑修复、混凝土修复、抑制飞尘等[9];通过MICP的试管试验和一维砂柱试验,发现温度与碳酸钙生成速率、生成量呈正相关关系,生成碳酸钙晶型基本一致,且在一般土壤温度下MICP都能有效加固土体[8];分别对砂质黏土和粉土进行MICP注浆固化,其主要胶结物为方解石型碳酸钙,碳酸钙含量和无侧限抗压强度均随固化次数增加而提高,土体强度受碳酸钙生成量影响并存在敏感阈值[10-11];微生物对裂隙试样修复效果显著,可达到隔水层再造的目的[12];对掺入纤维的砂土进行MICP处理,可改善砂土的抗剪强度和应变软化特性,产生的碳酸钙有利于纤维锚固土体,使加筋效果强化[13];微生物掺入水泥基材料,使试件抗压强度和刚度大幅提高,对开裂期越短、宽度越小的裂缝修复率越高,可实现近100%的修复率,生成文石、方解石型碳酸钙结晶[14-16];对于花岗岩试件与砂岩试件,裂隙处填充介质密实度越大,碳酸钙生成量越多,加固效果越好,岩石试件抗拉强度随裂隙粗糙度增加而增大[17]。MICP技术作为1种绿色环保的固土新方法,其优势在于绿色环保,对生态环境友好[18]。利用微生物诱导碳酸钙结晶将松散的砂土颗粒胶结,可加固裂隙土体并提高其物理力学性质。为此,采用巨大芽孢杆菌作为修复材料,该菌种不仅能应用于土体固化中,还能起到土壤增肥及净化地下水的作用[15];制作试样并预制裂缝,对土体的预制裂缝充填微生物菌液、胶结溶液、砂土混合物并压实,对MICP处理后的试样进行无侧限抗压强度试验和抗剪强度试验,通过测试修复后土体物理力学特征的变化,进一步揭示MICP对裂隙土体的修复机理。
1 菌种培养及试样制备
1.1 菌种活化和培养及胶结液配制
选用菌种为巨大芽孢杆菌(Bacillus megaterium de Bary),来自中国普通微生物菌种保藏管理中心。采用液体培养基,其营养物质包含:牛肉蛋白胨、酵母提取物和NaCl,pH调节至7.0左右,溶剂为去离子水,培养基配方见表1。
1.1.1 巨大芽孢杆菌的活化
从中国普通微生物菌种保藏管理中心采购的巨大芽孢杆菌,是存储于安瓿瓶中的巨大芽孢杆菌冻干粉,巨大芽孢杆菌冻干粉如图1。
在进行微生物培养前,需对其活化,活化过程大致分为以下几步。
1)试验器材灭菌处理。将玻璃器材反复清洗至少3次,再用超纯水将所用器皿润洗干净。将实验器材置于高压蒸汽灭菌锅中进行灭菌处理,在温度121℃、0.1 MPa条件下保持20 min。
2)配置液体培养基。按表1中的培养基配方配制液体培养基,充分溶解后取适量装入锥形瓶,用医用棉塞住瓶口,包裹1层牛皮纸,用棉线扎口封装,置于高压灭菌锅,在121℃、0.1 MPa条件下保持30 min后,放入超净工作台中冷却待用。
3)安瓿瓶开封。在超净工作台中用75%酒精棉球擦拭安瓿瓶,用镊子敲击瓶身顶部,取出瓶内细菌编号纸,将巨大芽孢杆菌冻干粉留在瓶底。用量程为1 000μL的无菌移液枪吸取1~2 mL液体培养基注入安瓿瓶中,反复吹打,将细菌干粉溶解,混合均匀后变成悬浮溶液。
4)接种。使用无菌移液枪吸取细菌悬浮液,注入经灭菌处理后的液体培养基中,将其放入30℃生化恒温培养箱,静置培养72 h。
1.1.2 巨大芽孢杆菌的培养
巨大芽孢杆菌活化后可进行扩大培养,用于后续的土力学试验。细菌的扩大培养须在严格的无菌环境下进行,所有试验操作均在紫外灯灭菌后的超净工作台中完成,且操作过程尽量在酒精灯外焰附近进行。具体步骤如下。
1)配置液体培养基。液体培养基主要用于细菌的扩大培育,液体培养基配方见表1。配制完毕后放入高压蒸汽灭菌锅,以120℃、0.1 MPa条件进行高温蒸汽灭菌,保持30 min,灭菌完成后取出液体培养基放入超净工作台冷却待用。
2)接种。将活化好的菌液取出放入超净工作台,用无菌移液枪从液体培养基中吸取4~5 mL菌液,分别加入2瓶200 mL新鲜培养基中,随后封装瓶口。
3)培育。将装有200 mL已接种液体培养基的锥形瓶放入生化恒温培养箱,培养箱参数设置为30℃,培养时间为48 h。
1.1.3 胶结液的配制
胶结溶液是为微生物诱导矿化提供氮源与钙源,选材包括尿素与CaCl2,胶结溶液配方见表2。
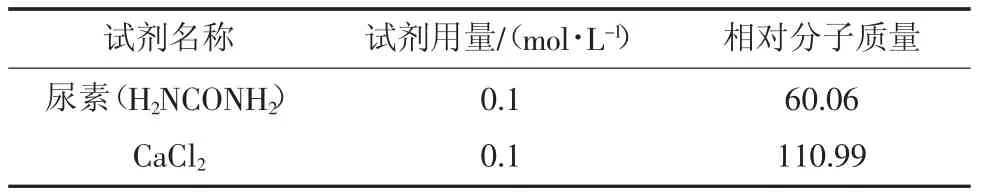
表2 胶结溶液配方Table 2 Cementing solution formula
1.2 试样制备
1)预制裂缝。预制裂缝如图2。固化试样分为2种:①对于无侧限抗压强度试验,试样直径3.91 cm,高度8.00 cm,在所有圆柱体试件顶面由上向下预制1条相同长度、深度且表面缝宽为0.40 cm并随深度逐渐缩小的裂缝;②对于直接剪切试验,试样直径6.18 cm,高度2.00 cm,在所有圆柱体试件顶面由上向下预制3条相同长度、深度且表面缝宽为0.20 cm并随深度逐渐缩小的裂缝。

图2 预制裂缝Fig.2 Precast crack
2)充填物配比。裂隙充填物选择砂土混合物:标准砂过0.2 mm筛,土过0.1 mm筛,两者以体积比1∶2比例混合。在充填裂隙过程中,同1组内对4个试样分别注入不同浓度微生物菌液及等浓度胶结溶液,菌液浓度依次为40%、60%、80%、100%。
3)裂缝充填工艺。以砂土混合物为骨料,以不同浓度菌液与等浓度胶结液的混合溶液为黏合剂,将二者注入试样预制裂缝中,具体操作为:用药匙将混合均匀的砂土骨料掺入裂缝并适当压实,同时用注射器将菌液和胶结液的混合溶液注入裂缝,使混合溶液和骨料交替充填。反复以上操作,直至裂缝充填完成,并将上表面涂抹平。填充完成后置于室温条件下培养,待修复完成后进行试验测试。使每项试验不少于4组样本,每组样本不少于3个试样。
2 试验方法
为了分析微生物菌液对裂隙土体加固效果,在温度、裂隙特征、固化方法、固化时间等条件均相同的情况下,对相同参数的试样进行加固处理。将培养好的原菌液利用无菌水进行稀释,配制成40%、60%、80%、100%4种浓度。
1)菌液浓度检测。采用紫外可见分光光度计,调节波长至600 nm,形状规则的(近似球形)微生物菌浓度(干重)和吸光度有线性关系[19],利用细菌的吸光度来测定细菌培养液的浓度,从而判定细菌的生长发育情况[20]。
2)无侧限抗压强度试验。采用无侧限抗压强度试验来获得微生物注浆处理前后试样抗压强度。对固化后的试样采用应变控制式无侧限压缩仪进行试验,在不加任何侧向压力的情况下施加垂直压力,当轴向应变大于20%或轴力出现峰值后,2%~3%应变时停止试验,计算最大轴向应力作为无侧限抗压强度[15]。4种菌液浓度由低到高依次对应编组1#、2#、3#、4#4组试样,每组设3个样本。无侧限抗压强度试验如图3,应力-应变计算见GB/T 50123——1999《土工试验方法标准》。

图3 无侧限抗压强度试验Fig.3 Unconfined compressive strength test
3)直接剪切试验。采用应变控制式直剪仪进行固结快剪试验,来获得微生物注浆处理前后试样抗剪强度。将试样以裂缝走向垂直于剪切方向的方式放入剪切盒内,对试样施加相同垂直载荷,沿固定剪切面施加相同水平剪力,剪力由0开始增加,试样剪破时剪力达到最大值,对应剪破面上剪应力达到抗剪强度。直接剪切试验如图4,计算不同浓度菌液处理后试件的抗剪强度。4种菌液浓度由低到高依次对应编组5#、6#、7#、8#4组试样,每组设3个样本。

图4 直接剪切试验Fig.4 Direct shear test
3 试验结果讨论
3.1 菌液浓度的变化
通过对比600 nm波长下微生物菌液与空白水样间的吸收光能量差,计算菌液的吸光度(OD值)[15],用OD600值来表示菌液浓度,其原理主要是依据细胞浓度与其菌液的混浊度成正比,因此与吸光度也成正比[21]。分别检测40%、60%、80%、100%浓度下微生物菌液OD600值,不同菌液浓度OD600值如图5。

图5 不同菌液浓度OD600值Fig.5 OD600 values of different bacterial concentrations
每种浓度测试3个试样并计算平均值,40%、60%、80%、100%浓度的微生物菌液对应的OD600值依次为:1.33、1.53、1.75、1.9,该值用于表征试验中微生物的菌液浓度。
3.2 菌液浓度与试样无侧限抗压强度的关系
对不同浓度菌液微生物注浆加固处理后的试样进行无侧限抗压强度试验,无侧限抗压强度试验结果见表3。
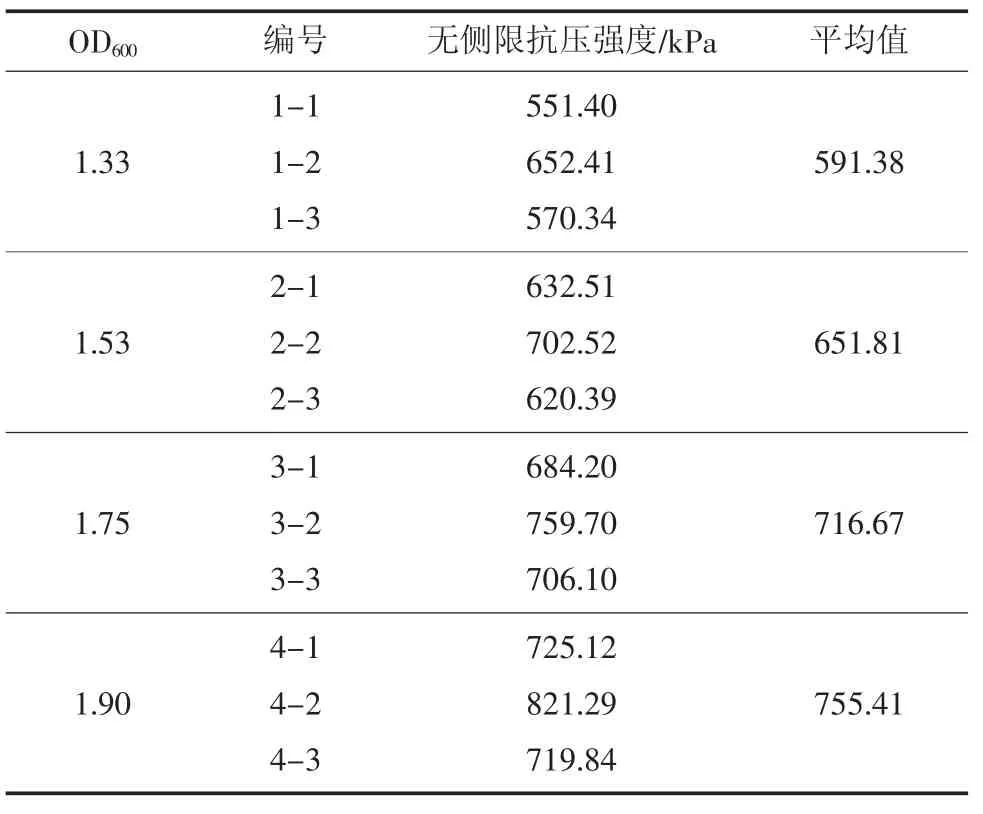
表3 无侧限抗压强度试验结果Table 3 Unconfined compressive strength test results
结果表明,在采用不同浓度菌液对试样进行固化处理后,随着菌液浓度的递增,试样无侧限抗压强度依次提高。对于OD600值分别为1.33、1.53、1.75、1.90的菌液固化处理的试样,其无侧限抗压强度峰值比例为1∶1.102∶1.212∶1.277。编组1(OD600=1.33)的试样无侧限抗压强度最低,随着菌液浓度增大,编组2、编组3、编组4的试样无侧限抗压强度依次提高了10.22%、21.19%、27.74%,无侧限抗压强度变化关系如图6。

图6 无侧限抗压强度变化关系Fig.6 Variation of unconfined compressive strength
3.3 菌液浓度与试样抗剪强度的关系
对微生物注浆加固处理后的试样进行直接剪切试验,将裂缝走向垂直于剪切方向,分别施加相同载荷,沿固定剪切面施加相同水平剪力直接剪切试验结果见表4。
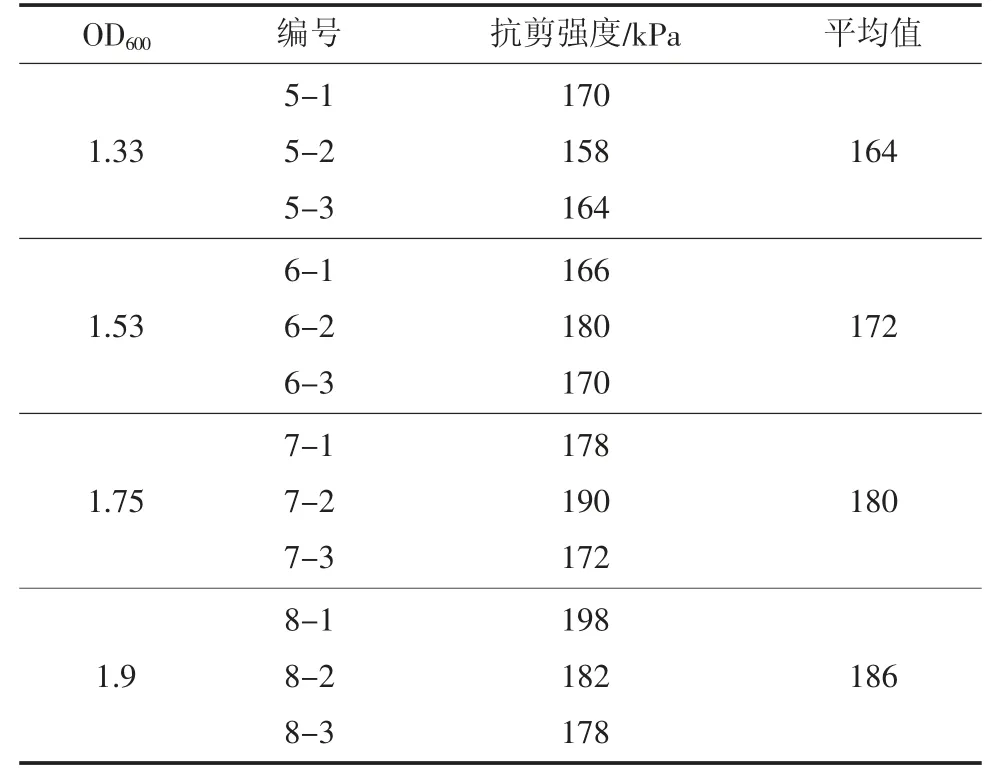
表4 直接剪切试验结果Table 4 Direct shear test results
在采用不同浓度菌液对试样进行固化处理后,随着菌液浓度的递增,试样抗剪强度依次提高。对于OD600值分别为1.33、1.53、1.75、1.9的菌液固化处理的试样,其抗剪强度比例为1∶1.049∶1.096∶1.134。编组5(OD600=1.33)的试样抗剪强度最低,随着菌液浓度增大,编组6、编组7、编组8的试样抗剪强度分别提升了4.88%、9.76%、13.41%,抗剪强度变化关系如图7。

图7 抗剪强度变化关系Fig.7 Variation of shear strength
3.4 MICP固化机理及其优势
微生物诱导碳酸钙结晶固化裂隙土体大致分为3个阶段:①微生物、营养物质、砂土混合物等同时注入裂缝后,巨大芽孢杆菌经新陈代谢产生脲酶,将胶结溶液中的尿素催化水解,生成铵根离子和碳酸根离子[22];②微生物细胞表面带负电荷,使溶液中的钙离子被细胞吸附,当钙离子与溶液中碳酸根离子相互结合达到饱和状态,从而在细胞表面析出碳酸钙沉淀;③随着微生物细胞周围碳酸钙沉淀不断生成,形成以细菌为成核点的碳酸钙结晶,充填于裂隙土体孔隙中,裂隙中松散的砂土颗粒逐渐被胶结为整体[23-25]。因而当微生物菌液浓度较高时,注浆后微生物细胞在砂土体中分布密度较大,碳酸钙晶体结晶更加充分,能够更有效地充填孔隙并固化,与周围土体形成具有一定力学性能的整体,以达到修复裂隙的目的。
MICP技术是以碳酸钙结晶作为黏结砂土颗粒的胶结材料,使裂隙土体颗粒之间联结力增强,从而提高裂隙土体的无侧限抗压强度与抗剪强度,达到改善其物理力学性质的目的。相比于传统的化学灌浆技术,MICP技术避免了对周围土体的扰动及对生态环境的破坏,具有可持续性和绿色环保等特点[26]。在MICP实现加固作用后,由于微生物菌种所处环境中营养物质的缺乏,以及微生物细胞被碳酸钙沉淀包裹,导致菌种逐渐死亡,对环境影响较小,且生成的沉淀物对环境无害,因而具有能耗低、污染小的优势,符合低碳经济和环境友好的原则[27]。
4 结论
1)MICP技术可一定程度上修复加固土体裂隙,提高试样无侧限抗压强度及抗剪强度,改善受损土壤物理力学性质。
2)低浓度菌液对土体裂隙的修复能力弱于高浓度菌液。随着菌液浓度升高,试样无侧限抗压强度和抗剪强度均逐级提升,裂隙土体的修复效果提升。相较而言,抗剪强度提高有限。
3)MICP技术作为1种绿色环保的固土新方法,有实现工程应用的前景,但仍需考虑外部影响因素,并改进固化工艺和固化方式。
