QuEChERS-冷冻诱导液液萃取/液相色谱-高分辨质谱法测定蔬菜水果中77种农药残留
2021-10-17赵云峰陈达炜
毕 军,任 君,赵云峰,陈达炜*
(1.国家食品安全风险评估中心/卫生部食品安全风险评估重点实验室,北京 100021;2.盘锦检验检测中心,辽宁 盘锦 124000;3.乌海市检验检测中心,内蒙古 乌海 016000)
随着农药种类和使用量的逐年递增,由此带来的农产品中农药残留增多的问题受到了全世界的广泛关注。近年来,已有多家国际机构对农药残留的危害展开了评估,并制定了严格的限量要求[1-3]。我国实施的GB2763-2019也规定了食品中农药最大残留限量标准[4],为我国食品中农药残留的监管提供了政策保障。但由于农药“乱用滥用”问题仍然存在,且多数植物源性食品中农药残留的种类较多、含量较低。因此,为了更好地实施食品安全战略,在完善已有标准的同时,建立新的农药残留分析方法,提高检测水平显得更加重要。
目前,农药残留在环境及食品中的主要测定方法有气相色谱法(GC)[5]、液相色谱法(LC)[6]、液相色谱-质谱法(LC-MS)[7-9]、气相色谱-质谱法(GC-MS)[10]。其中,质谱技术因具有高灵敏度、高选择性等特点已成为农药残留痕量检测的主要手段,高分辨质谱更因其卓越的非靶向筛查能力而受到广泛关注。对于蔬菜水果最常使用的样品前处理方法主要包括液液萃取法(LLE)、固相萃取法(SPE)及QuEChERS法等[11-15]。其中,QuEChERS方法是一种基于分散固相萃取(DSPE)技术的净化方法,通常使用的吸附剂为N-丙基乙二胺(PSA)、石墨化炭黑(GCB)和C18粉,该方法因操作简便、价格低廉等优点被广泛应用[16]。然而,QuEChERS方法在面对复杂基质时常会出现净化效果欠佳、富集倍数不高的现象,需要根据实际检测需求进行改进,或与其它净化技术结合使用以达到更加理想的净化、富集效果[17]。冷冻诱导液液萃取技术(CI-LLE)是在LLE技术基础上发展起来的一种新技术[18-20]。该技术操作简单,在乙腈-水混合溶液中,通过低温使得乙腈在水相中的溶解度下降而诱导相分离。其中,高极性化合物分布在下层水相,而大量的分析目标物则分配在上层乙腈相。通过调节乙腈-水混合溶液的比例,可实现分析目标物的富集和净化。
基于以上技术背景,本研究采用CI-LLE技术对QuEChERS方法进行优化改良,显著提升了样品净化效果,降低了基质效应对农药残留检测的影响,并增强了分析目标物的富集倍数;利用液相色谱-高分辨质谱分析手段,实现了蔬菜水果中77种农药残留的定性定量分析,建立了一种简单、高效和高灵敏的蔬菜水果中农药残留的分析方法。
1 实验部分
1.1 仪器与试剂
Dionex U3000/Q Exactive超高效液相色谱-高分辨质谱(美国Thermo公司),Vortex Genie2涡旋混合器(美国Scientific Industries公司),3K15离心机(德国Sigma公司),超低温冰箱(美国Thermo公司)。
乙腈、甲醇(质谱级,美国Fisher Scientific公司);甲酸、甲酸铵(色谱级,美国Tedia公司);实验用水(美国Millipore公司);氯化钠、无水硫酸钠(分析纯,国药试剂有限公司);有机磷类、氨基甲酸酯类、三唑类、新烟碱类等农药残留标准品(77种)均购自德国Dr.Ehrenstorfer公司(具体名单见表1);多菌灵-D4(Carbendazim-D4)、吡虫啉-D4(Imidacloprid-D4)、啶虫脒-D3(Acetamiprid-D3)、甲氧虫酰肼-D9(Methoxyfenozide-D9)和戊菌唑-D7(Penconazole-D7)购自德国Dr.Ehrenstorfer公司和加拿大TRC公司;DSPE净化剂(50mg PSA+50mg C18+250mg无水硫酸钠)购自美国安捷伦公司。蔬菜水果样品购于各大超市和农贸市场。
1.2 标准溶液的配制
农药混合标准溶液的配制:分别准确称取77种农药标准品适量,用甲醇溶解配制成质量浓度为1000mg/L的标准储备液,于-20˚C储存。用乙腈稀释各标准储备液制得农药标准混合中间液(10mg/L),并逐级稀释成标准混合使用液(10µg/L、100µg/L和1mg/L)。
农药混合内标溶液的配制:分别准确称取5种农药同位素内标适量,用甲醇溶解配制成质量浓度为100mg/L的内标储备液,于-20˚C储存。用乙腈稀释各内标储备液制得农药内标混合中间液(1mg/L),并逐级稀释成内标混合使用液(40µg/L)。
农药混合标准工作曲线:吸取适量标准混合使用液和内标混合使用液,用40%乙腈水溶液稀释成质量浓度分别为0.05 、0.1 、0.2 、0.5 、1.0 、2.0 、5.0 、10、20、50µg/L的系列标准工作曲线,内标质量浓度为2µg/L,并按“1.3 ”执行CI-LLE富集后取上清液进样分析,临用现配。
1.3 样品制备
准确称取蔬菜或水果样品10g(精确至0.01 g),置于50mL离心管中,加入内标混合中间液(1mg/L)50µL,静置10min后,加入10mL乙腈,旋涡混匀5min,再加入2g氯化钠和8g无水硫酸钠剧烈振荡2min,以8000r/min离心5min,取乙腈上清液1.5 mL加入预先装有DSPE混合净化剂的2mL离心管中,旋涡30s,以10000r/min离心5min,取1.0 mL上清液,加入5mL离心管中,再加入1.5 mL纯净水,混匀,执行CI-LLE富集和净化,即在-80˚C冷冻7min诱导相分离后,取上层乙腈相(约300µL),以13000r/min离心5min后,待测定。
1.4 仪器分析条件
色谱条件:Accucore aQ C18色谱柱(2.6 µm,2.1 mm×150mm),柱温40˚C,流动相为甲醇(A)-水(B)体系,两相中均含0.1 %甲酸和4mmol/L甲酸铵,流速0.4 mL/min。梯度洗脱程序:0~4.0 min,2%~20% A;4.0 ~5.5 min,20%~40% A;5.5 ~12.5 min,40%~100% A;12.5 ~14.0 min,100% A;14.0 ~15.0 min,100%~2%A;15.0 ~20.0 min,2%A。进样体积5µL。为减缓色谱分离中所产生溶剂效应,本实验在色谱柱前连接一个溶剂混合器(35µL,美国赛默飞公司)[18]。
质谱参数:采用HESI离子化方式;喷雾电压为3.8 kV;毛细管温度为320˚C;加热温度为400˚C;鞘气为40arb(4×107Pa),辅助气为10arb(107Pa);扫描模式为时间分段全扫描(Full scan)/数据依赖质谱(ddMS2)采集模式,正离子采集,时间分段窗口和扫描范围见表1;Full scan分辨率采用70000 FWHM,自动增益控制(AGC)为3×106,最大注射时间为200ms;ddMS2采集分辨率为17500FWHM,Loop Count为1,TopN为2,逐级碰撞裂解能量(NCE)为15%、35%和55%,触发二级质谱采集的添加列表中包括分析的77种农药的一级质谱精确质量数。农药的质谱采集信息、保留时间、碎片离子见表1。

表1 77种农药的质谱采集信息、保留时间和碎片离子Table1 MS informations,retention times(tR)and fragment ions of77pesticides

(续表1)

(续表1)
2 结果与讨论
2.1 农药种类选择
本研究中农药种类的选择基于前期蔬菜水果日常监测和第六次总膳食研究中液相色谱-高分辨质谱非靶向筛查所获取的数据结果,选取具有一定检出率或超标率的77种常见农药。这77种农药包括有机磷类、氨基甲酸酯类、新烟碱类等杀虫剂,三唑类、甲氧基丙烯酸酯类、咪唑类、酰胺类等杀菌剂,三嗪类等除草剂,哒螨灵等杀螨剂。由于反相液相色谱-高分辨质谱仪对于菊酯类、有机氯类等农药的质谱检测性能不佳,草甘膦、百草枯等高极性农药在常规反相色谱分离效果不佳,本研究未对其进行涵盖。
2.2 仪器条件选择
本研究采用aQ C18色谱柱分析,基于前期农药多残留检测分析中流动相条件的优化[21],甲醇-水体系(两相中均含0.1%甲酸和4mmol/L甲酸铵)能够保证多农药分析的最佳性能。尽管高分辨质谱用于多残留检测的定量分析逐渐增多,但其主要采用较宽采集范围的全扫描技术[21]。在该模式下,四极杆不进行前体离子选择,检测性能下降,尤其在超痕量分析中。由于常规的全扫描采集的质量数范围较宽(m/z100~1000),使进入质谱的离子总数过多,导致质谱分析的稳定性较差,最终影响低水平农药分析的定量准确性。本研究采用时间分段法,通过在一定时间下,缩减靶向检测分析物的质量范围,进而降低过多干扰物的离子总数,从而提高靶向分析物的分析准确性。如表1所示,在0.50 ~4.30 min的分析时间内,通过限定扫描范围为m/z140~220,即可涵盖该分析时间内甲胺磷等5种农药的分析,相较于全扫描方法的m/z100~1000扫描范围,在固定的AGC离子总数内,较窄的扫描范围能较大程度提高痕量农药残留水平的累积,进而提高定量检测水平的稳定性和准确性。本研究中77种农药的总提取离子流图见图1。

图1 77种农药(1µg/L)的总提取离子流图Fig.1 Total extracted ion chromatogram of77pesticides(1µg/L)
2.3 样品前处理方法的选择
采用QuEChERS法结合CI-LLE技术对样品进行处理,以提高方法的富集和净化效果,降低基质效应对检测的影响。对于CILLE技术,不同的乙腈-水比例对于农药的富集效率有差异,通常采用富集倍数和绝对回收率评价方法的富集效果[20]。本实验考察了不同极性的77种农药在40%、50%、60%、70%和80%乙腈-水溶液下CI-LLE处理所获取的富集倍数和绝对回收率的分布情况,结果见图2。结果显示,随着乙腈比例的不断降低,77种农药的富集倍数逐渐增加,当乙腈比例降至40%时,除了灭蝇胺(0.68 )和烯啶虫胺(0.87 )的富集倍数低于1.0 ,其它75种农药的富集倍数均在1.00 ~5.79 之间,而当乙腈比例降至30%时,相分离消失。尽管乙腈比例降至40%时,大部分农药的绝对回收率有所下降,但约75%农药的绝对回收率大于60%。因此,本实验选择40%乙腈水溶液作为CI-LLE处理的最佳条件。为解决一些中高极性农药由于绝对回收率低导致测定结果不准确的问题,本实验对系列标准曲线也执行CI-LLE处理,进而使77种农药的相对回收率均在70%~120%范围。
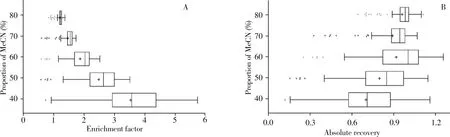
图2 77种农药在不同乙腈-水比例下的富集倍数(A)和绝对回收率(B)分布Fig.2 Distribution of enrichment factors(A)and absolute recoveries(B)for77pesticides under different proportions of acetonitrile water solution
本实验还考察了不同冷冻温度(-80˚C、-30˚C、-20˚C)下,77种农药的CI-LLE分层效果。实验结果表明,只要冷冻时间充足,不同的冷冻温度下均可达到稳定的冷冻诱导分层效果,其中,-80˚C下处理时长为7min,-30˚C下处理时长为45min,-20˚C下处理时长为60min。本实验采用-80˚C作为冷冻诱导分层的处理温度。
与常规的QuEChERS盐析净化相比,本方法增加了后续的CI-LLE处理,约75%农药的富集倍数在3倍以上(图2A),显著提高了方法的检测灵敏度,有助于蔬菜水果中痕量农药的残留分析。此外,通过CI-LLE处理,进一步使得提取液中的残留果胶、糖类和氨基酸等极性干扰物分配于下层水相,达到一定净化效果。
2.4 基质效应
基质效应(增强效应和抑制效应)会对某些待测物的准确定性与定量产生影响。本实验分别选取5种不同水果和5种不同蔬菜样品,按照“1.3”处理后上机测定,若未检测到任何目标化合物,则选用该样品提取液为空白基质。用上述空白基质提取液及40%乙腈水溶液分别配制质量浓度范围在0.05 ~50µg/L的基质混合标准溶液和溶剂混合标准溶液,以目标化合物的峰面积为纵坐标,测定质量浓度为横坐标绘制标准曲线。依据不同基质溶液与纯溶剂配制的标准曲线斜率的比值评价方法的基质效应,若斜率比值介于0.8 ~1.2 之间,则认为基质效应对定量测定无显著影响,可以忽略;若斜率比值超过上述范围,则表明基质效应较强。
采用上述方法评价本实验方法中77种不同极性农药的基质效应,结果如图3所示。不同基质(n=10)对目标化合物的基质影响的斜率比值在0.66 ~1.27 之间,且约97%的农药在蔬菜水果中的基质效应介于0.8 ~1.2 之间,说明本方法中,不同水果、蔬菜样品对77种农药残留的基质效应影响在可控范围之内。此外,为弥补不同基质间所产生基质效应的差异以及样品前处理过程所产生的损失,本实验选用5种不同极性的同位素内标配制纯溶剂混合标准曲线进行内标法定量分析。
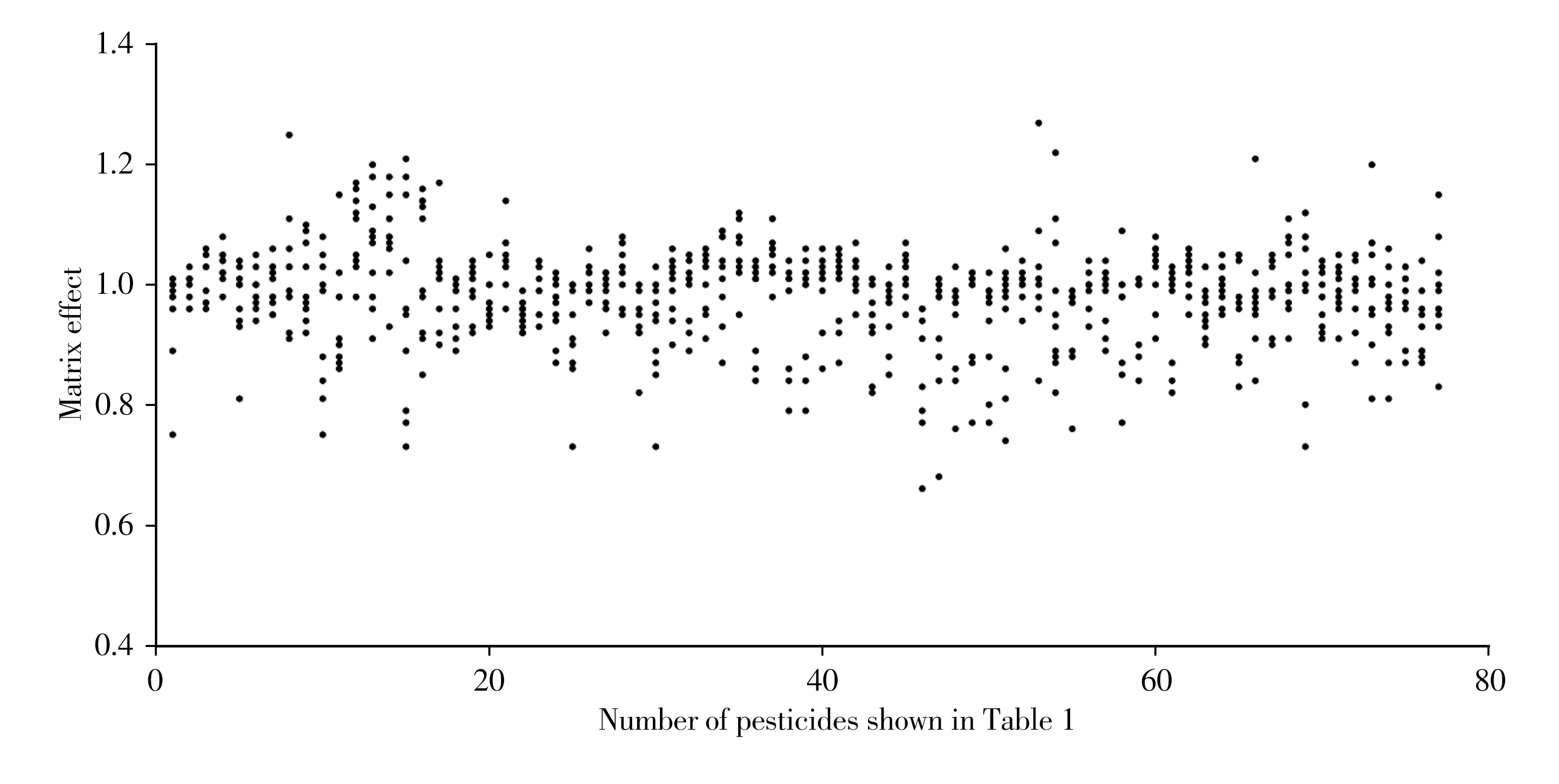
图3 77种农药在不同蔬菜和水果基质中的基质效应(n=10)Fig.3 Matrix effects of77pesticides from different vegetable and fruit matrices(n=10)
2.5 线性范围、检出限及定量下限
配制质量浓度为0.05 ~50µg/L的系列标准混合溶液,分别加入50µL同位素内标混合使用液(40µg/L)进行测定,结果如表2所示。77种农药残留在一定质量浓度范围内均呈良好的线性关系,相关系数(r2)均大于0.99 。以标准曲线低浓度水平添加空白样品,经样品前处理后分析测定,分别以3倍和10倍信噪比考察方法的的检出限(LOD)和定量下限(LOQ),测得77种农药的LOD为0.02 ~0.20 µg/kg,LOQ为0.05 ~0.50 µg/kg。

表2 77种农药的方法学数据Table2 Method validation results of77pesticides

(续表2)
2.6 准确度与精密度
分别选用2种蔬菜样品(青椒、菠菜)和2种水果样品(葡萄、苹果)作为空白基质进行准确度和精密度实验,选定加标水平分别为LOQ、10LOQ、100LOQ和100µg/kg。按照“1.3”样品处理后上机测定,每个加标水平重复测定6次,考察方法的回收率和相对标准偏差(RSD)。在4个加标水平下,77种农药在空白基质中的平均回收率为70.8 %~119%,RSD为0.70 %~15%(见表2)。上述结果表明该方法具有良好的准确度和精密度。
2.7 实际样品的测定
采用本文建立的方法对市售的16份水果和65份蔬菜样品中77种农药残留进行检测,共检出43种农药,结果见表3。以上数据表明,本方法可广泛适用于蔬菜水果中77种农药残留的分析检测。

表3 81种蔬菜、水果样品中检出43种农药含量(µg/kg)Table3 Contents of43pesticides in81vegetables and fruits(µg/kg)

(续表3)
3 结 论
本研究采用冷冻诱导液液萃取技术结合QuEChERS净化方法,建立了蔬菜水果中77种农药残留的高分辨质谱检测方法,该方法操作简单,重现性好,能显著降低基质效应对农残检测的影响,具有较高的灵敏度、准确度和精密度,符合农药多残留检测的要求,为水果蔬菜中农药多残留的日常监测提供了可靠的技术支持。
