骨肉瘤化疗敏感性相关基因研究进展
2021-10-17杨贵田征
杨贵 田征
作者单位:830000 乌鲁木齐,新疆医科大学第一附属医院骨肿瘤科
在过去的几十年中,癌症研究发展迅速,化疗的出现可以提高大多数癌症的生存率。尽管靶向治疗和免疫治疗等新的治疗方式已开始在某些肿瘤中取得不错的治疗效果,但化学治疗仍是几乎所有癌症类型的全身治疗方案之一。尽管当今有各种各样的化学疗法可供选择,但是对于大多数患者而言,耐药性仍然是一个严重的问题。骨肉瘤化疗耐药的机制目前尚不明确,可能跟以下途径有关:DNA 拓扑异构酶的活性改变,谷胱甘肽转移酶 ( GST ) 的活性增高,膜运输功能障碍,自噬激活以及 DNA 损伤修复增强等[1]。随着药物基因组学逐渐被视为个性化医疗的工具,并且可以预测癌症患者对化学疗法的反应及临床结果[2],越来越多的学者开始从基因角度去分析与化疗敏感性相关的基因,以求找到化疗耐药的解决办法。笔者将对具有代表性的骨肉瘤化疗敏感性相关基因研究进展作一综述。并根据骨肉瘤化疗主要药物将其归纳为阿霉素、顺铂、甲氨蝶呤、多药耐药相关基因几大类。
一、阿霉素相关基因
1. DNA 损伤修复相关基因 ( PARP1、SIRT6 ):很多抗肿瘤药物的作用机制都是通过破坏 DNA 的结构来促进细胞凋亡,因此,DNA 损伤修复增强可能是肿瘤产生耐药性的重要原因之一。据最新研究报道,目前与化疗耐药相关的 DNA 修复机制主要包括:核苷酸切除修复 ( NER )、碱基切除修复 ( BER ) 以及同源重组修复 ( HRR )[1]。PARP1 和 SIRT6 都是 BER 途径的重要蛋白,已经证明在骨肉瘤细胞系中应用 PARP1 抑制剂奥拉帕利下调 PARP1表达时,骨肉瘤细胞对阿霉素的敏感性明显提高[3]。因此,PARP1 基因可能是改善阿霉素敏感性的靶点基因。最近的研究进一步证实了这一观点,该研究发现 SIRT6 可以通过激活 PARP1 来介导 DNA 损伤修复途径,抑制 SIRT6时,可以增强阿霉素对骨肉瘤细胞的敏感性,同样应用PARP1 抑制剂奥拉帕利可以减轻 SIRT6 过表达导致的阿霉素耐药[4]。PARP1 抑制剂奥拉帕利目前已被国家药品监督管理局 ( CFDA ) 正式批准用于治疗铂敏感复发性卵巢癌维持治疗,未来能否在骨肉瘤中应用有待进一步研究。
2. 低氧相关基因 ( PI3K、NF-κB、AMPK ):缺氧存在于骨肉瘤化疗耐药的机制中,缺氧会降低 MG-63 或 U2-os骨肉瘤细胞对阿霉素的敏感性,但是目前尚无缺氧导致化疗耐药的确定机制[5]。先前的研究发现磷酸肌醇 3 激酶 ( PI3K ) 途径和核因子 κB ( NF-κB ) 通过抑制药物诱导的细胞凋亡参与低氧诱导的耐药性[6]。最近的研究表明,AMPK 在缺氧诱导的骨肉瘤细胞对阿霉素的抗性中起关键调节作用,低氧通过激活 AMP 激活的蛋白激酶 ( AMPK )信号传导可以促进骨肉瘤细胞的耐药性,抑制 AMPK 活性时,可以降低缺氧诱导的骨肉瘤对阿霉素的耐药性[7]。因此 PI3K、NF-κB 和 AMPK 基因都是骨肉瘤化疗敏感性的重要基因,抑制这些基因的表达或者抑制基因调控的相关途径可能是改善阿霉素耐药的新方法。
3. 自噬相关基因 ( HMGB1、HMGN5、PTEN ):自噬是溶酶体蛋白水解的一种机制,可以通过分解细胞成分,产生细胞存活所需的代谢物质,从而促进细胞的存活以达到化疗耐药的作用[8]。HMGB1 是晚期炎症的标志物,可持续促进炎症因子的释放,从而不断触发炎症反应,导致细胞损伤或坏死而改变自噬及凋亡水平[9]。先前的研究发现,阿霉素,顺铂和甲氨蝶呤均可上调骨肉瘤细胞 MG-63,Saos-2 和 U2-OS 中 HMGB1 mRNA 的表达,抑制 HMGB1 基因表达时,能够恢复细胞系 MG-63 和 Saos-2的化学敏感性;另一项研究表明,骨肉瘤细胞系的化疗耐药性既依赖于 HMGB1,也依赖于 HMGN5,当激活自噬过程时,可以促进 HMGB1 和 HMGN5 的表达,从而诱导化疗耐药,而抑制自噬过程则可以下调 HMGB1 和 HMGN5的表达,并促进骨肉瘤对化疗敏感[1]。因此,HMGB1 和HMGN5 基因都是与自噬相关的可以影响骨肉瘤化疗敏感性的重要基因,但是具体机制仍不明确,这些基因是否可以用作治疗靶点仍有待研究。但是,最新的研究发现,除了 HMGB1 和 HMGN5 基因之外,与自噬相关的其他基因,比如 PTEN 也已被证明与骨肉瘤阿霉素敏感性相关。PTEN 是一种抑癌基因,可以抑制 PI3K / AKT / mTOR 信号通路,早期的研究发现,PTEN 可以通过促进细胞自噬降低化疗敏感性;最近的研究表明 miR-155 通过抑制 PTEN表达,增强 PI3K / AKT / mTOR 信号通路,从而抑制阿霉素诱导的细胞凋亡和自噬,并降低对阿霉素的敏感性[10]。因此,PTEN-PI3K / AKT / mTOR 信号通路 - 自噬可能是潜在的治疗化疗耐药的途径。
4. 抑制细胞凋亡和细胞周期调控相关基因 ( PHB、rhoA、Bcl-2、STAT3 ):细胞周期停滞通过允许细胞在进入细胞周期之前修复 DNA 损伤来延迟细胞凋亡。因此,凋亡或细胞周期信号转导的改变可能会导致肿瘤细胞对化疗的抵抗[1]。先前的研究表明,PHB ( 一种抗增殖蛋白 )和 rhoA ( 参与凋亡 ) 基因的过度表达将骨肉瘤药物敏感性分别降低至约 52% 和 59%,说明了其在骨肉瘤化学敏感性中的重要性。此外 Bcl-2 也被证明是影响骨肉瘤阿霉素敏感性的重要基因。利用慢病毒介导的 RNA 干扰抑制 Bcl-2会增加对阿霉素的敏感性。因此,Bcl-2 抑制剂可能是治疗骨肉瘤阿霉素耐药的可行方法。Venetoclax 是一种特异性的 Bcl-2 抑制剂,在治疗复发或难治性慢性淋巴细胞性白血病 ( CLL ) 方面具有良好的反应率,且毒性可控[1]。在人骨肉瘤细胞系中将其与阿霉素联合使用来改善耐药也是一种不错的选择。
最近的研究表明,阿帕替尼可通过抑制转录激活因子3 ( STAT3 ) 信号转导,抑制转录因子 Sox2 的表达,从而降低了阿霉素诱导的骨肉瘤化疗耐药性[11]。这暗示了 STAT3在骨肉瘤阿霉素耐药性中的重要作用。另一项研究表明,抑制 STAT3 可以通过增加药物吸收和消除药物外排而增加耐药骨肉瘤细胞对阿霉素的敏感性。该研究还发现 MDR1( 多药耐药蛋白 ) 是 STAT3 的下游靶标[12],MDR1 已被公认为是引起化疗耐药的重要原因,因此,STAT3 / MDR1信号转导轴将是改善化疗耐药的重要靶点。已经证明在体外和体内,STAT3 / MDR1 信号转导轴抑制剂 Raddeanin A 可以明显提高骨肉瘤细胞对阿霉素的敏感性[12]。而另一项研究还发现,淫羊藿苷通过阻断 STAT3 磷酸化,从而抑制 MDR1 和 MRP1 的表达,最终恢复了耐阿霉素骨肉瘤细胞的化疗敏感性[13]。这些研究给阿霉素耐药患者的治疗带来了希望,Raddeanin A、淫羊藿苷等 STAT3 /MDR1 轴抑制剂联合阿霉素治疗骨肉瘤化疗耐药将是未来值得研究的方向 ( 图1 )。

图1 阿霉素耐药相关基因Fig.1 Genes related to doxorubicin resistance
二、顺铂相关基因
1. DNA 损伤修复相关基因 ( FoxM1 ):顺铂是一种细胞毒性药物,通过促进 DNA 的嘌呤形成具有亲核位点的二价化合物,从而导致 DNA 链内交联,引起 DNA 双链断裂,最终诱导细胞的凋亡[14]。因此,顺铂耐药性最常见的原因是 DNA 修复机制的改变。同源重组可以修复 DNA 双链断裂、单链 DNA 缺口、DNA 内部或链间交联[15]。同源重组修复 DNA 的能力增强时可能参与骨肉瘤顺铂耐药机制。已经证明 Rad51 是同源重组修复的关键蛋白,在肿瘤中高表达,参与化疗耐药[16]。在骨肉瘤中,朱霞等[17]发现,抑制 FoxM1 可以通过下调 Rad51 表达从而增加骨肉瘤细胞对化疗的敏感性。并且应用 FoxM1 特异性抑制剂Thiostrepton ( 硫链丝菌肽 ) 处理骨肉瘤的耐药细胞系时发现耐药细胞增殖明显下降。因此,FoxM1 / Rad51 可能是一个潜在的改善顺铂耐药的治疗靶点。
2. 细胞内药物修饰相关基因 ( GSTP1 ):药物进入细胞后保持活性是至关重要的,这样才能在靶细胞中发挥作用。谷胱甘肽 -S- 转移酶 ( GSTs ) 是一个 Ⅱ 期解毒酶家族,可以催化谷胱甘肽 ( GSH ) 与多种可进入细胞的化合物结合,导致其失活,从而达到解毒作用。已经发现GSTP1 与很多癌症的化疗耐药性有关,在人类骨肉瘤细胞中,GSTP1 过表达会导致肿瘤细胞对阿霉素和顺铂的耐药性增加;而 GSTP1 的抑制剂 NBDHEX 已经发现可以增加骨肉瘤耐药细胞对顺铂的敏感性,从而与顺铂发挥协同的抗肿瘤作用[1]。因此,GSTP1 抑制剂可能成为改善顺铂耐药的靶向药。
3. 癌基因 ( CCN2 ):癌基因或抑癌基因是影响细胞增殖和凋亡的重要基因,并在化疗耐药中扮演重要角色。早期研究发现 CCN2 可能是人类骨肉瘤对顺铂耐药的关键癌基因。在人类骨肉瘤细胞中,CCN2 通过 Bcl-xL 和 survivin的上调抑制顺铂诱导的细胞凋亡和促进肿瘤细胞存活从而增强了患者对顺铂的耐药性[18],而 Bcl-xL 和 survivin 也已经被证明可以通过抑制细胞凋亡来减弱骨肉瘤的化疗敏感性[19-20]。这揭示了 CCN2 在骨肉瘤化疗耐药中的重要作用,Bcl-xL 和 survivin 可能是其促进耐药的最终靶点。但是,最新的一项研究发现,CCN2 同时可以通过影响转运蛋白 ABCG2 促进骨肉瘤耐药。CCN2 通过下调 miRNA-519d 来增加 ABCG2 表达并促进骨肉瘤耐药性[21],而ABCG2 已被发现有助于骨肉瘤的多药耐药性[1]。这从另一个角度解释了 CCN2 导致的耐药,未来可能还会发现其他影响耐药的途径,但不管怎样,CCN2 都是影响化疗敏感性的重要基因。
4. 抑癌基因 ( PTEN、PPARγ ):上文提到很多癌基因参与骨肉瘤对顺铂耐药,同样,抑癌基因也是影响骨肉瘤顺铂敏感性的重要基因,比如 PTEN、PPARγ。Mxd1 是Myc / Max / Mxd 家族的成员,被证明参与低氧环境下的耐药性发展。低氧诱导的 Mxd1 通过直接抑制 PTEN,从而激活 PI3K / AKT 的抗凋亡和生存途径,促进骨肉瘤细胞对顺铂的抵抗[22]。因此 Mxd1-PTEN-PI3K / AKT 轴可能治疗骨肉瘤顺铂耐药的潜在靶点。此外,最新的研究报道,PPARγ 激动剂吡格列酮不仅可以克服骨肉瘤患者原位异种移植 ( PDOX ) 模型中的阿霉素抗性,同时还可以克服顺铂耐药的骨肉瘤 PDOX 模型。PPARγ 激动剂吡格列酮与顺铂联用时,与单独使用顺铂治疗的骨肉瘤 PDOX 模型相比,可以明显抑制肿瘤细胞生长,促进肿瘤细胞凋亡[23]。这给那些既耐阿霉素,又耐顺铂的患者带来了希望,PPARγ 激动剂不仅可以与阿霉素,同时还能与顺铂发挥协同抗肿瘤作用,未来能否与骨肉瘤化疗药联合使用以增加骨肉瘤化疗敏感性值得进一步的研究。
5. 自噬相关基因 ( beclin1、ATG4B ):beclin1 和ATG4B 基因都是自噬基因,早期的研究发现通过抑制beclin1 基因的表达,导致自噬的抑制,从而增加了骨肉瘤细胞对顺铂的敏感性[24]。最近的研究表明 ATG4B 的过表达促进顺铂诱导的自噬并抑制细胞凋亡,从而增强骨肉瘤细胞系中的顺铂耐药性[25]。因此,自噬相关基因除了参与前文所讲的阿霉素敏感性之外,也参与顺铂敏感性。抑制与自噬相关的基因表达可能是改善骨肉瘤阿霉素和顺铂耐药的不错选择 ( 图2 )。
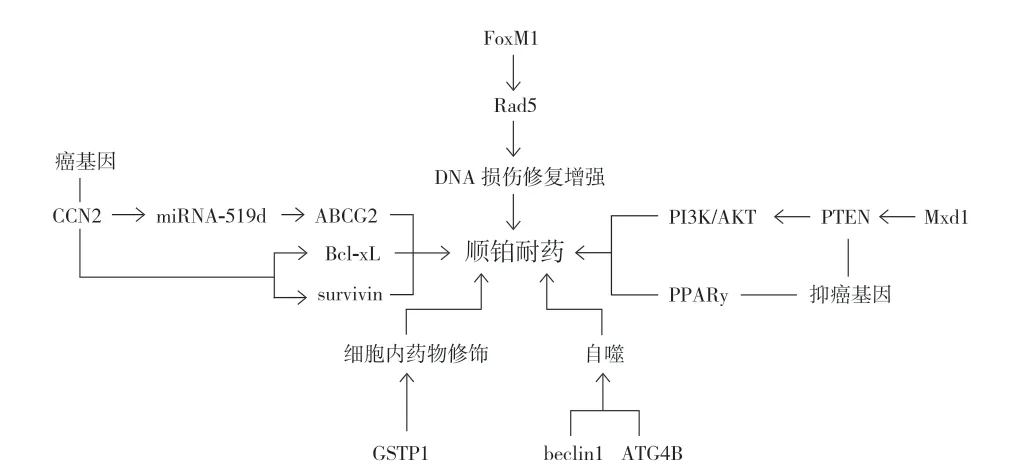
图2 顺铂耐药相关基因Fig.2 Genes related to cisplatin resistance
三、甲氨蝶呤相关基因
1. 药物转运相关基因 ( RFC、FOLT ):甲氨蝶呤是二氢叶酸还原酶 ( DHFR ) 的抑制剂,与叶酸结构相似,通过抑制二氢叶酸还原成有生理活性的四氢叶酸,从而使嘌呤核苷酸和嘧啶核苷酸的生物合成过程中一碳基团的转移作用受阻,导致 DNA 的生物合成受到抑制[26]。甲氨蝶呤的运输受损是骨肉瘤细胞耐药的常见机制,还原性叶酸载体 ( RFC ) 是介导甲氨蝶呤 ( MTX ) 转运至细胞内的重要物质,在骨肉瘤细胞中,当 RFC 出现功能障碍或者表达下降时,都导致了 MTX 耐药的产生[1]。因此,RFC 活性将是影响骨肉瘤对甲氨蝶呤敏感性的重要因素,激活 RFC 基因的过表达可能是提高甲氨蝶呤敏感性的有效手段之一。
FOLT 基因是一种叶酸转运基因,先前的研究表明,当 FOLT 活性增强时可以明显促进 MTX 转运至细胞内,从而提高 MTX 的细胞毒作用[27]。最近的研究进一步证明了在骨肉瘤细胞中,FOLT 的下调表达是引起骨肉瘤 MTX耐药的重要因素之一[28]。因此 FOLT 基因也是改善骨肉瘤MTX 敏感性的重要基因 ( 图3 )。
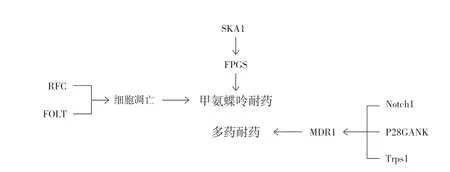
图3 甲氨蝶呤与多药耐药相关基因Fig.3 Genes related to methotrexate and multidrug resistance
2. FPGS 基因:叶酰聚谷氨酸合酶 ( FPGS ) 是 MTX 和叶酸相互作用的关键酶,催化 MTX 形成具有活性的甲氨蝶呤多聚谷氨酸复合物 ( MTX-PG ),从而发挥 MTX 的细胞毒作用[29]。因此 FPGS 活性的改变可能是影响肿瘤对MTX 敏感性的重要因素,一项最新的研究支持了这一观点。该研究发现在骨肉瘤细胞系中,纺锤体和动粒关联蛋白-1 ( SKA1 ) 的过表达通过与 RNA 聚合酶 Ⅱ 亚单位 RPB3的相互作用导致了 FPGS 下调,从而导致了甲氨蝶呤的耐药性,而抑制 SKA1 的表达能够恢复药物敏感性[30]。
四、多药耐药相关基因
1. MDR 基因 ( MDR1 ):MDR 蛋白也叫多药耐药相关蛋白,MDR 蛋白通过将细胞内的化疗药物转运至细胞外,使细胞内药物浓度降低,从而导致多药耐药的发生[31]。此外,MDR 蛋白还可以通过增加促凋亡蛋白的活性,间接抑制化疗药物所致的细胞凋亡[32]。MDR1 也被称为 P 糖蛋白 ( P-gp ) 或者 ABCB1 蛋白,是最先发现的 MDR蛋白,作为一种依赖 ATP 的膜转运体,可以直接将药物从细胞内转运至细胞外,使细胞内药物浓度降低,导致耐药性的产生[33]。研究表明 P-gp 的过表达与骨肉瘤产生多药耐药密切相关[34],此外很多基因还可以通过调节 MDR1基因的表达间接导致骨肉瘤多药耐药的产生,这些基因包括 Notch1、P28GANK、Trps1 等[35-37]。因此抑制 MDR1 的表达将是改善骨肉瘤多药耐药的关键措施。近年来,已经开始研究通过下调或抑制 MDR1 基因的表达来改善骨肉瘤化疗敏感性的靶向药物,比如吡格列酮、粉防己碱以及碱性磷酸酶抑制剂 NVP-TAE684 等[38-40],这些研究均取得了不错的效果。相信在未来通过大量临床药物试验的验证,这些可以下调 MDR 蛋白表达的药物将会是治疗骨肉瘤多药耐药的重要手段。
五、小结与展望
本文从基因角度阐述了与骨肉瘤化疗敏感性相关的重要基因,并进一步分析这些基因影响化疗敏感性的机制,除了已经被广泛认可的常见机制,比如 DNA 损伤修复增强,自噬激活,膜转运功能障碍,多药耐药蛋白的表达等之外,最新的研究还发现,低氧诱导的化疗耐药以及与细胞凋亡和细胞周期调控相关的基因也与化疗敏感性相关。激活或抑制这些化疗敏感性相关基因的靶向药已显示出可以促进相关化疗药物的细胞毒作用,比如通过下调或抑制 MDR1 基因的表达来改善骨肉瘤化疗敏感性的靶向药物吡格列酮、粉防己碱以及碱性磷酸酶抑制剂 NVP-TAE684等。有的药物甚至已经被批准用于临床治疗,比如 PARP1抑制剂奥拉帕利目前已被国家药品监督管理局 ( CFDA ) 正式批准用于治疗铂敏感复发性卵巢癌维持治疗。因此,针对这些化疗敏感性相关基因影响化疗耐药的机制研发出有效的可以增加骨肉瘤化疗敏感性的靶向药,联合传统化疗药物进行治疗可能是未来进一步提高骨肉瘤患者生存率的一种有效措施,这有望使我们打破骨肉瘤治疗长达近四十年的停滞状态。
