急性脑损伤患者血清Tau,HMGB1水平检测在判断并发认知功能障碍风险的应用价值
2021-10-16陶红莉鲁晓波孙帼英
陶红莉,鲁晓波,吴 怡,孙帼英,黄 刚,宋 雷
(1.咸阳市中心医院精神心理科,陕西咸阳 712000;2.宝鸡市康复医院心身科,陕西宝鸡 721001)
急性脑损伤(acute brain injury,ABI)病情危重,进展迅速,病死率高[1]。近年来,随着脑多极检测仪在临床的应用和治疗药物的改进,ABI 病死率有所降低,但报道显示ABI 后认知功能障碍成为影响患者生活质量的重要因素[2]。因而如何对ABI后认知障碍进行早期预测逐渐引起临床重视。血清Tau 蛋白属微管相关蛋白中含量最高的蛋白组分,既往报道显示血清Tau 有助于缺血性脑卒中患者痴呆的早期筛查[3-4]。而高迁移率组蛋白B1(mobility group box-1 protein,HMGB1)属促炎因子,陈锐等[5]发现HMGB1 参与ABI 炎性反应,并通过影响Toll样受体,参与ABI 后认知功能障碍的发生。因而,本研究通过随访观察168 例ABI 患者临床资料,探讨血清Tau 与血清HMGB1 联合检测的应用价值。报道如下。
1 材料与方法
1.1 研究对象 收集2018年4月~2020年4月咸阳市中心医院收治的ABI 患者168 例,其中男性92 例,女性76 例;年龄18~70 岁,平均年龄47.12±11.54 岁;体重指数20.67±1.95kg/m2;文化程度:本科及以上36 例,高中84 例,高中以下48 例;病情程度:轻度116 例,中度52 例。168 例患者中,MoCA 评分<26 分者36 例,为观察组;MoCA 评分≥26 分者132 例为对照组。
纳入标准:①患者均经CT 检查,可见脑水肿、蛛网膜下腔出血、脑梗死或脑挫裂伤征象;②患者发病至入院时间≤24h;③格拉斯哥昏迷评分量表(glasgow coma scale,GCS)评分≥9 分[6];④患者或家属均知悉研究内容,并签署知情同意书。
排除标准:①并发有心肺严重基础疾病者;②既往有脑外伤或精神意识障碍病史者;③患者语言理解能力差或有痴呆病史。
剔除标准:①随访失访病例;②因ABI 死亡或意外死亡病例;③随访期间主动要求退出研究者。
1.2 仪器与试剂 Avanti JXN-30/26 智能型高效离心机,Thermo Multiskan Sky 全波长酶标仪。血清Tau 试剂盒(上海雅吉生物科技有限公司),血清HMGB1 试剂盒(上海科顺生物科技有限公司)。
1.3 方法 在患者入院病情稳定后,清晨空腹采集肘静脉血5ml,高速离心10min 后取上清液,送检。采用酶联免疫吸附法检测血清Tau 和血清HMGB1水平,操作按试剂盒说明书进行。分别以标准品浓度和光密度值为横纵坐标绘制标准曲线,计算血清Tau 和血清HMGB1 表达水平。
随访:在患者出院后进入随访,每4 周电话联系1 次,在出院后半年时采用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)对患者认知功能水平进行调查,以MoCA 评分<26 分为有认知功能障碍[7]。
1.4 统计学分析 选用SPSS 22.0 软件包对数据进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较行t检验,影响因素采用Logistic 分析,以受试者工作曲线(receiver operating characteristic,ROC)分析预测价值,以曲线下面积(area under curve,AUC)>0.75 为预测价值高,P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清Tau 和血清HMGB1 比较 观察组血清Tau 为347.84±75.51pg/ml,对照组为298.67±80.16pg/ml,两组比较,差异有统计学意义(t=3.30,P<0.01)。观察组血清HMGB1 为6.79±2.29μg/L,对照组为4.96±1.08μg/L,两组比较差异有统计学意义(t= 6.84,P<0.01)。以血清Tau 和血清HMGB1 为检验变量,以是否发生认知功能障碍为状态变量,绘制ROC,见图1,结果显示血清Tau 判断认知功能障碍的AUC 为0.73(SE=0.07,95%CI=0.59~0.87),截断值为345.50pg/ml。血清HMGB1 判断认知障碍的AUC 为0.74(SE=0.08,95%CI=0.59~0.90),截断值为5.45μg/L。
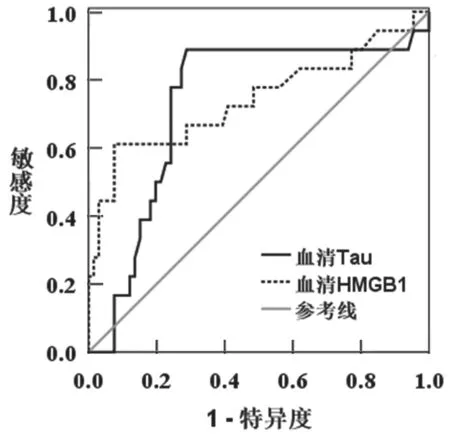
图1 血清Tau 和血清HMGB1 判断认知障碍的ROC 分析结果
2.2 不同血清Tau 和血清HMGB1 水平患者病理特征指标比较 见表1。不同血清Tau 和血清HMGB1水平患者文化程度、脑损伤程度、MoCA 评分及蛛网膜下腔出血、脑挫裂伤CT 征象情况比较,差异均有统计学意义(χ2=30.07,34.30,20.68,7.37,13.87;29.47,18.22,15.71,50.60,6.74;均P< 0.05)。
表1 不同血清Tau 和血清HMGB1 水平患者病理特征指标比较[n(%),±s]
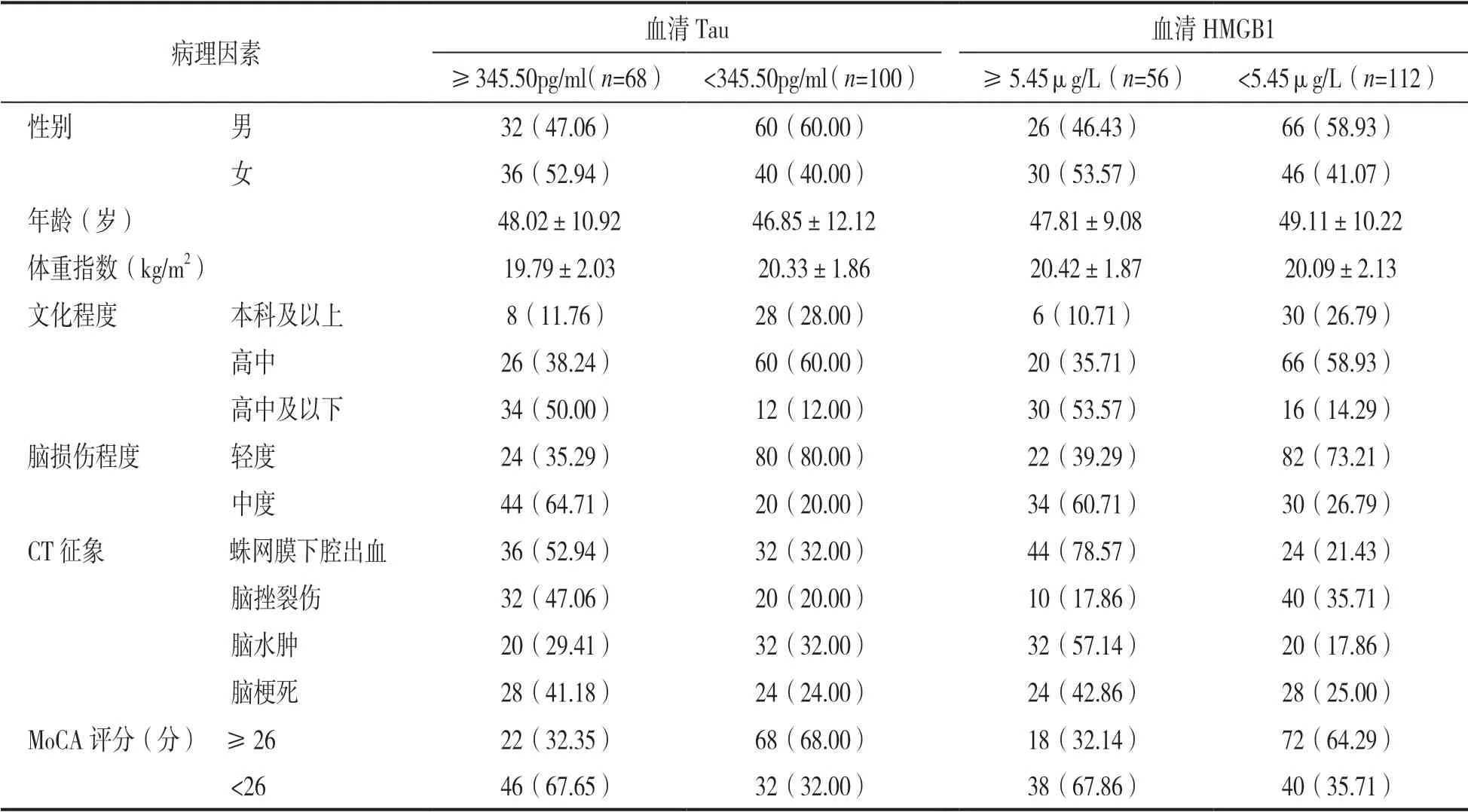
表1 不同血清Tau 和血清HMGB1 水平患者病理特征指标比较[n(%),±s]
病理因素血清Tau血清HMGB1≥345.50pg/ml(n=68) <345.50pg/ml(n=100)≥5.45μg/L(n=56)<5.45μg/L(n=112)性别 男32(47.06)60(60.00)26(46.43)66(58.93)女36(52.94)40(40.00)30(53.57)46(41.07)年龄(岁)48.02±10.9246.85±12.1247.81±9.0849.11±10.22体重指数(kg/m2)19.79±2.0320.33±1.8620.42±1.8720.09±2.13文化程度 本科及以上8(11.76)28(28.00)6(10.71)30(26.79)高中26(38.24)60(60.00)20(35.71)66(58.93)高中及以下34(50.00)12(12.00)30(53.57)16(14.29)脑损伤程度 轻度24(35.29)80(80.00)22(39.29)82(73.21)中度44(64.71)20(20.00)34(60.71)30(26.79)CT 征象 蛛网膜下腔出血36(52.94)32(32.00)44(78.57)24(21.43)脑挫裂伤32(47.06)20(20.00)10(17.86)40(35.71)脑水肿20(29.41)32(32.00)32(57.14)20(17.86)脑梗死28(41.18)24(24.00)24(42.86)28(25.00)MoCA 评分(分) ≥2622(32.35)68(68.00)18(32.14)72(64.29)<2646(67.65)32(32.00)38(67.86)40(35.71)
2.3 ABI 并发认知功能障碍的危险因素分析 见表2。Logistic 多因素分析结果显示,文化程度、脑损伤程度、脑挫裂伤、血清Tau 及血清HMGB1 是ABI 后认知功能障碍的独立影响因素(P<0.05)。
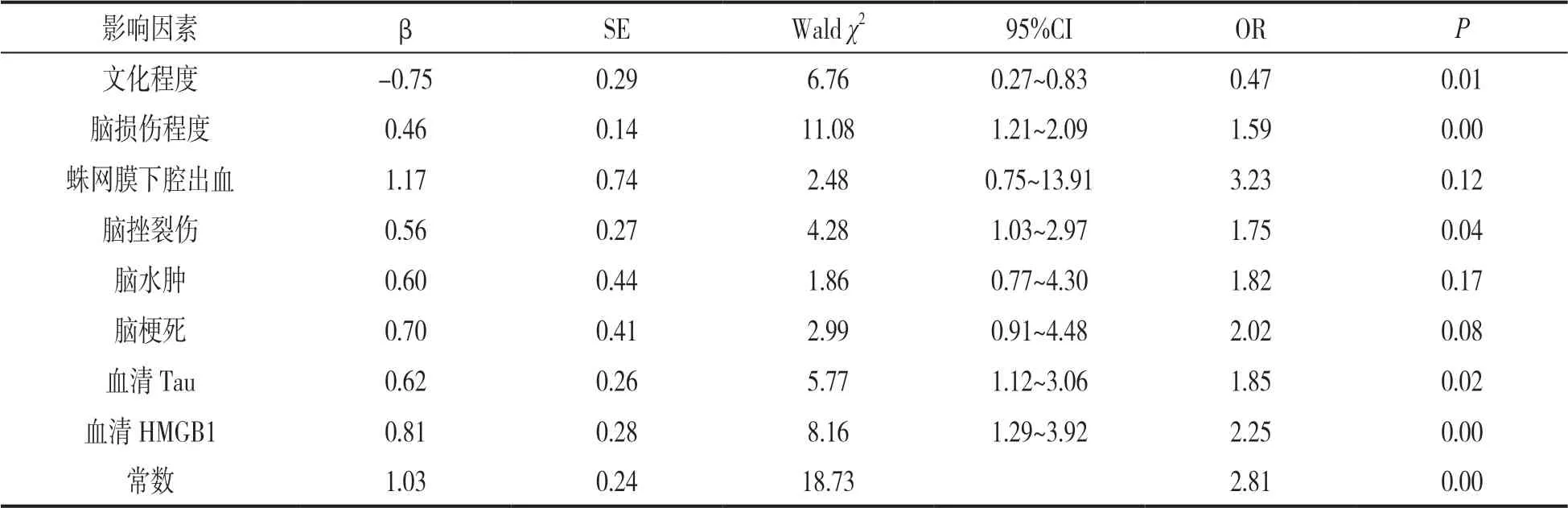
表2 ABI 并发认知功能障碍的危险因素分析
2.4 两种预测模型判断ABI 后并发认知功能障碍的ROC 分析结果 见表3。基于Logistic 多因素分析结果建立预测模型,Y1=1.03-0.75X1+0.46X2+0.56X3+0.62X4+0.81X5(X1= 文化程度,X2= 脑损伤程度,X3=脑挫裂伤,X4=血清Tau,X5=血清HMGB1)。Y2=1.03+0.62X4+0.81X5。对影响因素赋值,绘制Y1与Y2预测模型判断ABI 后认知功能障碍的ROC(图2),Y1与Y2预测模型判断ABI 患者并发认知障碍的AUC 比较,差异无统计学意义(Z= -0.16,P=0.56)。
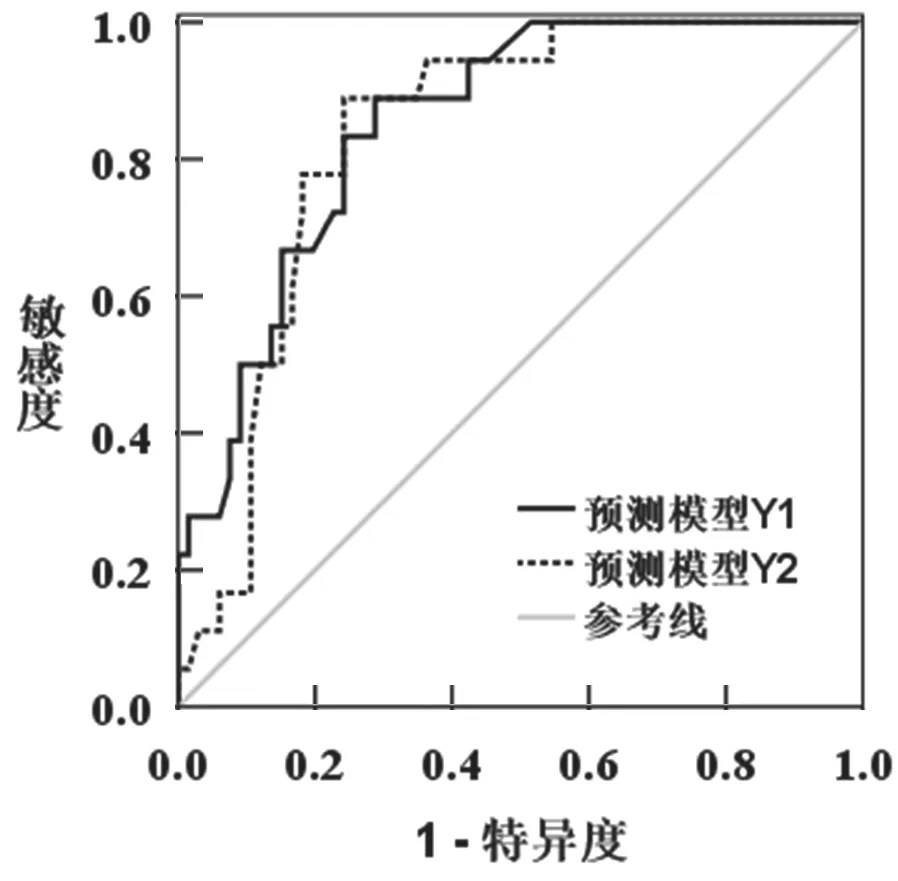
图2 两种预测模型判断ABI 后并发认知功能障碍的ROC 分析
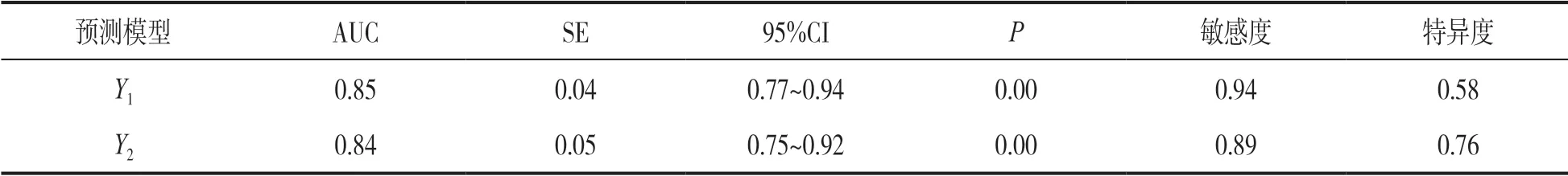
表3 两种预测模型判断ABI 后并发认知功能障碍的ROC 分析结果
3 讨论
ABI 后认知功能障碍指患者执行力、注意力、逻辑推理能力及语言表达能力等功能的异常降低。ABI 后认知功能障碍的发生导致患者工作学习能力降低,严重影响患者生活质量,认知功能已成为评估ABI 后康复效果的主要标准[8]。目前临床多认为ABI 发生后与阿尔茨海默病(Alzheimer's disease,AD)相关特征性蛋白在脑组织的沉积是认知障碍的重要原因[9-10]。淀粉样蛋白(myloid-β peptide,Aβ)能直接损害神经元和胶质细胞,造成认知功能降低。张晨鹏等[11]实验显示Aβ 在脑血管壁的沉积可促进微血管病变,成为认知障碍的诱因。Tau 是与AD相关的特征性蛋白,存在于神经元轴突内,Tau 通过与细胞膜微管蛋白结合,在维持微血管稳定性和诱导微血管成束中发挥重要作用。研究还发现Tau蛋白磷酸化可直接破坏轴浆运输功能,引起脑神经元死亡[12]。ABI 发生后,血脑屏障被破坏,Tau 被降解释放入血,造成血清Tau 的持续升高。另外,Tau 也是调节神经细胞轴突内物质转运和信号传导的关键蛋白[13],而ABI 后轴突损伤则是患者发生认知障碍的原因之一,Tau 水平异常可能通过影响轴突内微观孔的通透性,进而造成轴突肿胀等病理改变[14],成为认知功能障碍的诱因。因而,Tau 有望成为评估ABI 后认知障碍重要的血清标记物。
虽然有关ABI 后认知功能障碍的机制尚未完全阐明,但炎症和氧化应激与ABI 后认知功能障碍的关系已成为临床共识[15]。HMGB1 属非组蛋白染色体结合蛋白,既往报道发现HMGB1 可介导TLR2等信号通路,并诱导激活转录因子κ 基因结合核因子,参与脑损伤病理进展和认知障碍的发生[16]。王新军等[17]则认为抑制HMGB1 表达,有助于减轻炎性反应,改善认知功能。本研究也发现观察组血清HMGB1 水平显著高于对照组,ABI 发生后,机体启动防御机制,HMGB1 被大量分泌,促进白介素-1、白介素-6 及肿瘤坏死因子-ɑ 等炎性因子分泌,加重氧化应激,使炎症反应进一步加重,进而损害神经功能[18],导致认知障碍的发生。
本研究显示不同血清Tau 和血清HMGB1 水平患者脑损伤程度、MoCA 评分及蛛网膜下腔出血、脑挫裂伤CT 征象发生率差异有统计学意义,提示血清Tau,血清HMGB1 与脑损伤病理进程和认知功能相关。Logistic 多因素分析结果也证实血清Tau和血清HMGB1是ABI后认知障碍的独立危险因素。这再次证实血清Tau 和血清HMGB1 与ABI 后认知障碍的密切关系。为此,本研究建立预测模型,结果显示基于血清Tau 和血清HMGB1 两项的模型与联合CT 征象与文化程度后的模型判断ABI 后并发认知障碍风险的AUC 均超过0.80,且二者差异无统计学意义,提示血清Tau 与血清HMGB1 联合检测判断认知障碍风险可获得联合CT 征象和文化程度后建立的预测模型相近的准确性,这说明动态监测血清Tau 与血清HMGB1,可量化评估ABI 后认知功能障碍风险,这对于指导临床、进行早期干预具有重要意义。但本研究样本量小,结论还有待今后进一步研究证实。
综上,血清Tau 与血清HMGB1 联合检测有助于ABI 后认知功能障碍的早期筛查,具有较高临床应用价值。
