支气管哮喘患者血清MicroRNA-145水平表达与肺功能、气道重塑及Th1/Th2平衡的关系分析
2021-10-16任炳臣韩晓庆王永红赵京梅王海静何洪英
李 颖,任炳臣,韩晓庆,王永红,赵京梅,李 静,王海静,肖 宁,何洪英
(1.邯郸市中心医院 呼吸内科一病区, 河北邯郸 056001;2 邯郸市第一医院院前急救,河北邯郸 056002;3.河北省华北理工大学附属医院呼吸内科, 河北唐山 063000)
支气管哮喘(bronchial asthma,BA)的发生机制比较复杂,临床认为是免疫因素、炎症介质等相互作用所致的结果,而辅助性T 细胞1/辅助性T 细胞2(helper T cell 1/helper T cell 2,Th1/Th2)失衡与炎症介质密切相关[1]。Th1 细胞能够分泌干扰素-γ(interferon-γ,IFN-γ)、白介素-2(interleukin-2,IL-2)等因子,促使巨噬细胞活化,对机体免疫、炎症有调节作用,Th2 细胞能够分泌白介素-4(interleukin-4,IL-4),白介素-13(Interleukin-13,IL-13)等因子,具有促炎作用[2]。通常Th1 和Th2 细胞处于平衡状态,一旦二者失衡,易引起气道炎症疾病,以BA 最常见[3]。气道重塑在哮喘中呈进行性发展,可加重气道壁形态异常,致病情进展为重度哮喘,随着哮喘程度加重,对肺功能的影响也越大[4]。既往对这类患者给予激素治疗,但部分病人治疗无效[5],因此临床需寻求可靠调控因子,明确新的干预靶点。近年来,有学者发现微小核糖核酸-145(micro ribonucleic acid-145,microRNA-145,简称miR-145)基因可能参与了肺损害气道高反应的病变过程,与慢性阻塞性肺疾病有关[6]。而该病和哮喘有诸多相似之处,因此miR-145 可能也参与了哮喘进展过程,但目前哮喘患者miR-145 的表达水平及其在哮喘发生发展中的作用机制尚不清楚,临床仍需大量研究对此予以论证,鉴于此,本研究拟探讨BA 患者血清miR-145 表达水平与肺功能、气道重塑、Th1/Th2 的关系。
1 材料与方法
1.1 研究对象 纳入邯郸市中心医院2018年7月~2020年7月收治的BA 患者90 例作为BA 组,另选取同期于邯郸市中心医院体检的62 例健康志愿者作为健康组。研究方案获得邯郸市中心医院伦理委员会批准。纳入标准:①BA 组:满足中华医学会呼吸病学分会哮喘学组制定的《支气管哮喘防治指南(2016年版)》中的相关标准[7],年龄≥18岁;急性发作期病例;初诊病例;能配合完成相关检查;精神状态、认知功能正常;知情同意。②健康组:性别、年龄等基线资料与BA 组匹配;身体健康状况良好;能配合完成相关检查;精神状态、认知功能正常;知情同意。排除标准:因肺炎、肺间质性疾病等其他因素所致的喘息、咳嗽等症状者;自身免疫性疾病者;恶性肿瘤者;入院前三个月内有激素药物、解痉平喘治疗史者;肝、肾、心等脏器严重受损者;危重症者。BA 组男性47 例,女性43 例,年龄23~45 岁,平均年龄33.94±8.75 岁;并发过敏性鼻炎4 例;并发过敏史3 例;体质量指数18~24kg/m²,平均年龄22.15±1.41kg/m²;并发吸烟史16 例;并发饮酒史18 例;并发家族遗传史15 例。健康组男性34 例,女性28 例,年龄22~48岁,平均年龄31.65±9.02 岁;并发过敏性鼻炎1例;并发过敏史1 例;体质量指数18~24kg/m²,平均22.89±1.64kg/m²;并发吸烟史10 例;并发饮酒史13 例;并发家族遗传史9 例。两组基线资料比较,差异无统计学意义(P>0.05)。
1.2 仪器与试剂 主要仪器为高速离心机(山东博科集团,TG-16W),恒温箱(北京福意电器,FYL-YS-430L), 荧光PCR 板(Roche 罗氏,4729692001 96 孔板),电泳仪(济南来宝医疗器械,DYY-6D),紫外分光光度计(上海屹谱仪器制造有限公司,U-T6A)。主要试剂为Trizol 试剂盒(无锡百泰克生物),琼脂糖(北京中科瑞泰生物)、引物(经上海生物工程设计)。
1.3 方法 受试者在就诊或体检当日,接受相关检查与指标检测。血清miR-145:在受试者空腹状态下,采集肘静脉血3ml,行离心处理,时间为10min,转速3 000r/min,分离血清,存放于-70℃环境待测。经实时荧光定量-聚合酶链式反应(real-time quantitative reverse transcription polymerase chain reaction,qRT-PCR)检测,利用Trizol 试剂盒提取总RNA,通过琼脂糖凝胶电泳检测RNA 纯度,采用Stem-loop 法行miRNA 逆转录合成cDNA,将该反应液经qRT-PCR 法予以检测,扩增反应条件为95℃预变性10min,95℃变性10s、50℃退火50s、72℃延伸30s,共40 个循环,以U6作为内参引物。引物序列:(1)miR-145:正向引物为5’-CCTCACGGTCCAGTTTTCCC-3’,反向引物为5’-GCAAATCCAGCTGTGAAACCA-3’;(2)U6:正向引物为5’-CTCGCTTCGGCAGCACA-3’,反向引物为5’-AACGCTTCACGAATTTGCGT-3’,引物经上海生物工程设计。待扩增反应完毕,按照每间隔5s 增加1℃的条件,继续加热至99℃,建熔解曲线,经2-△△Ct表示血清miR-145 相对表达量。肺功能检测:利用涵飞医疗(上海)S-980A I 肺功能检测仪测定1 秒用力呼气容积(forced expiratory volume in one second,FEV1),用力肺活量(forced vital capacity,FVC),峰值呼气流速(peak expiratory flow,PEF),最大呼气中期流量(maximal mediate expiratory flow 75/25,MMEF75/25), 并计算FEV1与FVC 的比值,即FEV1/FVC。气道重塑指标:经德国西门子Sensation 64 高分辨率CT 进行测定,选用薄层技术,层间距、层厚均为1.0mm,扫描电压、矩阵分别为120MV,512×512,通过骨建法行重塑,受试者均接受深吸气、深呼气末屏气相扫描,各层面取两个清晰影像行气道测量,各部位取均值作为最终结果,内容包括气道总面积(total airway crosssectional area,Ao)、气道腔面积(area of airway,Ai)、气道外径(external diameter,D),气道内径(lumen diameter,L),从而计算支气管管壁厚度与外径比值(airway wall thickness/External diameter,T/D),气道壁面积占气道总截面积百分比(Percentage of wall area,WA%)。T/D=[(D-L)/2]/D,WA%=(Ao-Ai)/Ao×100%。Th1,Th2,T 细胞亚群[T cell subsets1(Tc1),T cell subsets2(Tc2)]及IFN-γ,IL-4 检测:在受试者空腹下,取4ml 肘静脉血,分装于两管,每管各2ml,一管经美国贝克曼库尔特CytoFLEX 流式细胞仪检测外周血Th1,Th2 细胞以及Tc1,Tc2 细胞,另一管行离心处理,2 500 r/min离心15min,离心半径8cm,取血清存放于低温冰箱待测,经酶联免疫吸附试剂盒(上海仁捷生物)测定血清IFN-γ,IL-4 水平。
1.4 统计学分析 使用SPSS23.0 进行研究资料分析。观测资料中的计量数据,均通过正态性检验,以均数±标准差(±s)描述。两组间的比较,方差齐同为成组t检验,方差不齐同为校正t检验(统计量为t)。计数资料以例数及率描述。两组间比较为卡方检验或校正卡方检验(统计量为χ2)。各指标间的相关分析为Pearson 相关检验。统计推断的检验水准α=0.05。
2 结果
2.1 两组血清miR-145 表达水平及肺功能指标比较 见表1。BA 组血清miR-145 表达水平高于健康组,而FEV1,FVC,PEF,MMEF75/25和FEV1/FVC 均低于健康组,差异均有统计学意义(均P<0.05)。
表1 两组血清miR-145 表达水平及肺功能指标比较(±s)
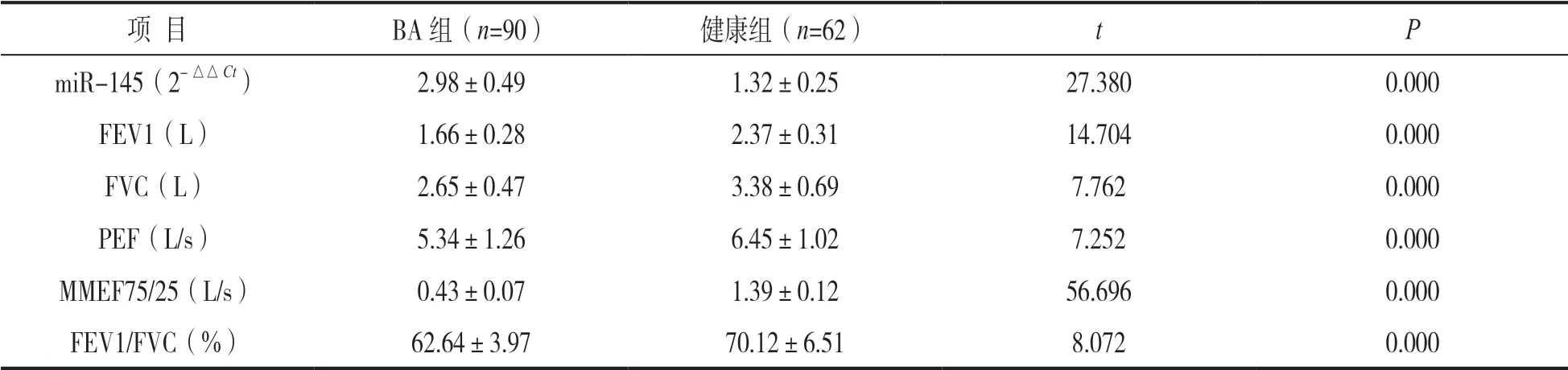
表1 两组血清miR-145 表达水平及肺功能指标比较(±s)
项 目BA 组(n=90)健康组(n=62)tP miR-145(2-△△Ct)2.98±0.491.32±0.2527.3800.000 FEV1(L)1.66±0.282.37±0.3114.7040.000 FVC(L)2.65±0.473.38±0.697.7620.000 PEF(L/s)5.34±1.266.45±1.027.2520.000 MMEF75/25(L/s)0.43±0.071.39±0.1256.6960.000 FEV1/FVC(%)62.64±3.9770.12±6.518.0720.000
2.2 两组气道重塑指标比较 见表2。BA 组D,Ao,T/D,WA%均显著高于健康组,差异有统计学意义(均P<0.05),两组L,Ai 比较差异无统计学意义(均P>0.05)。
表2 两组气道重塑指标比较(±s)
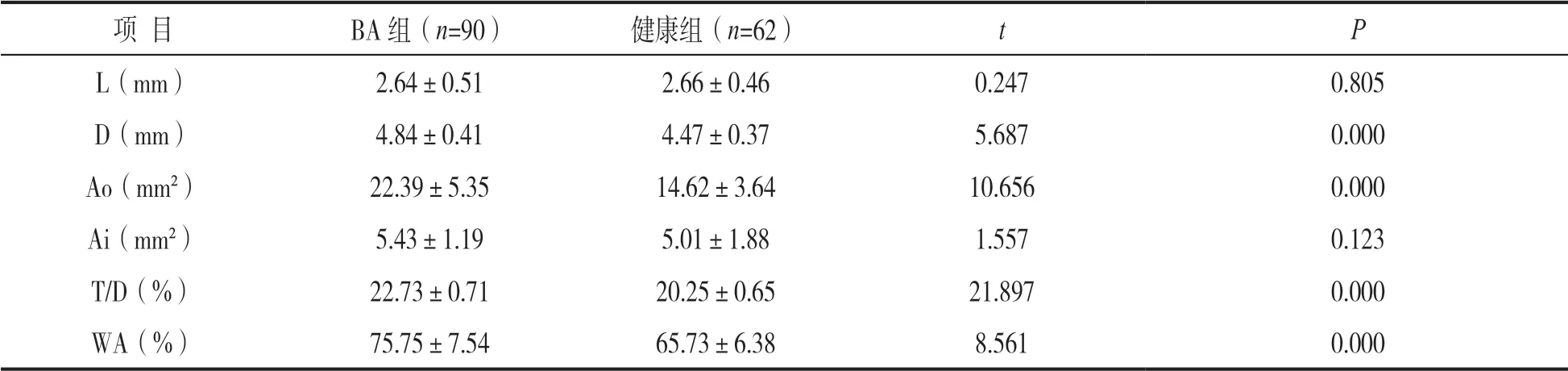
表2 两组气道重塑指标比较(±s)
项 目BA 组(n=90)健康组(n=62)tP L(mm)2.64±0.512.66±0.460.2470.805 D(mm)4.84±0.414.47±0.375.6870.000 Ao(mm²)22.39±5.3514.62±3.6410.6560.000 Ai(mm²)5.43±1.195.01±1.881.5570.123 T/D(%)22.73±0.7120.25±0.6521.8970.000 WA(%)75.75±7.5465.73±6.388.5610.000
2.3 两组Th1,Th2,Tc1,Tc2 细胞及血清IFN-γ,IL-4 比较 见表3。BA 组Th1,Th1/Th2,Tc1,Tc1/Tc2 和IFN-γ 均低于健康组,而Th2,Tc2 和IL-4较健康组显著升高,差异有统计学意义(均P<0.05)。
表3 两组Th1,Th2,Tc1,Tc2 细胞及血清IFN-γ,IL-4 比较(±s)

表3 两组Th1,Th2,Tc1,Tc2 细胞及血清IFN-γ,IL-4 比较(±s)
项 目BA 组(n=90)健康组(n=62)tP Th1(%)0.50±0.110.79±0.1513.0040.000 Th2(%)0.84±0.270.58±0.128.0540.000 Th1/Th20.59±0.081.36±0.3119.1240.000 Tc1(%)14.04±1.7630.61±6.5722.7990.000 Tc2(%)10.06±3.253.48±0.4515.8220.000 Tc1/Tc21.40±0.328.79±2.7625.1940.000 IFN-γ(pg/ml)19.97±4.4533.43±5.5216.5980.000 IL-4(ng/ml)18.41±4.897.31±1.5420.1340.000
2.4 BA 患者血清miR-145 表达水平与肺功能、气道重塑及Th1,Th2,Tc1,Tc2 的相关性 经Pearson 线性相关分析显示,血清miR-145 表达水平与FEV1,FVC,PEF,MMEF75/25,FEV1/FVC,Th1,Th1/Th2,IFN-γ,Tc1 和Tc1/Tc2 呈负相关(r=-0.612,-0.403,-0.490,-0.534,-0.558,-0.537,-0.619,-0.591,-0.711 和-0.619, 均P<0.05), 而其与D,Ao,T/D,WA%,Th2,IL-4 和Tc2 呈正相关(r=0.577,0.556,0.416,0.409,0.542,0.508 和0.624,均P<0.05),血清miR-145与L,Ai无相关性(r=0.305,0.319,均P>0.05)。
3 讨论
BA 是由肥大细胞、中性粒细胞、T 淋巴细胞等多种细胞因子参与的一种呼吸系统疾病,大部分患者既往有哮喘家族史[8]。研究表明在哮喘发病过程中,CD4+T 细胞发挥了重要作用,其受抗原刺激后,可分化Th1 和Th2 细胞亚群,而Th1 和Th2细胞亚群失衡可能参与了哮喘炎症的进展过程[9]。近年来,研究发现BA 发病可能与miRNA 表达有关,其可能通过影响炎症因子释放参与BA 的病理改变[10]。哮喘患者伴有明显的气道病理改变,具体表现为气道上皮增厚、支气管腺体肥大、气道平滑肌细胞增殖等,能引起气道高反应[11]。研究认为miRNA-145 与气道高反应性发生有关,但作用机制不明确[12]。鉴于此,临床可考虑观察BA 患者血清miR-145 表达水平变化,以便进一步了解病情,提出针对性治疗方案。
本结果显示BA 患者的血清miR-145 表达水平增高。炎症反应促进了BA 进展,例如IL-4,IL-13 等炎症介质大量释放,能通过对B 细胞进行刺激,致抗体免疫球蛋白M 与免疫球蛋白E 生成,加重气道高反应[13]。miR-145 是高度保守的一种miRNA,小鼠实验[14]提示其能调控细胞免疫以及炎症进展,对IL-1,IL-6 等因子有调控作用,表明miR-145 可能通过调控炎症因子水平参与疾病进展,但该研究发现miR-145 对炎症反应有抑制作用,与本次结论相悖。该研究主要探讨miR-145 与动脉粥样硬化的关系,与本研究所讨论的疾病类型不同,提示miR-145 在不同疾病中的表达与作用存在特异性。孙海霞等[15]发现BA 患者的血清miR-145 表达水平较体检者增高,与本次结论吻合。本研究还提示BA 患者存在肺损害。肺损害在哮喘中较常见,在哮喘发作过程中有炎症介质参与,可引起气道高反应,致黏膜充血、气道分泌物增加,削弱气道上皮屏障功能,从而致病菌侵袭肺部,导致肺功能下降,哮喘严重程度与肺损害程度、气道高反应严重度密切相关[16]。因此,临床必须重视对BA 患者进行肺功能检测。
气道重塑是BA 患者的常见表现,本次结果提示BA 患者的D,Ao,T/D 和WA%均增高,表明其存在明显气道重塑。BA 患者的气道重塑主要集中于肌层以及外膜气道壁,可引起形态学、组织学改变,致气道狭窄,且具有不可逆性,尽早发现、评估气道重塑,对改善预后有益。D,Ao,T/D 和WA%是评估气道重塑的常用指标,其中WA%能对气道重构给予直观、准确判断,尤其在判断气道狭窄中敏感度高,哮喘程度越重,则WA%值越高,D,Ao 和T/D 对气道重塑的评估敏感性均较高,能反映气道反应性程度,气道反应性越重,则D,Ao和T/D 值越高[17]。本研究还发现BA 患者的Th1/Th2 和Tc1/Tc2 处于失衡状态。IL-4 是Th2 和Tc2的生成因子,它可促进B 细胞分化、增殖,有效抑制这类细胞的凋亡,还可对嗜酸性粒细胞凋亡进行抑制,致该类细胞数目增多,使炎症机制启动,发挥促炎作用[18]。IFN-γ 则是Th1 和Tc1 的生成因子,它对Th2 和Tc2 释放促炎因子有抑制作用,可抑制炎性浸润[19]。一旦Th1,Tc1 细胞受抑制,Th2,Tc2 细胞过度活跃,则会导致促炎因子大量释放,而抑炎介质的释放减少,促进BA 进展。
血清miR-145 表达水平与FEV1,FVC,PEF,MMEF75/25,FEV1/FVC,Th1,Th1/Th2,IFN-γ,Tc1 和Tc1/Tc2 呈负相关,与D,Ao,T/D,WA%,Th2,IL-4 和Tc2 呈正相关。其中IL-4 过表达能使Th2 细胞直接活化,加重气道高反应与肺损害,而miR-145 能调控IL-4 的表达,其过表达可致炎症程度更重,miR-145 过表达可能通过上调IL-4促进BA 患者的肺损害。蓝英等[20]研究提示哮喘患儿的Runt 相关转录因子3(RUNX3)mRNA 表达水平下降。而另有学者指出,miR-145有促炎作用,Th2 生成的促炎因子能刺激miR-145 表达,且mi-R145 表达能通过靶向调控RUNX3 而调节哮喘病人的Th1/Th2 失衡状态,在miR-145 表达受到抑制后,则可纠正该失衡现象[21]。由此可见,mi-R145 靶向调节RUNX3 可能是参与哮喘病情进展的重要机制。Tc2 有促炎作用,Tc1 有炎症抑制作用,而miR-145与Tc2 作用相似,也具有促炎作用,其可能通过共同作用,参与BA 患者病情进展。
综上所述,BA 患者的血清miR-145 表达水平增高,其过表达对患者肺功能、气道重塑、Th1/Th2 细胞影响较大,可促进Th1/Th2 失衡,临床可通过测定血清miR-145 表达进一步了解BA 患者病情。本研究的局限性为选取样本较少,且未分析不同BA 严重程度患者血清miR-145 水平的变化,未来还需增加样本量,进一步分析BA 严重度与miR-145 的关系,更加深入阐述miR-145 对BA 的影响。
