智力障碍/全面性发育迟缓遗传学诊断策略探讨
2021-10-15周有峰刘光华
周有峰,黄 艳,刘光华
(1.福建省妇幼保健院儿科 福建医科大学附属医院,福建 福州 350001; 2.福建医科大学临床医学部,福建省妇幼保健院儿科,福建 福州 350001)
智力障碍/全面发育迟缓(intellectual disability/global developmental delay, ID/GDD)是儿童时期常见的神经发育障碍,是严重影响儿童健康的致残性疾病。智力障碍这个术语通常应用于≥5岁的儿童[1]。全面发育迟缓专用于<5岁,在≥2个能区(大运动或精细运动、语言、认知、社交和社会适应能力等)没有达到预期的发育标志,且无法接受系统性智力功能评估,包括年龄太小而无法参与标准化测试的儿童[2]。遗传性因素在ID/GDD病因的占比约50%[3]。拷贝数变异(copy number variants, CNVs)是指染色体亚显微结构中微重复和微缺失,与ID/GDD密切关联[4]。约8%智力障碍患儿存在单核苷酸变异(single nucleotide variation ,SNV)[5]。CNV-seq是基于二代测序技术(next generation sequencing, NGS)的全基因组低深度测序方法,可检测>100 kb CNVs,被认为是目前有望取代染色体微阵列(CMA)平台的诊断技术[6-7];全外显子测序(whole exome sequencing, WES)可检测基因内部SNV及小于10 bp的插入和缺失变异,理论上可与CNV-seq互为补充。基于以上理论,本研究根据预先设计的纳入和排除标准,收集患儿资料,探讨联合检测在ID/GDD遗传学诊断中的应用价值。
1 资料与方法
1.1研究对象 收集2016年6月至2019年12月就诊于福建省妇幼保健院门诊不明原因的智力障碍/全面发育迟缓患儿外周血样本65例,男32例、女33例,年龄 3个月至5岁7个月,中位年龄7月。所有对象均签署知情同意书。
1.2选择标准 纳入标准:(1)临床表现为精神发育迟滞,经Gesell婴幼儿发育量表评定DQ<75或韦氏智力量表评定IQ<70,符合美国精神病协会修订的第5版诊断和统计学手册(DSM-V)诊断标准;(2)无明确围生期及生后缺氧、中毒、中枢神经系统感染及颅脑外伤史;(3)无明显的颅脑影像学异常。排除标准:(1)生化、血氨、乳酸、血尿代谢筛查异常,考虑内分泌、遗传代谢性疾病可能;(2)诊断为脆性X染色体综合征。
1.3方法
1.3.1CNVs检测 采集患儿及双亲血样,提取DNA,构建基因组DNA文库并进行全基因组文库质控。采用Illumina NovaSeq 6000测序仪(美国 Illumina 公司),应用CNV-seq检测CNVs,采用2019年美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)CNVs判读推荐共识[8-9],获得阳性CNVs。
1.3.2SNV检测 CNVs阴性患儿(包括可能良性、良性及阴性CNVs结果),采用IDT公司的xGen® Exome Research Panel v1.0捕获探针基础上,设计并合成捕获探针,与基因组DNA文库序列进行液体杂交、DNA片段富集,采用Illumina NovaSeq 6000测序仪行三人家系全外显子测序(trio-WES)。依据2015年ACMG单核苷酸变异的解读指南[10-11]进行的SNV致病性分级和疾病关联判定。
1.4统计学方法 采用SPSS 18.0软件处理,采用χ2检验比较异常表型(包括面容异常、头围异常、器官畸形、癫痫等)差异。P<0.05为差异有统计学意义。
2 结 果
2.1检测结果分析 ID/GDD患儿65例共检出29例阳性结果。22例CNVs阳性,其中致病性CNVs 15例,包括非综合征或数据库未定义的CNVs 2例;可能致病性CNVs 4例;临床意义不明CNVs 3例。43例CNVs阴性样本行trio-WES检出7例与患儿表型关联基因变异,见表1~2。
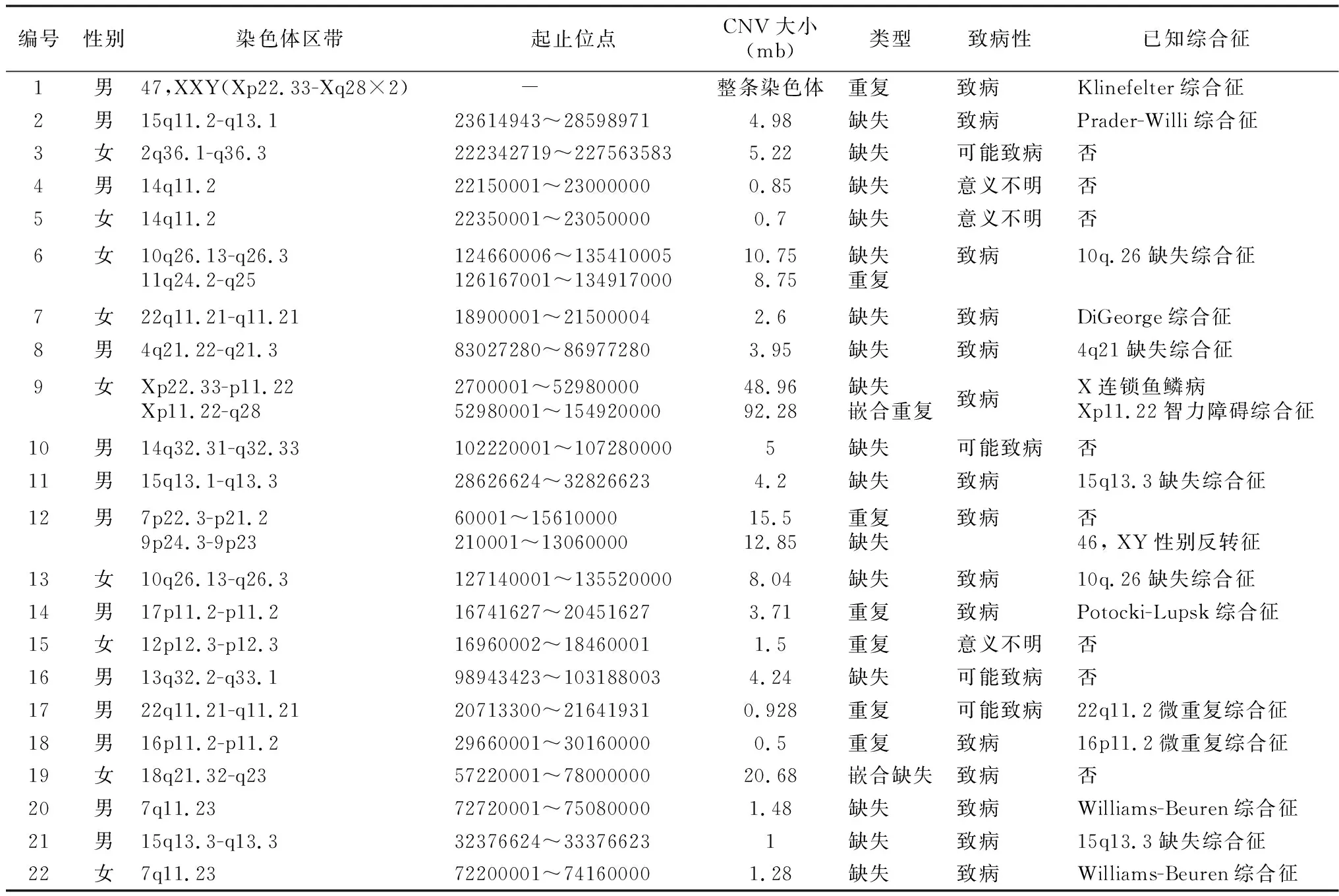
表1 22例阳性拷贝数变异分布特征和致病性
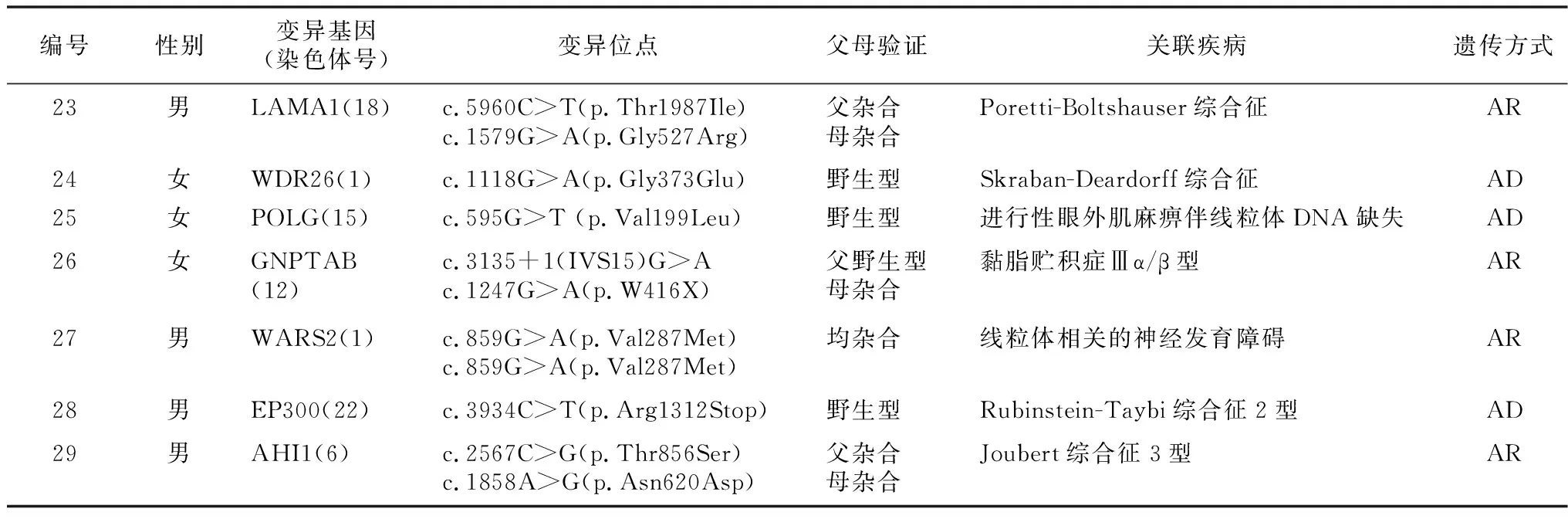
表2 7例家系全外显子组测序阳性变异特征和关联疾病
2.2阳性患儿表型差异分析 CNVs阳性组22例,单纯ID/GDD4例,ID/GDD伴异常表型组18例;SNV阳性组7例,单纯ID/GDD3例,ID/GDD伴异常表型4例。两组患儿异常表型差异无统计学意义(P>0.05),提示临床难以通过表型确定遗传变异类型,见表3。

表3 阳性患儿异常表型分析[例(%)]
2.3单独检测组与联检测组阳性率差异分析 两种方法均阳性22例,单独检测阴性而联合检测阳性7例,两种方法均阴性36例。采用McNemar检验比较两种诊断方法阳性率差异有统计学意义(P<0.05)。提示联合检测较单独检测可提高阳性率, 见表4。

表4 两种检测方法阳性比较(例)
3 讨 论
本研究通过基于NGS的CNV-seq和trio-WES检测技术,发现29例ID/GDD患儿可能的遗传病因,总体阳性率44.6%(29/65),致病性CNVs检出率23.1%。而CMA平台检测CNVs阳性率在15%~20%[12]。检出率较高可能与以下因素相关:CNV-seq检测基于高通量测序,均匀覆盖全基因组,漏检率低,而CMA芯片探针在基因组内密度并不均匀,可能导致漏检。Dong等[13]在186个全血DNA样本中,采用基于二代测序的CNVs检测方法,检测到62个致病CNVs,范围从60.9 kb至41.7 mb,染色体异常检出率达30.1%。在既往核型分析正常的样本中,CNVs检出率可达12.8%。与传统CMA平台比较,CNV-seq分辨率更高,可达50 kb。Gross等[14]研究发现, CNV-seq与CMA平台的检测同样敏感,且可识别染色体嵌合三体。例1为染色体非整倍体重复,提示极端情况下,CNV-seq能检测染色体非整倍体异常,且不需细胞培养,较核型分析有更高的检测效率。未来改进算法后可能检测50 bp至10 kb之间的小拷贝数变异和系统地检测嵌合CNVs。此外,CNV-seq可以通过低至10 ng的基因组DNA来实现准确的CNV诊断,这比基于CMA的诊断所需的最低限度低20倍[15]。以上研究提示基于NGS的CNV-seq技术可以很好的弥补核型分析、CMA平台的局限性,有助于提高检测阳性率。
CNVs与SNV所致临床表型无显著性差异,难以通过临床表型确定变异类型及最佳检测方案。既往诊断流程建议对经代谢筛查、染色体核型分析、脆性X染色体检测、CMA平台检测CNVs阴性的ID/GDD患儿可考虑NGS检测[2]。流程需多次采血,诊断周期长。核型分析需细胞培养,阳性率仅为3%[16],不利于早期诊断和家长依从。如果采用WES作为一线诊断测试,其诊断效能可能超过50%[17]。间隔6~12月后通过原始数据重分析,WES可能再增加约10%的诊断率[18]。采用CNV-seq与trio-WES联合检测方案,弥补了WES对CNVs诊断上的不足,可减少采血次数、缩短检测周期。随测序成本的下降,与CMA比较,采用CNV-seq与trio-WES联合检测方案可在检测费用相似或稍高情况下大幅提高检测阳性率;单台设备检测有效减少投入成本;同时父母验证利于遗传咨询。本研究CNV-seq联合trio-WES检测阳性率较单独CNV-seq检测提升了10.8%。一项荟萃分析认为WES在诊断效能上明显优于CMA,但与全基因组测序在诊断效能上无显著差异[19],考虑到成本因素, CNV-seq和trio-WES联合检测,检测阳性率更高、周期较短、可重分析,可以很好地弥补核型分析、CMA平台的局限,为进一步明确ID/GDD的遗传学病因提供了新的方式,是现阶段值得推广的检测策略。
CNV-seq亦存在不足,如无法检测三倍体及多倍体,无法发现染色体平衡易位和单亲二倍体,对基因组高度重复区域不敏感等[20];WES无法发现内含子区域变异及三核苷酸重复序列异常[21]。目前基于NGS的短读长基因组测序(short-read genome sequencing, srGS)可以检测CNVs、倒位和平衡易位以及更复杂的结构变体和非编码区域,预计将很快成为遗传学检测的新金标准[22]。未来结合基因组学、转录组学、蛋白组学及代谢组学的整体组学策略,将提供更多遗传变异与临床表型关联证据,提高ID/GDD病因诊断率。
