蛴螬多糖的荧光标记研究*
2021-10-14张宇洁张欣蕾
张宇洁,杜 研,张欣蕾
(西安医学院 药学院,陕西 西安 710021)
蛴螬,是金龟子的幼虫,具有破血、行瘀、通乳等多种药理作用, 主治淤痛、痛风、破伤风和喉痹等。蛴螬多糖是其主要活性成分,与植物多糖相比,动物多糖的活性更加突出。现有研究表明, 蛴螬多糖对抑制肿瘤生长有重要的作用[1]。目前,国内对于蛴螬多糖的研究主要在于提纯分离和其抗肿瘤的生物学活性方面[2]。多糖类由于其分子量较大,结构复杂,缺乏发色基团和荧光基团,使其难以检测,给其生物机制及药代动力学的相关研究带来极大困难,无法确切知道其是如何发挥作用的。
本文利用多糖的还原末端与荧光物质8-氨基-1,3,6 奈三磺酸二钠盐(ANTS)进行反应,对蛴螬多糖进行荧光标记,对标记结果进行验证,然后通过单因素实验考察合成过程中的某些参数是否对其有影响,并测定了荧光取代度,实现了荧光检测器检测或追踪多糖,为多糖的生物机制研究及药代动力学的研究提供一定思路。
1 实验部分
1.1 仪器与试剂
BS-100A 自动部分收集器、HL-1B 数显恒流泵(上海沪西分析仪器厂);荧光分光光度F-4600(株式会社日立制作所);Multiskan GO 酶标仪1510(Thermo Fisher Scientific);Agilent cary100 型双波长紫外可见分光光度计、HPLC Agilent 1260InfinityⅡ型、荧光检测器G7121A(Agilent 公司)。
8-氨基-1,3,6 奈三磺酸二钠盐(98%)、氰基硼氢化钠(95%)(Aladdin);Sephadex G-25(生物技术级)(GE healthcare);蛴螬均一多糖(实验室自制)。
1.2 实验方法
1.2.1 ANTS 标记蛴螬多糖的方法 精密称定蛴螬多糖约10mg,溶于1mL 新鲜配制的0.2mol·L-18-氨基-1,3,6 奈三磺酸二钠盐(ANTS)的醋酸水溶液中(pH 值为5.5)。再向体系中加入1mL 新鲜配制的1.0mol·L-1NaBH3CN 的二甲基亚砜(DMSO)溶液,于40℃恒温水浴下密闭,避光反应20h。
将上述反应体系转入洗净的截留分子量为1000 的透析袋中加水透析24h,收集透析液浓缩至1mL,经Sephadex G-25 分离纯化,以蒸馏水为洗脱溶剂,每3mL 洗脱液收集一管。测定各管洗脱液在360nm 下的吸光度(ANTS 的吸收),多糖-苯酚-浓H2SO4(1∶1∶8) 反应后测得各管洗脱液在490nm 下的吸光度(多糖的吸收),收集在两个波长处都有吸收的共有峰洗脱液,浓缩后冻干即得黄色疏松状固体粉末蛴螬多糖-ANTS。
1.2.2 蛴螬多糖标记重要参数的单因素考察 荧光标记蛴螬多糖方法中,我们通过考察蛴螬多糖与ANTS 反应的时间(16、20、24、30h),温度(80、60、40、25℃),反应时介质的pH 值(4.5、5.5、6.5、7.5),ANTS 浓度(0.05、0.1、0.2、0.3mol·L-1),3 个条件不变,只改变一个条件,确定这些因素是否影响荧光物质标记蛴螬多糖的效率。
2 结果与讨论
2.1 蛴螬多糖-ANTS 荧光标记物的鉴定结果
2.1.1 荧光标记物可见-紫外光谱扫描 用紫外-可见分光光度计对多糖进行光谱扫描,扫描波长为200~700nm,蛴螬多糖-ANTS 在360nm 处出现了特征吸收峰,而蛴螬多糖本身在此区间无吸收,可推断蛴螬多糖已经与ANTS 发生了反应。结果见图1。
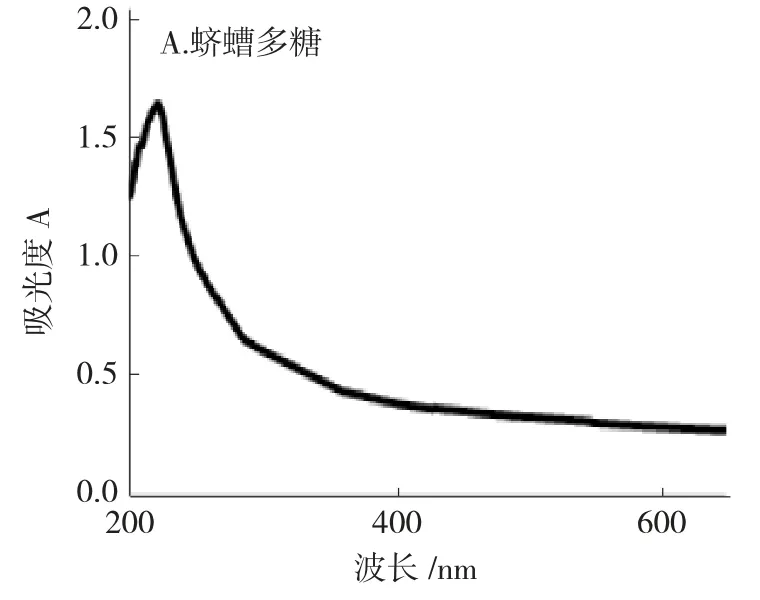
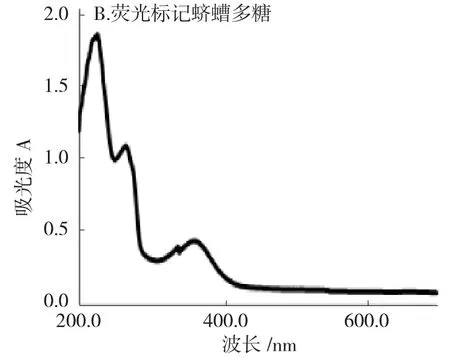
图1 经荧光标记的蛴螬多糖紫外光谱图Fig.1 Ultraviolet spectrum of fluorescently labeled polysaccharide
2.1.2 荧光标记物的荧光光谱扫描 在激发波长200~450nm、发射波长400~650nm 范围内对蛴螬多糖-ANTS 进行扫描,结果显示,蛴螬多糖-ANTS 最大激发波长在360nm 处,最大发射波长在520nm处,可推断ANTS 已经与蛴螬多糖发生了反应。结果见图2。
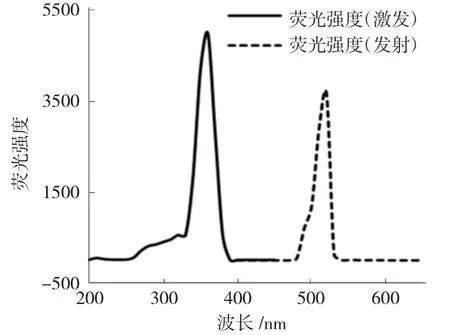
图2 荧光标记物荧光光谱图Fig.2 Fluorescence spectrum of fluorescent markers
2.1.3 荧光标记物的高效液相色谱测定
2.1.3.1 色谱条件
色谱柱 TSK-GEL G4000PWXL(7.8mm×30.0cm,TOSOH)
流动相 0.05mol·L-1Na2SO4水溶液(水为去离子水)
流速 0.4mL·min-1
柱温 25℃
进样量 10μL
检测器 荧光检测器
2.1.3.2 样品检测 分别精密称取蛴螬多糖、ANTS、蛴螬多糖-ANTS 适量,用蒸馏水配成浓度为0.1mg·mL-1的溶液,用高速离心机以12000r·min-1的速率离心15min,取上清液加入样品管中,取10μL 进样,激发波长为360nm、发射波长为520nm 下使用荧光检测器检测,结果见图3。
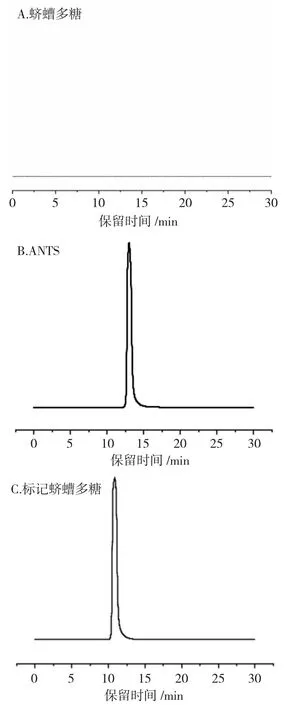
图3 高效液相色谱图Fig.3 HPLC of Polysaccharide
由图3 可知,蛴螬多糖本身检测不到,经ANTS标记后的蛴螬多糖能被检测到,且保留时间较ANTS 缩短,因为标记后的蛴螬多糖分子量变大,所以保留时间缩短,但荧光检测器依然能检测到,由此可得,荧光物质已经成功标记到了多糖上。
2.2 蛴螬多糖标记方法的单因素考察[3]
2.2.1 蛴螬多糖与ANTS 的反应时间考察
由图4A 可知,随着时间的延长,蛴螬多糖与ANTS 反应形成的化合物在360nm 的吸收值逐渐增加,但20h 后趋于平缓,因此,确定反应时间为20h。
2.2.2 蛴螬多糖与ANTS 反应的温度考察
由图4B 可知,随着温度升高,在40℃时,形成的蛴螬多糖-ANTS 合成物在360nm 下吸收值最大,以后逐渐减小。因此,确定反应温度为40℃。
2.2.3 蛴螬多糖与ANTS 反应pH 值考察
由图4C 可知,蛴螬多糖-ANTS 合成物在360nm 下的吸收值在pH 值为5.5 的时候最佳。
2.2.4 蛴螬多糖与ANTS 反应的ANTS 浓度考察
由图4D 可知,ANTS 浓度影响反应过程并不是很明显,为节约成本,加入不影响反应的ANTS 的量。
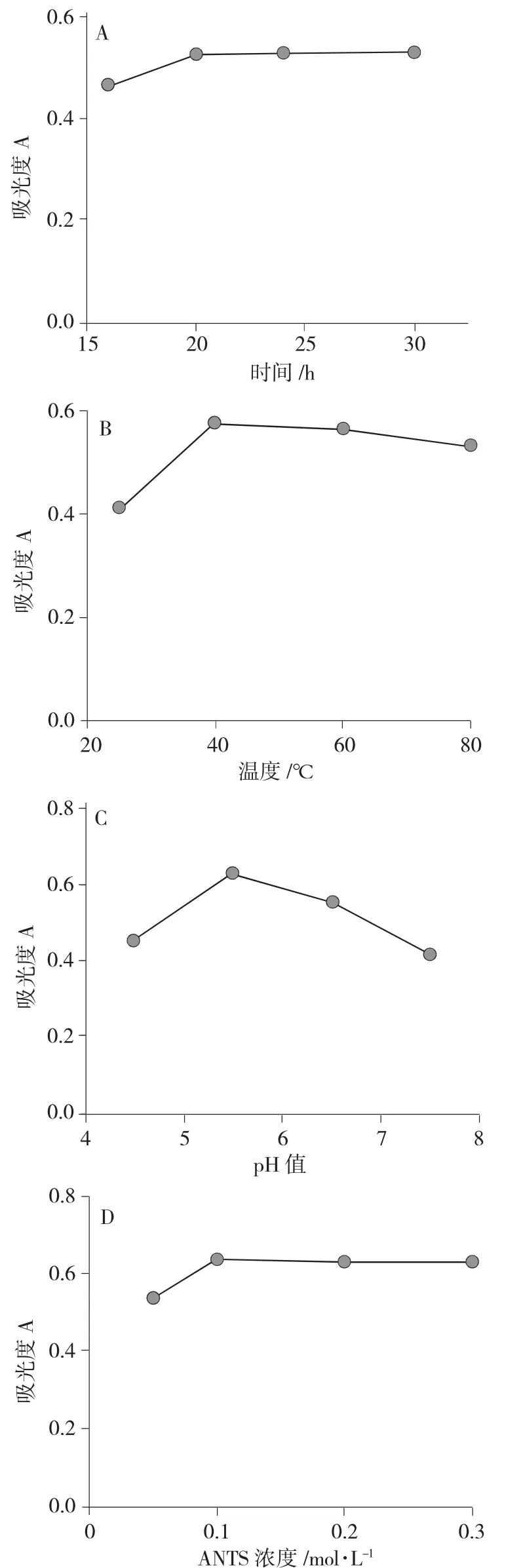
图4 单因素考察结果Fig.4 Single-factor result
2.3 荧光标记物的荧光取代度测定
精密称取ANTS 适量,用蒸馏水配成浓度为58μg·mL-1的溶液。分别量取1.0、2.5、5.0、7.5 和10mL 母液于干燥的50mL 容量瓶中,以蒸馏水定容至刻度线处,稀释得到浓度为1.16、2.9、5.8、8.7 和11.6μg·mL-1的溶液。用石英比色皿测定各溶液在360nm 下的吸光度值。以ANTS 溶液浓度作横坐标,以各浓度吸光度值为纵坐标作图,得到标准曲线y=0.0246x-0.001,相关系数r=0.9992,结果表明,ANTS在1.16~11.6μg·mL-1浓度范围内线性关系良好。
精密称定蛴螬多糖-ANTS 适量,配成浓度为38μg·mL-1的溶液,测定该溶液在360nm 下的吸光度值,代入标准曲线计算得到标记物中ANTS 的含量,以ANTS 的含量计算蛴螬多糖荧光标记物中ANTS 的取代度为1.56%。
3 结论
在国内外的文献报道中,许多采用放射性同位素标记多糖研究其生物活性和分子机制,但由于放射性物质会对人身体造成危害而不便应用。因而采用化学合成法,通过多糖上的特征结构,将荧光物质结合到多糖上的荧光标记技术已经成为目前应用非常广泛的一项技术。已知有多种荧光物质可以通过多糖特征性还原末端同其发生反应,如异硫氰酸荧光素(FITC)、2-氨基吡啶(AP)、8-氨基-1,3,6 奈三磺酸二钠盐(ANTS)、6-氨基喹啉(AQ)、4-氨基苄腈(ABN)、2-氨基吖啶酮[4]等。
本文实验利用8-氨基-1,3,6 萘三磺酸二钠盐(ANTS) 的氨基首先与蛴螬多糖还原端醛基发生亲核反应,消去一分子水,形成席夫碱,席夫碱不稳定,还原剂NaBH3CN 迅速将其还原成稳定的二级胺,达到荧光标记的目的[5]。再通过透析、凝胶色谱等方法进行分离纯化,得到较纯的多糖荧光标记物。因为多糖在360 和490nm 下没有特征吸收,而ANTS 在360nm 下有特征吸收,多糖-苯酚-浓H2SO4(1∶1∶8) 显色反应后多糖在490nm 下有特征吸收,从而根据紫外图谱判别ANTS 是否连接到多糖上。ANTS 的最大激发波长在360nm 处,最大发射波长在520nm 处,从而根据荧光图谱判别ANTS 是否连接到多糖上。多糖本身无荧光,所以在荧光检测器的高效液相色谱图上无色谱峰,ANTS 在相同色谱条件下色谱峰的保留时间在13min,而经ANTS 标记后的蛴螬多糖色谱峰保留时间在10min。这是因为经过标记后的蛴螬多糖分子量变大,在凝胶色谱柱上保留时间缩短,由此可得ANTS 已经成功标记到了当归多糖上。
在考察蛴螬多糖与ANTS 反应的单因素实验中发现,最佳条件是pH 值为5.5,40℃条件下反应20h时反应率最高。
