硒代半胱氨酸的研究进展
2021-10-14董泽云
董泽云
(天津大学 药物科学与技术学院,天津 300072)
硒(Se)是动物和人类都必需的微量元素,可从包括谷物和蔬菜在内的饮食中获得。在1950 年代,德国科学家克劳斯·施瓦茨(Klaus Schwarz)首次发现硒作为必需微量元素而存在,可以防止大鼠肝脏坏死[1]。硒缺乏与多种疾病有关,包括中国农村地区多发的地方性心肌病克山病(Keshan)和慢性骨软骨病卡申-贝克病(Kashin-Beck),还会影响个体药物代谢的能力,并且可能与某些药物毒性增加和药效降低有关[2]。硒在细胞中的功能,主要通过硒代半胱氨酸的形式并入多种硒蛋白的活性位点而实现。硒代半胱氨酸是遗传密码中的第21 个氨基酸,在蛋白合成中由UGA 密码子编码。硒代半胱氨酸存在于多种硒蛋白和硒酶中,例如谷胱甘肽过氧化物酶和硫氧还蛋白还原酶,它们在氧化还原、氧化还原信号和抗氧化防御中具有重要的生物学功能。因此,硒蛋白是生命体中必不可少的。但研究表明,硒蛋白的活性中心硒代半胱氨酸分子本身对多种癌细胞系具有细胞毒性作用,因此,其作为具有广谱抗肿瘤活性的潜在药物被广泛研究。本文对硒代半胱氨酸的生物合成路径的研究进展,硒代半胱氨酸参与的硒蛋白的功能以及硒代半胱氨酸分子作为抗肿瘤药物的细胞毒性及其机理研究进行了综述,为硒蛋白作为一些疾病治疗研究靶标和硒代半胱氨酸分子作为抗肿瘤药物的进一步研究提供理论基础。
1 硒代半胱氨酸的生物合成
对于普通氨基酸而言,氨基酸分子通常在细胞质基质中形成,然后通过相应的氨酰-tRNA 合成酶偶联到同源tRNA 上。而硒代半胱氨酸的合成路径不同于普通氨基酸。 硒代半胱氨酸具有同源tRNASec,但由于细胞质基质中不存在游离的硒代半胱氨酸,也没有相应的硒代半胱氨酰-tRNA 合成酶,硒代半胱氨酸的合成并非始于硒代半胱氨酸与同源tRNASec 的连接,而是丝氨酰-tRNA 合成酶首先将丝氨酸(Ser)连接到非同源tRNASec 上形成丝氨酰-tRNASec(Ser-tRNASec)(图1)[3]。在真核生物和古生菌中,丝氨酰-tRNASec 通过磷酸丝氨酰-tRNASec 激酶(PSTK) 转化为磷酸化的丝氨酰-tRNASec(pSer-tRNASec)。而后,该中间体在硒代半胱氨酸合成酶(SecS)的作用下,接受活化的硒供体分子硒代磷酸盐,从而产生最终产物硒代半胱氨酰-tRNASec(Sec-tRNASec)(图1)。硒代磷酸盐由硒化氢在ATP 和硒代磷酸盐合成酶2(SPS2)的共同作用下生成[4,5]。硒代半胱氨酸在细菌中的合成路径与在真核生物和古生菌中不完全相同。在细菌中,硒代半胱氨酸合成酶(在细菌中为SelA)直接作用于丝氨酰-tRNASec(Ser-tRNASec),并去除丝氨酰基团中的羟基形成中间体。随后,中间体接受接收活化的硒代磷酸盐最终产生硒代半胱氨酰-tRNASec(Sec-tRNASec)。此处的硒代磷酸盐在细菌中的硒代磷酸盐合成酶SelD 的作用下产成[6,7]。
硒代半胱氨酸由密码子UGA 进行编码,而UGA 通常是决定蛋白质合成停止的终止密码子。将UGA 识别为硒代半胱氨酸密码子而不是终止密码子的关键为硒蛋白mRNA 上具有茎环结构的SECIS 元件,称为硒代半胱氨酸插入元件。在细菌中,SECIS 元件出现在UGA 密码子下游的编码区内,作为与Sec-tRNASec 结合为复合物的特定延伸因子SelB 的结合位点。在古生菌和真核生物中,SECIS 元件通常位于硒蛋白mRNA 3' 端的非翻译区, 它与SECIS 结合蛋白2(SBP2)形成的复合物能够与特定的延伸因子EFSec 与Sec-tRNASec 形成的复合物结合,从而将硒代半胱氨酸插入到硒蛋白中(图1)[8]。
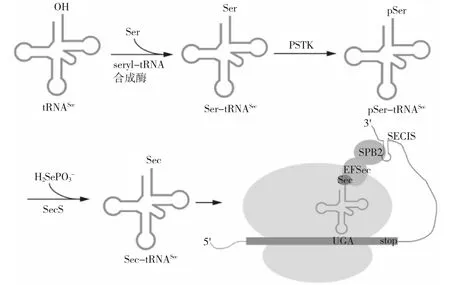
图1 硒代半胱氨酸在真核生物内的合成路径Fig.1 Biosynthesis pathway of selenocysteine in eukaryote
2 硒代半胱氨酸参与的硒蛋白及其功能
硒代半胱氨酸通过特殊的生物合成途径插入多种硒蛋白的活性位点。由于硒代半胱氨酸的pKa值较低,在生理条件下,硒代半胱氨酸中的硒几乎被完全离子化,因此,可以作为一种极其有效的生物催化剂。研究表明,哺乳动物中可能存在多达100 种硒蛋白。人类的25 种硒蛋白中大约有一半硒蛋白已经能够被纯化和克隆,其功能也被进一步研究表征。这些硒蛋白大多通过硒代半胱氨酸表现出酶促氧化还原功能,从而具有催化或抗氧化活性[5,9,10]。谷胱甘肽过氧化物酶通过催化H2O2和其他过氧化物的还原而保护细胞不受自由基和过氧化物类活性氧的损害,硫氧还蛋白还原酶在其代谢活动中通过催化硫氧还蛋白还原而起调节作用。由于硫氧还蛋白可刺激正常细胞和肿瘤细胞的增殖,并在肿瘤细胞中以高浓度形式存在,抑制硫氧还蛋白还原酶的活性可以在癌症的预防和治疗中起到重要作用[11,12]。甲状腺激素脱碘酶将硒代半胱氨酸与甲状腺激素的代谢联系起来,3 种不同的甲状腺激素脱碘酶可催化甲状腺激素的还原去碘化,从而使其活化或失活,对于胎儿的正常生长发育必不可少[10]。此外,还有许多其他功能已知或未知的硒蛋白在生物体调节中起到重要作用。
3 硒代半胱氨酸的毒性及机理
研究表明,游离的硒代半胱氨酸分子对多种癌细胞系具有细胞毒性作用,其半数致死量范围为1.7~37.0μM[13-16]。因此,硒代半胱氨酸作为具有广谱抗肿瘤活性的潜在药物被广泛研究。目前,已经提出了几种硒代半胱氨酸作为抗癌活性药物的可能机制,包括诱导细胞凋亡、抑制细胞增殖、破坏细胞氧化还原平衡、引发DNA 损伤等[13,17,18]。
细胞内活性氧(reactive oxygen species, ROS),包括超氧阴离子、H2O2和羟基自由基,是在细胞内正常有氧条件下产生。但在外部刺激的影响下,细胞内活性氧的浓度会升高,可能会攻击细胞膜脂质、蛋白质和DNA,并引发氧化损伤。ROS 引发的DNA 损伤反应会激活共济失调-毛细血管扩张突变基因(ATM)和Rad-3 相关蛋白(ATR),并将DNA 损伤信号传递到下游靶蛋白和抑癌基因p53。p53 是细胞凋亡的主要参与者,它可以诱导促凋亡因子的转录激活以及对促存活因子的抑制。Chen T.等研究结果显示,硒代半胱氨酸在A375、HepG2 和MCF7 细胞系中可以诱导剂量依赖性的细胞凋亡作用,且引起细胞内的ROS 浓度的显著提高。此外,在HepG2 和MCF7 细胞中也观察到DNA 链的断裂[13]。他们对硒代半胱氨酸引起MCF7 细胞凋亡作用的进一步研究表明,硒代半胱氨酸通过ROS 的产生介导线粒体功能障碍和p53 磷酸化诱导MCF7 细胞凋亡[17]。通过ROS 抑制剂谷胱甘肽(glutathione, GSH))抑制ROS可有效减少硒代半胱氨酸引发的细胞氧化损伤并减慢细胞凋亡进程,进一步证实了ROS 在硒代半胱氨酸参与的抗癌机制中的重要性[13]。研究发现,硒代半胱氨酸还可以通过触发对硫氧还蛋白还原酶的抑制作用,介导氧化损伤的细胞凋亡来抑制人神经胶质瘤的生长[19]。另外,Bcl-2 蛋白家族对线粒体膜电位具有调节作用,降低其表达量会影响胞内氧化还原平衡,进而导致细胞凋亡。硒代半胱氨酸通过调节Bcl-2 蛋白家族的表达和磷酸化导致线粒体膜电位流失,进一步导致细胞色素C 和凋亡诱导因子(AIF)从线粒体中释放,随后转移到细胞核中并诱导染色质浓缩和DNA 降解,最终导致细胞凋亡[17,18]。
硒代半胱氨酸的化学结构与半胱氨酸类似,唯一不同的是半胱氨酸中的硫原子在硒代半胱氨酸中由硒原子取代。因此,在蛋白质合成过程中,如果细胞中存在游离的硒代半胱氨酸,当半胱氨酰-tRNA识别错误导致硒代半胱氨酸取代半胱氨酸插入蛋白质中时,就会导致蛋白没有办法正确折叠,进一步导致未折叠蛋白效应(unfolded protein response, UPR)的产生。UPR 致使未折叠蛋白被降解,蛋白合成减慢,蛋白质功能受损,细胞凋亡蛋白基因生成,促使合成细胞凋亡蛋白酶,从而诱导细胞凋亡。细胞凋亡蛋白酶抑制剂可抑制由细胞凋亡蛋白酶引起的细胞凋亡反应,进一步证实了硒代半胱氨酸可导致由未折叠蛋白效应引起的细胞凋亡[20]。
除细胞凋亡途径外,研究显示,经过硒代半胱氨酸处理的稀细胞中,大量内质网蛋白发生改变,且伴有内质网空泡的形成。这表明细胞发生内质网应激反应,从而导致内质网压力调节蛋白发生变化,导致细胞自体吞噬[20]。
4 结语
硒代半胱氨酸被认为是核糖体介导的蛋白质合成中的第21 个氨基酸,其复杂的特异性插入系统由UGA 密码子指导。基本上所有已表征的硒蛋白都是氧化还原酶,其中硒代半胱氨酸位于催化活性位点并显示出氧化还原活性。显然,硒代半胱氨酸独特的催化性质是这些蛋白中使用硒的原因,包括硒代半胱氨酸的亲核性,与半胱氨酸相比较低的pKa值,其作为离去基团的能力以及氧化还原电势。这些特性可以通过半胱氨酸进行部分补偿,例如大多数硒蛋白的硒代半胱氨酸被半胱氨酸取代时,会保留约1%的活性。但相比较而言,硒代半胱氨酸的活性显示出了更强的优越性[21]。
硒蛋白在生命体调节中起到重要作用,例如硫氧还蛋白还原酶在调节细胞内氧化还原稳态,保护细胞不受ROS 损伤中具有关键作用。研究发现,硫氧还蛋白还原酶在癌细胞中浓度显著升高,与促进肿瘤细胞增殖、抑制肿瘤细胞凋亡以及增强肿瘤细胞耐药性有关。因此,硫氧还蛋白还原酶可作为癌症治疗的靶标,抑制其活性可以在癌症的预防和治疗中起到重要作用。而硒代半胱氨酸作为硫氧还蛋白还原酶的活性中心,可以作为抑制酶活性的反应中心。例如Pan S.等开发了含有两个Se-N 键的含硒小分子,在还原条件下,两个Se-N 键可以与硫氧还蛋白还原酶中硒代半胱氨酸和半胱氨酸的侧链基团Se-H 键和S-H 键反应,分别形成Se-Se 键和Se-S键。而新键的形成可以破坏硫氧还蛋白还原酶的还原催化,从而抑制硫氧还蛋白还原酶的活性,导致ROS 水平升高,引发癌细胞的凋亡[12]。
硒代半胱氨酸分子对多种癌细胞系具有细胞毒性作用,作为潜在药物分子,硒代半胱氨酸对癌细胞的细胞毒性、细胞毒性机理以及在药物递送系统中的应用已经被广泛研究。He L.等开发了多孔氧化硅纳米粒子作为硒代半胱氨酸分子的药物递送载体,此多功能纳米粒子的表面连接TAT 细胞穿透肽和转铁蛋白,显著增强了其进入HeLa 细胞的特异性,并且在酸性条件下,硒代半胱氨酸能够被有效释放且发挥其细胞毒性作用[22]。Wang S.等将非病毒蛋白衣壳作为新型的硒代半胱氨酸的药物递送载体,硒代半胱氨酸分子通过共价键连接到蛋白衣壳内部,在细胞中由GSH 等还原剂的作用下被完全释放,并在多个癌细胞系中发挥其细胞毒性作用[14]。硒代半胱氨酸还可以敏化HepG2 人肝癌细胞,与阿霉素共同使用并在体内外实现抗癌协同作用[23]。正是由于硒代半胱氨酸分子引起广泛的细胞毒性作用,使其成为潜在的抗癌药物。因此,我们需要对其细胞毒性及毒性机理有更全面的理解,在不影响其有效性的前提下,提高细胞特异性及靶向性,更有针对性的将其作为抗癌药物进行研究。
总的来说,硒代半胱氨酸分子作为硒原子在体内的主要存在形式,拥有复杂的生物合成系统,其参与的硒蛋白具有重要的生物调节作用且可作为潜在的癌症治疗靶标,并且硒代半胱氨酸分子本身也是潜在的抗癌分子药物。但是其毒性机理还需要进一步深入系统的研究,成为硒代半胱氨酸分子进一步作为抗癌药物研究的基础。
