N,N'-二甲基-5-硝基-2,2'-联咪唑锌(II)配合物的合成,表征及与DNA 相互作用*
2021-10-14杨莉宁刘春叶
杨莉宁,刘春叶
(西安医学院 药学院,陕西 西安 710021)
自从1969 年首次报道顺铂对动物肿瘤有强烈的抑制活性后,引起人们对金属配合物抗肿瘤研究的重视。近年来,对金属化合物的研究已成为抗肿瘤药物研究中较为活跃的领域之一。硝基咪唑类化合物具有抗肿瘤、抗真菌、抗病毒、抗菌和抗结核等多种生物活性,在生物和药物化学领域应用广泛[1-3]。金属配合物以硝基咪唑衍生物作为配体可提高配合物的生物活性并改善配合物在溶液中的溶解性,从而提高其生物利用率,降低其毒副作用。生物大分子的DNA 影响着生命与遗传性状的翻译与转录,甚至影响着疾病和进化[4,5]。Ru2+、Zn2+、Co3+等配位饱和的金属配合物可以识别DNA 的二级结构,研究DNA与配合物间的相互作用,对定向设计及构筑新型抗癌药物有重要意义[6,7]。
鉴于此我们设计合成了N,N'-二甲基-5-硝基-2,2'-联咪唑的锌(II)配合物,对其进行了性质表征,研究了其热稳定性和固体荧光性,并以紫外光谱、荧光光谱及粘度法对配合物与DNA 相互作用机理进行了推测分析。
1 实验部分
1.1 试剂与仪器
小牛胸腺DNA(ct-DNA),三羟甲基氨基甲烷(Tris[(CH3OH)3CNH2])均为生化试剂,其余均为分析纯试剂,用前未作进一步处理,蒸馏水为二次蒸馏水。配体NO2Me2biim 按文献方法合成[8]。
Vario EL-IIIG 型元素分析仪(德国EA 元素分析系统公司);EQUINOX55 型红外光谱仪(德国Brucker 公司);STA449C 型热分析仪(德国NETZCH公司);1800 紫外可见分光光度计(日本岛津公司);Ubbeoldhe 粘度计(上海申玻玻璃仪器厂);DDS-307型电导仪(上海大谱仪器有限公司);F-4500 荧光分光光度计(日本日立公司)。
1.2 配合物的合成
称取0.5mmol ZnCl2固体和 0.5mmol 配体NO2Me2biim 分别溶于15mL 甲醇中,二者混合并在室温下搅拌24h,过滤得浅黄色溶液,放置,14d 后析出无色细小微晶颗粒,过滤,乙醇洗涤并干燥得无色配合物固体。
1.3 配体及配合物与ct-DNA 相互作用实验
采用文献已报道的经典方法,对实验所需试剂及缓冲溶液进行配制,并进行与ct-DNA 相互作用的紫外光谱、荧光光谱及粘度法实验[9]。
2 结果与讨论
2.1 配合物的性质表征
2.1.1 元素分析及摩尔电导率
表1 的数据表明,配合物元素分析的实验值与理论值较为一致,基本可以确定其化学组成。根据摩尔电导率值可以判断配合物在乙醇中属于非电解质[10]。

表1 配合物的元素分析及摩尔电导率*Tab.1 Element analysis and molar conductivity data of complex
2.1.2 红外光谱分析

表2 配体及配合物的红外光谱数据(cm-1)Tab.2 IR data of the ligand and complex(cm-1)
以KBr 压片测定配体及其配合物的红外光谱。与配体N,N'-二甲基-5-硝基-2,2'-联咪唑的红外光谱相比较,形成配合物后特征吸收峰发生偏移主要表现在咪唑环上的振动吸收,其中vC=N伸缩振动和配体相比由1530cm-1向低波数1513cm-1发生了红移且强度降低,说明金属与咪唑环上的3 位N 发生了配位。这是N 原子与金属配位引起C=N 核间电子密度降低造成的。而位于指纹区的423cm-1吸收峰可以指派为配位键vZn-N。
2.1.3 紫外-可见光谱分析
用Tris-HCl 缓冲溶液配制配体及其配合物(1.0×10-4mol·L-1)的溶液,扫描它们的紫外-可见吸收光谱。图1 表明,配体在200~400nm 范围内有两个主要吸收峰,分别位于240 和336nm 处,可分别归属为有机配体咪唑环共轭体系的π→π*和n→π*跃迁。配合物和配体呈现有类似的双吸收峰,但吸收峰的强度发生了改变,这是金属离子与配体发生配位的结果。

图1 配体和配合物的紫外吸收光谱图Fig.1 UV-Vis spectrum of ligand and its complex
2.1.4 固体荧光光谱分析
在室温条件下,分别测定了配体NO2Me2biim 和配合物固体荧光光谱(见图2)。在280nm 紫外光激发下,配体分别在471,485 和493nm 处有极弱的荧光发射峰,主要是配体内的π→π*跃迁所致。而其Zn 配合物在300nm 激发光激发下于421,452 和467nm 处产生较强的蓝光荧光发射光谱,Zn2+离子是d10电子构型,不易被氧化或还原,因此,配合物的荧光光谱既不是来源于金属向配体(M→L)的电荷转移,也不是配体到金属(L→M)的电荷转移,可能归咎于配体之间的π→π*跃迁。相较于配体,配合物荧光发射峰发生了紫移,是由于配体与金属配位后配体的共轭程度降低而引起的[11]。

图2 配体L 和配合物的固体荧光光谱Fig.2 Fluorescence spectra of ligand and its complex
2.1.5 热重分析 N2气氛下,流速30cm3·min-1,升温速率为20℃·min-1进行热重分析,测得配合物从室温到1000℃温度范围内的TG-DSC 曲线,见图3。

图3 配合物的热重曲线图Fig.3 Thermogravimetric analysis of complex
由图3 可以看出,配合物[Zn(NO2Me2biim)Cl2·H2O]热分解过程,在320℃之前配合物比较稳定,说明其组成中的水分子为配位水分子,不易失去。其后快速失重直到360℃左右,对应于失去一个配位水分子及配体咪唑环上的甲基、硝基等侧链基团(失重实测值27.3%,理论值26%)。DSC 曲线上在320~330℃有一小的吸热峰,在350℃有一尖锐的放热峰,为配合物的融化吸热及分解放热。随着温度升高,有机配体剩余部分缓慢分解(总失重实测值63.58%,理论值62.26%),DSC 曲线在700℃左右开始出现一较宽的放热峰,可能为残余物ZnCl2的相变放热,同时TG 曲线一直在下滑,意味着ZnCl2在高温N2气氛下的不断挥发。
综合元素分析、紫外、红外、摩尔电导率、固体荧光及热重等分析数据,并结合甲硝唑配合物文献[12],推测配合物[Zn(NO2Me2biim)Cl2·H2O]的可能结构为四配位单核锌配合物如Chart 1 所示。

图示1 配合物[Zn(NO2Me2biim)Cl2·H2O]的可能结构Chart 1 Possible structure of complex[Zn(NO2Me2biim)Cl2·H2O]
2.2 配体及其配合物与ct-DNA 相互作用
2.2.1 配体及其配合物与ct-DNA 相互作用的紫外光谱分析
图4 为配体及其配合物随着DNA 浓度增加与DNA 相互作用的紫外吸收光谱图。

图4 DNA 浓度对配体L 及其配合物紫外光谱的影响Fig.4 UV absorption spectra of L and its complex with increasing concentration of DNA
由图4 可见,当固定配体和配合物溶液的浓度时,随着加入ct-DNA 的量的增加,配体和配合物的紫外吸收峰强度下降,均表现为减色效应(吸光度变化ΔA:1.06→1.02,1.25→1.21),说明配体和配合物均与DNA 发生了相互作用,可初步推测作用机制属于嵌插作用,因为小分子化合物插入DNA 后,长链DNA 的“屏蔽”使π 平面接受的光通量减少,会导致减色效应[13]。
2.2.2 配体及其配合物与DNA 相互作用的荧光光谱分析
图5 为配体及其配合物随着DNA 浓度增加与DNA 相互作用的荧光光谱。
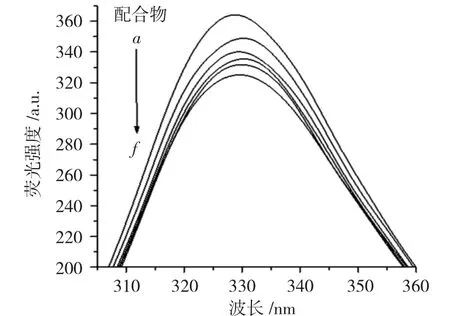
图5 DNA 浓度对配体L 及其配合物荧光光谱的影响Fig.5 Fluorescence spectra of L and complex at different concentrations of DNA

荧光光谱是研究配合物与DNA 相互作用的最常见和简便的方法。如果配合物与DNA 作用后出现了荧光增强或减弱现象,说明配合物与DNA 发生了一定的作用。虽不能以此作为配合物与DNA 发生嵌插或其它作用的直接判据,但荧光强度变化幅度的大小可反映出配合物与DNA 之间是否发生作用及其作用的强弱。
由图5 可以看出,固定配体和配合物溶液的浓度,随着DNA 浓度的增加,配体和配合物的荧光强度逐渐减小,且配体的荧光发射峰发生了较大的红移,而配合物未观察到峰位的偏移。配合物本身就具有较强的荧光性,当它与DNA 发生专一作用后,DNA-配合物体系的荧光强度会大大降低。当小分子与DNA 发生相互作用后,二者在水溶液中互相碰撞发生能量交换也能导致小分子的荧光光谱发生猝灭。
2.2.3 配体及其配合物与ct-DNA 相互作用的粘度分析
图6 为配体及其配合物浓度增加对DNA 相对粘度的影响。
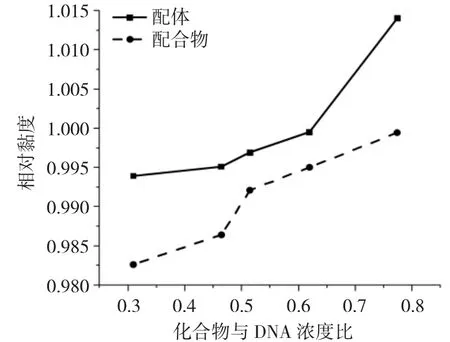
图6 配体及其配合物浓度对DNA 黏度的影响Fig.6 Effects of increasing amount of ligand and complex on the viscosity of DNA
粘度测试是研究配合物与DNA 作用方式的方法之一。配合物与CT-DNA 以嵌入方式相互作用时,DNA 双螺旋链增长,DNA 粘度增大;以部分插入的方式作用时,DNA 溶液的粘度降低;以静电或沟渠方式作用时,DNA 溶液的粘度未发生明显变化[14]。由图6 可知,配体及配合物的浓度增加对DNA 相对粘度的影响趋势是增大,尤其是配体影响较大,说明二者与DNA 的作用模式是嵌插模式,而且配体与DNA 的作用较强。
3 结论
设计合成了N,N'-二甲基-5-硝基-2,2'-联咪唑的锌(II)配合物。通过各种光谱分析、热重、元素分析和摩尔电导率对配合物的结构进行了表征,推测了配合物的可能组成。利用紫外光谱和荧光光谱研究了配体及配合物与DNA 的相互作用,并用粘度法进一步证实了实验结果。实验结果表明,配体及其配合物与DNA 相互作用模式为嵌插式,且配体与DNA 的相互作用力较强。
