基于短程硝化颗粒污泥对高氨氮废水的处理效果研究
2021-10-14李恺翔
李恺翔
(延安职业技术学院,陕西 延安 716000)
化肥、焦化、石化、制药、食品、垃圾填埋场等生产环境均可能产生高NH3-N 废水,即可认为高NH3-N 废水是轻重工业生产环节中较为普遍的废水排放形式,所以,研究高NH3-N 废水的处理方案[1-3],是当前废水处理环保工程中的主线研究课题。
硝化颗粒污泥是利用废水处理池中的微生物,进行实验室物种优选、基因强化、重点繁育培养的一种生化产品,由于这种微生物可以耐受高NH3-N 废水的生存环境,且在其新陈代谢循环中,将水中的NH3-N 离子作为重要代谢养料进行吸收分解[4-7],因此,培养代谢周期短、代谢效率高的硝化细菌菌群,加工消化颗粒以促进高NH3-N 废水池底层污泥生态环境的发育,使高NH3-N 废水在初期沉淀过程中即可利用废水池中的消化颗粒实现大部分NH3-N污染物的降解,可以最大限度降低高NH3-N 废水的处理成本,缩短处理周期,实现更高效率和更高效益的高NH3-N 废水处理效率[8-10]。
本文重点研究不同外部条件下的短程消化颗粒对高NH3-N 废水池中NH3-N 污染物的作用机理,以总结其生化学特征。
1 实验部分
1.1 试验水样
采用实验室制成法获得高NH3-N 废水水样,NH3-N 含量、重金属含量、pH 值分别按照表1 参数进行调制。
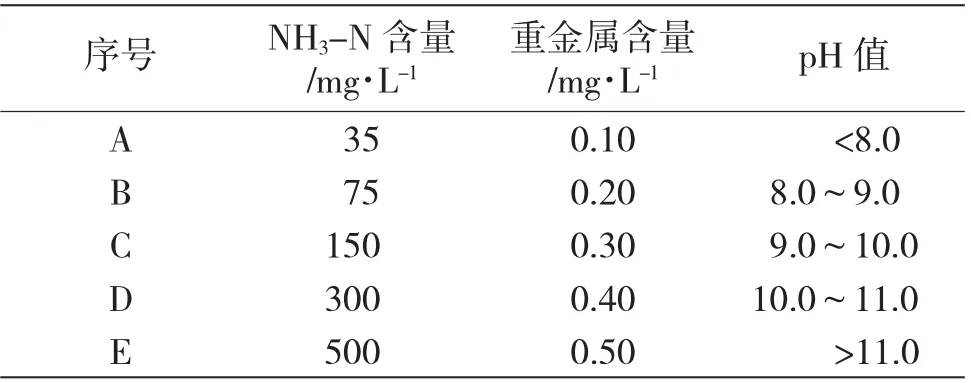
表1 废水水样制成方案Tab.1 Wastewater sample preparation scheme
表1 中,并非指出5 个合成水样的制成配比,而是将上述3 个条件分别进行组合,即在NH3-N 含量达到35mg·L-1的条件下,重金属含量可以按照A~E共5 个配置方案进行配置,pH 值也可以根据A~E共5 个方案进行配置,即通过该表中的合成水样制成方案,共可形成125 种不同配置的合成水样,以供更深入的数据分析。
1.2 硝化颗粒制成方案
从高NH3-N 废水消化污泥沉淀池中提取底层污泥,电镜下分析消化污泥菌群并通过硅藻法分离微生物整体群落。从AAA 型污水开始,根据诱导变异法,对其进行适应性培养,逐渐构成AAA 型~EEE型污水共125 种适应性硝化污泥。培养过程中,培养基采用经过硅藻过滤处理后的污泥固形物,培养液采用AAA 型~EEE 型合成污水水样,且高浓度水样的被培养微生物群落,来自低浓度水样的微生物稳定培养微生物群落。整体培养策略见图1。
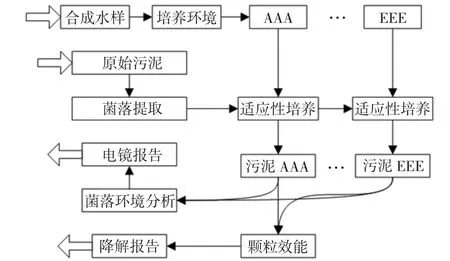
图1 消化颗粒制备及应用策略图Fig.1 Preparation and application strategy of digestive granules
图1中,通过制备125 种不同适应性的硝化颗粒,以供后续试验中的电镜报告和废水降解报告。其中,重金属离子污染物提取自原始污泥采样样本,包含铅、汞、砷等污染离子。
1.3 电镜报告编制方案
静态报告使用750、1500、2500 倍电镜对污泥培养结果进行观察,在对应染色机制下,记录不同类型硝化细菌的单位面积计数。动态报告使用该观察方式记录菌落的分裂增殖能力。报告统计中,分别就不同NH3-N 含量、重金属含量、pH 值条件进行统计。
1.4 降解报告编制方案
按照污水水样置入硝化颗粒并充分搅拌混合的时间线,分析不同时间点的NH3-N 浓度变化,重金属浓度变化,pH 值变化,考察不同的硝化颗粒加入量和不同环境温度等因素影响,绘制变化曲线。
2 结果与讨论
2.1 电镜报告结果
进行电镜报告分析过程中,针对每一种特定条件,分析该条件下所有其他对应情况,比如在特定NH3-N 浓度条件下,分析其他25 种重金属离子浓度、pH 值条件形成的对应菌落分布情况,每种特定情况进行不少于50 个采样的菌落电镜观察分析,结果见表2。
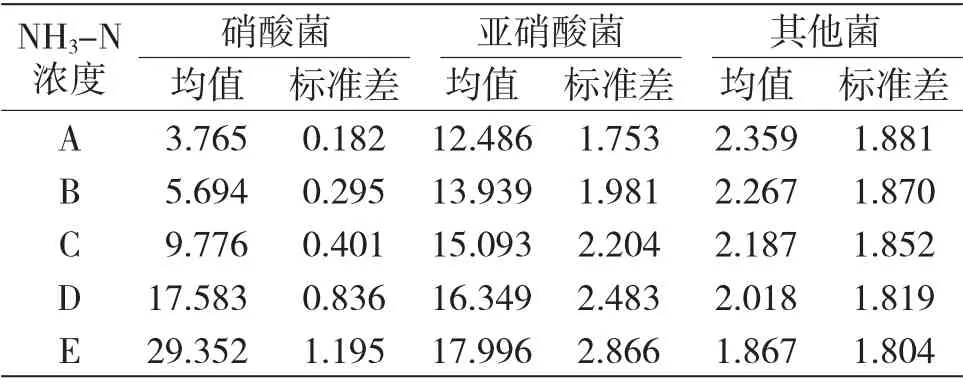
表2 不同NH3-N 浓度下的菌落构成对比表(×106cm-3)Tab.2 Comparison of colony composition under different ammonia nitrogen concentrations(106cm-3)
2.1.1 不同NH3-N 浓度下的菌落构成结果分析
由表2 可知,从标准差观察相应指标的条件依从度,发现除硝酸菌和亚硝酸菌之外的其他菌落标准差达到均值的七成以上,标志着其他菌落的分布情况与NH3-N 浓度无统计学关联性,而此模式下,发现硝酸菌与亚硝酸菌的分布情况沿NH3-N 浓度增长趋势表现出不同的增长率,其中硝酸菌呈指数型增长,亚硝酸菌呈线性增长,见图2。
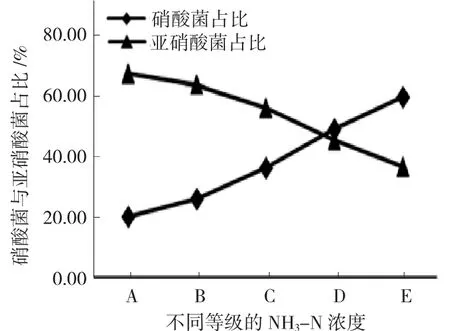
图2 不同NH3-N 浓度配置方案下的硝酸菌与亚硝酸菌占比变化示意图Fig.2 Change of the proportion of nitrate bacteria and nitrite bacteria under different ammonia nitrogen concentration configuration schemes
2.1.2 不同NH3-N 浓度占比结构分析
由图2 可知,随着NH3-N 浓度增加,适应性硝化颗粒中,亚硝酸菌浓度持续降低,而硝酸菌浓度持续升高。亚硝酸菌浓度与NH3-N 浓度呈现逆相关,硝酸菌浓度与NH3-N 浓度呈现正相关。
根据表1 中重金属离子浓度配置方案,同样每种重金属离子浓度配置方案下有25 种子方案,涉及到不同NH3-N 浓度和不同pH 值控制方案,每种重金属离子浓度方案电镜下观察50 个不同视野,结果见表3。
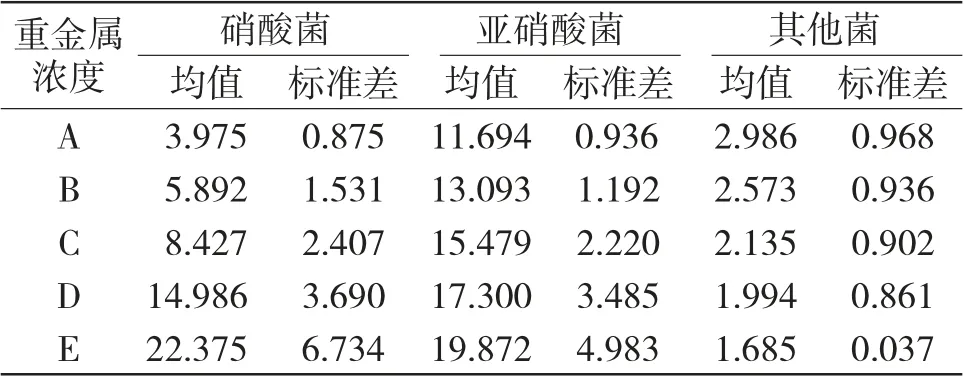
表3 不同重金属浓度下的菌落构成对比表(×106cm-3)Tab.3 Comparison of colony composition under different heavy metal concentrations(106cm-3)
2.1.3 不同重金属浓度下的菌落构成对比结果分析
由表3 可知,硝酸菌浓度呈现指数增长关系,亚硝酸菌浓度呈现线性增长关系,而其他菌落浓度因为标准差较大,不存在统计学意义。但硝酸菌浓度和亚硝酸菌浓度的标准差远大于不同NH3-N 浓度的统计结果,标志着不同重金属浓度下的统计结果与不同NH3-N 浓度下的统计结果相比,其数据依从性略低。
根据表1 中pH 值控制方案的配置策略,同样每种pH 值控制方案下有25 种子方案,涉及到不同NH3-N 浓度和不同重金属离子浓度,每种pH 值控制方案电镜下观察50 个不同视野,结果见表4。

表4 不同pH 值下的菌落构成对比表(×106cm-3)Tab.4 Comparison of colony composition under different pH values(106cm-3)
2.1.4 不同pH 值下的菌落构成对比结果分析
由表4 可知,硝酸菌浓度和亚硝酸菌的数据增长关系依然分别为指数关系和线性关系,且其标准差远小于上述两种统计方案。综合表2~4 结果,会发现随着污水污染程度增加,硝酸菌表现出更强适应性,大于亚硝酸菌的适应性,污染程度更重的污水,硝酸菌的生长增殖适应性更强。
考察3 种条件下的硝酸菌浓度和亚硝酸菌浓度,可以得到图3、4。
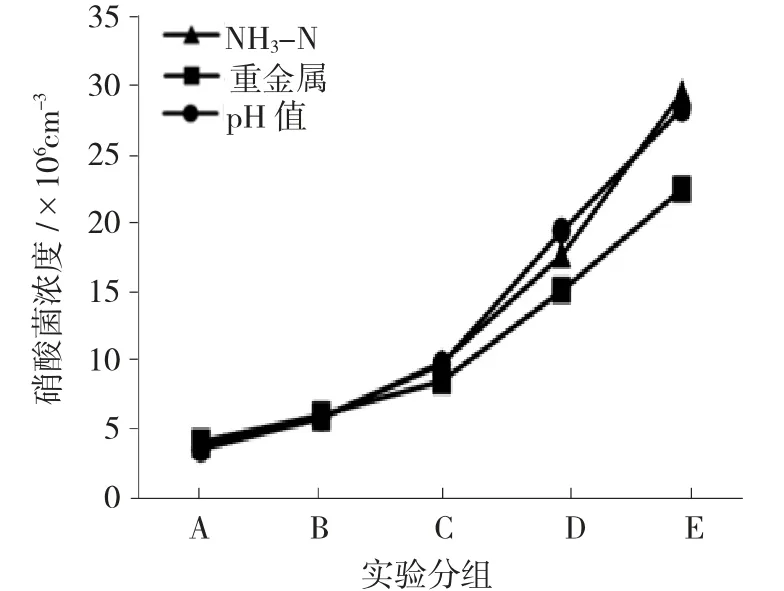
图3 硝酸菌浓度在不同污染级别下的表现Fig.3 Performance of nitrate bacteria concentration under different pollution levels
由图3 可知,在3 种不同污染条件下,硝酸菌浓度均呈现出指数型增长关系,其中重金属污染物条件下的浓度均值增长幅度略慢于其他两种污染条件。
由图4 可知,亚硝酸菌在3 种不同污染条件下,均表现出线性增长关系。与硝酸菌的浓度变化曲线相比,线性增长关系的增加量在后期会慢于指数增长关系,但不代表亚硝酸菌在高浓度废水中的适应性不强。实际的硝化颗粒中,亚硝酸菌也有生态学表达。
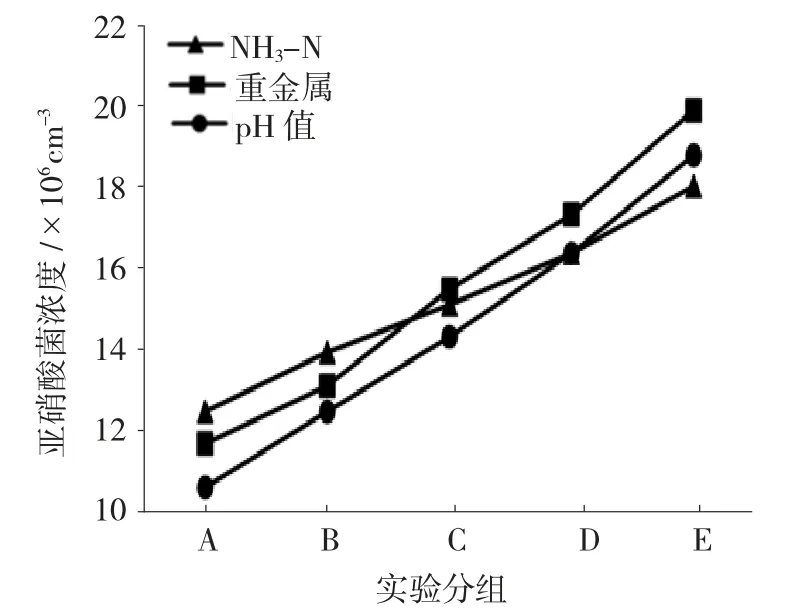
图4 亚硝酸菌在不同污染级别下的表现Fig.4 Performance of nitrite bacteria in different pollution levels
2.2 降解报告结果
针对表1 中125 种不同的NH3-N 废水水样,分别使用针对性培养的硝化颗粒对其进行处理,记录其不同时间点下的废水NH3-N 浓度下降幅度。对比高浓度废水池中沉淀周期内的废水浓度下降情况。总体评价125 种不同浓度废水的处理结果,其浓度下降结果见图5。
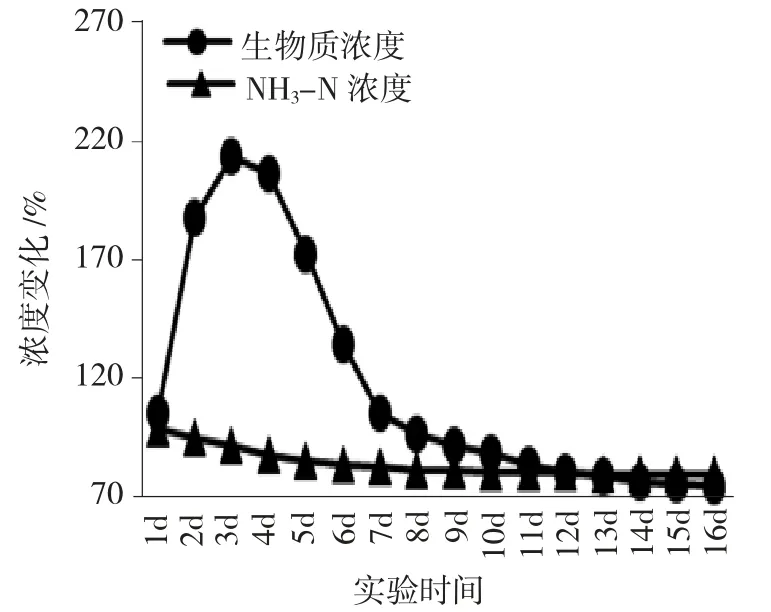
图5 所有废水处理过程的生物质及NH3-N 浓度变化情况均值趋势图Fig.5 Average trend of biomass and ammonia nitrogen concentration changes in all wastewater treatment processes
2.2.1 废水处理过程的生物质及NH3-N 浓度变化结果分析
由图5 可知,对应的硝化颗粒加入到对应的废水中后,由于微生物群落对废水环境的适应性,其生物质浓度会在前3d 周期内快速上升到初始浓度的2 倍以上,但因此时废水中的NH3-N 物质因为微生物群落的消耗而快速降低,在8d 左右时间达到初始浓度的80%左右,此时硝化颗粒的生物质群落对低浓度废水的适应性降低,因此,导致其生物质浓度下降至初始浓度的90%左右,且保持持续下降,所以生物质废水的NH3-N 污染物下降趋势也开始放缓。将生物质浓度下降到初始浓度90%的时间点视为该废水处理环节的适应性阈值点,如上述均值考察环境下,8d 是该阈值,超过8d 的废水沉淀处理过程,废水处理效率将显著降低。此时应将废水转移到低浓度处理池中,更换对应的硝化颗粒进行进一步处理。考察不同反应温度对硝化颗粒处理NH3-N 废水的影响效果,结果见表5。
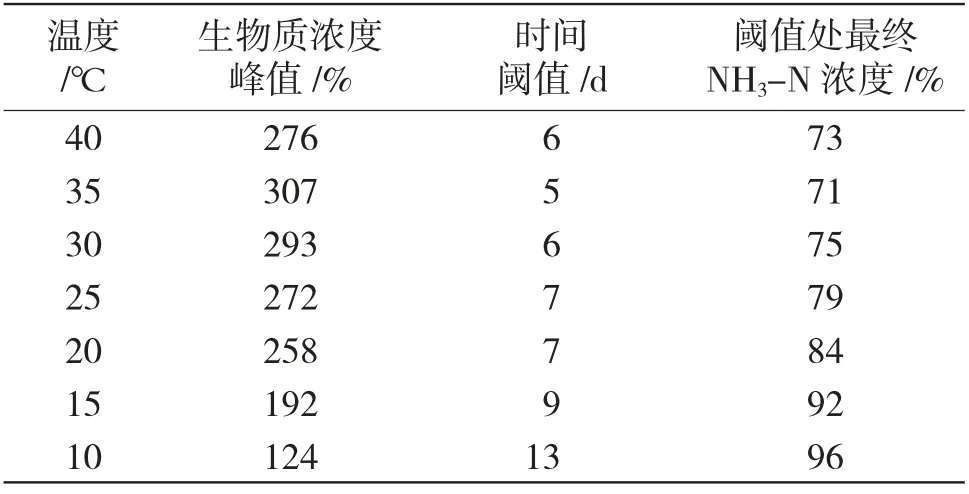
表5 反应温度对NH3-N 废水处理工艺的影响Tab.5 Effect of reaction temperature on ammonia nitrogen wastewater treatment process
2.2.2 反应温度对NH3-N 废水处理工艺的影响结果分析
由表5 可知,硝化颗粒污泥对高温环境表现出较高生物活性,特别是在35℃环境下,可以实现在最短时间阈值(5d)内,将NH3-N 废水中NH3-N 污染物浓度控制到71%的污水处理效果,且其生物质浓度峰值可以达到307%。即在35℃环境中,硝化颗粒可以达到最强的生物质活性。而当温度超过35℃时,其生物活性会有所下降,但在40℃时,其仍然可以在时间阈值6d 时,达到NH3-N 污染物浓度下降至73%的处理效果。但当温度下降到20℃以下时,硝化颗粒的生物活性显著降低,逐渐失去工业应用价值。如温度达到15℃,生物质浓度峰值仅可达到192%,时间阈值延长到9d,最终NH3-N 浓度高达92%;而温度达到10℃时,时间阈值达到13d,最终NH3-N 反应浓度高达96%,此时硝化颗粒已经几乎失去污水处理能力。
另外,35℃反应温度条件下,考察不同硝化颗粒加入浓度配比对硝化颗粒处理NH3-N 废水的影响效果,结果见表6。
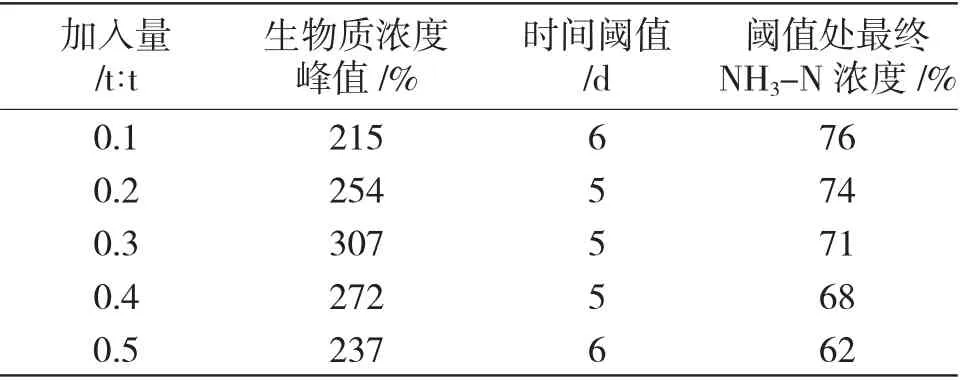
表6 硝化颗粒加入量对NH3-N 废水处理工艺的影响(35℃)Tab.6 Effect of nitrifying particle addition on ammonia nitrogen wastewater treatment process(35℃)
2.2.3 硝化颗粒加入量对NH3-N 废水处理工艺的影响结果分析
由表6 可知,随着硝化颗粒加入量增加,达到时间阈值时的最终NH3-N 浓度持续下降,即加入足量硝化颗粒,可以实现更显著的NH3-N 处理结果。当1t NH3-N 废水加入0.5t 硝化颗粒污泥时,其最终NH3-N 浓度可以达到初始浓度的62%。但是,当加入硝化颗粒的比例为1t 废水加入0.3t 硝化污泥时,其生物质浓度峰值最高,时间阈值也最短,其最终反应效率也最高。
综合降解报告分析结果,在35℃环境下,使用对应污染物构成的硝化颗粒,1t 废水加入0.3t 硝化颗粒后,其可以在5d 时间阈值周期内,实现使NH3-N 废水中NH3-N 污染物浓度降至71%的污水处理效果。此时应当将NH3-N 废水转移到下一步反应容器内,更换对应该污水成分的硝化颗粒对污水进行处理。即在理论上,第1 级处理结束后,NH3-N 污染物浓度下降至71%,第2 级处理结束后,NH3-N 污染物浓度下降至50%,第3 级处理结束后,NH3-N污染物浓度下降至36%,第4 级处理结束后,NH3-N污染物浓度下降至25%,依次类推,直至NH3-N 污染物达到排放标准。此时,控制反应条件,可以让每一级处理过程的时间阈值控制在5d 左右,即采用4级处理方案,污水的总处理时间为20d 左右。
3 结论
从上述的研究结果可以看出,不同的NH3-N 废水污染形式对应的适应性硝化颗粒生化成分有较大差异,对不同成分的NH3-N 废水需要选择针对性的硝化颗粒进行废水处理,同时在废水成分的变化过程中应选择对应的硝化颗粒进行分级废水处理,这样才能提升废水处理效率。
