黄伞栽培菌棒的真菌类杂菌多样性研究*
2021-10-14王守现荣成博宋庆港廖燕玲冯巧丽秦文韬
高 琳,王守现,刘 宇,荣成博,宋庆港,廖燕玲,3,冯巧丽,秦文韬**
(1.吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118;2.北京市农林科学院植物保护环境保护研究所北京市食用菌工程技术研究中心农业农村部华北都市农业重点实验室,北京 100097;3.百色学院农业与食品工程学院,广西 百色 533000)
食用菌兼具食用和药用价值,现已成为我国农业产业的第五大作物,在脱贫攻坚和乡村振兴过程中发挥了重要作用[1]。近年来,随着食用菌生产规模的不断扩大,食用菌菌种退化严重,生产中出菇设施、厂房老旧等问题凸显,食用菌病害发生日益严重[2]。真菌类杂菌是食用菌生产过程中的重要影响因素,污染普遍发生于食用菌制种期和发菌期,严重影响食用菌生长发育,造成其减产,现已成为制约食用菌产业健康发展的重要瓶颈[3]。
在食用菌制种期和发菌期发生普遍、危害严重的真菌类杂菌,主要来源于青霉属(Penicillium)、木霉属(Trichoderma)、毛霉属(Mucor)、链孢霉属(Neurospora)、曲霉属 (Aspergillus)、根霉属 (Rhizopus)等[3-5]。这些真菌类杂菌与食用菌菌丝竞争营养和生存空间,进而影响食用菌菌丝在培养料上的正常生长,病害发生较轻时可导致局部范围出菇少或形成斑点菇,严重时可导致整批菌种或整床培养料报废,损失严重。因此,明确食用菌生产过程中真菌类杂菌的多样性至关重要[2,6]。
黄伞(Pholiota adiposa) 又称多脂鳞伞、肥鳞伞、柳黄菇、柳蘑等,隶属于担子菌门(Basidiomycota) 伞菌纲 (Agaricomycetes) 伞菌目 (Agaricales)球盖菇科(Strophariaceae) 鳞伞属(Pholiota),是一种食药兼优且具有较高商品价值的珍稀食用菌[7]。黄伞色泽鲜艳、肉质滑嫩、香味浓郁,含有丰富的粗蛋白、粗多糖、氨基酸、维生素、微量元素及其他营养物质,且脂肪含量较低,是理想的绿色食品,具有很好的商业开发价值[8]。但与其他食用菌相比,黄伞生产过程中更易受杂菌污染,特别是在发菌期间,菇房不洁净、湿度大易导致真菌类杂菌污染的发生。当前,关于导致黄伞栽培菌棒污染的真菌类杂菌多样性的研究不足,缺乏抗杂性强的黄伞优良品种,缺少有效的综合防控措施。
通过对黄伞栽培生产过程中导致菌棒污染的真菌类杂菌进行分离、纯化、鉴定,明确不同黄伞菌株的抗杂性和其污染栽培菌棒上真菌类杂菌的多样性,以期为黄伞生产过程中真菌类杂菌的防治奠定基础。
1 材料与方法
1.1 供试材料
研究收集了课题组前期制作的25株黄伞菌株的污染栽培菌棒。黄伞菌株栽培菌棒的配方为棉籽壳50%、木屑30%、麦麸18%、石灰2%,含水量为67%。
1.2 主要试剂
真菌基因组DNA提取采用植物基因组DNA提取试剂盒,天根生化科技(北京)有限公司;琼脂糖凝胶电泳DNA Marker(1 kb Plus DNA Ladder),天根生化科技(北京)有限公司;PCRMix聚合酶,日本Takara公司;琼脂糖,美国Life Technologies公司。
1.3 主要仪器
DYY-6C型电泳仪,北京六一仪器厂;S1000TM PCR扩增仪、凝胶呈像系统,美国Bio-Rad公司产品。
1.4 培养基
PDA综合培养基:去皮土豆200 g煮熟取滤液,葡萄糖20 g、琼脂20 g、磷酸二氢钾3 g、无水硫酸镁1.5 g、蛋白胨5 g、维生素B110 mg,去离子水定容至1 L。
1.5 试验方法
1.5.1 不同黄伞菌株栽培菌棒污染情况调查
课题组前期制作了25株黄伞菌株的栽培菌棒,每个菌株30棒,共计750棒,在黄伞栽培菌棒菌丝生长12 d后检查污染情况。污染率(P,%)的计算公式为:
P=N/M×100%
式中:N为污染的菌棒数量(棒);M为该菌株栽培菌棒总数量(棒)。
1.5.2 不同黄伞菌株污染菌棒上真菌类杂菌的分离与纯化
挑选黄伞栽培污染菌棒31棒,使用75%酒精擦拭菌棒表面,用无菌手术刀于污染部位划开小口,挑取适量真菌类杂菌置于PDA综合培养基上,置于25℃黑暗培养;待菌落长至合适大小时挑取部分菌丝置于新的PDA综合培养基上,25℃黑暗培养,用于后续的DNA提取及菌株保藏。
1.5.3 不同黄伞菌株污染栽培菌棒上真菌类杂菌的多样性分析
根据基因组DNA提取试剂盒说明书提取真菌类杂菌的基因组DNA,并以此作为模板,采用通用引物 ITS4 (5’-TCCTCCGCTTATTGATATGC-3’) 和ITS5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’) 对ITS序列进行PCR扩增。扩增体系(50 μL):DNA模板2 μL,2×PCR Mix 25 μL,引物(10 μmol·L-1)各 2 μL,ddH2O 19 μL。PCR 反应条件为:95℃预变性 5 min,95℃变性30 s,55℃退火45 s,72℃延伸2 min,35个循环;72℃延伸10 min,4℃终止反应。取PCR产物5 μL经1%琼脂糖凝胶电泳检测后,将合格PCR产物送至北京诺赛公司测序。测序结果在GenBank数据库中进行BLAST比对,相似度高于97%则认为是同一个种[9]。
2 结果与分析
2.1 不同黄伞菌株栽培菌棒污染情况
为明确不同黄伞菌株栽培菌棒的污染情况,评价不同黄伞菌株的抗杂性,各菌株污染率统计见图1。
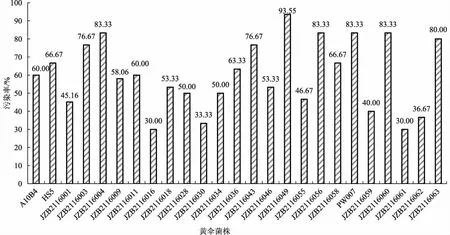
图1 25个黄伞菌株栽培菌棒的污染情况Fig.1 Contamination of the artificial bed-logs of 25 Pholiota adiposa strains
由图1结果显示,25个黄伞菌株的栽培菌棒发生真菌类杂菌污染的情况存在较大差异,说明不同黄伞菌株的抗杂性存在差异,其中菌株JZB2116049栽培菌棒的污染率最高,达93.55%;其次是菌株JZB2116060、PW007、JZB2116056、JZB2116004 的栽培菌棒,污染率为83.33%;菌株JZB2116061和菌株JZB2116016栽培菌棒的污染率最低,说明这两个菌株抗杂性最强,可在后期黄伞优异种质资源评价与黄伞的工厂化生产中重点考察。
2.2 不同黄伞菌株栽培菌棒真菌类杂菌的分离与鉴定
利用传统的分离培养方法对不同黄伞菌株栽培菌棒上的真菌类杂菌进行分离、纯化,从25株黄伞菌株的31个污染栽培菌棒中共分离出纯培养菌株67株,其形态学特征和ITS序列信息统计分析结果见表1。
由表1可知,真菌类杂菌中青霉属的分离比例最高,为41.53%(27株);曲霉属的分离比例为38.46%(25株);木霉属的分离比例为12.31%(8株);阿姆斯特丹散囊菌(Eurotium amstelodami)、耐盐枝孢菌 (Cladosporium halotolerans)、轮枝菌(Lecanicillium sp.)、疣孢篮状菌(Talaromyces verruculosus) 等各1株~2株。

表1 供试黄伞菌株及其栽培菌棒上分离得到的真菌类杂菌信息Tab.1 Information of the tested Pholiota adiposa strains and their contaminated fungi isolated from the artificial bed-logs of the tested Pholiota adiposa strain
2.3 不同黄伞菌株栽培菌棒真菌类杂菌的多样性
不同黄伞菌株栽培菌棒真菌类杂菌的多样性分析结果见表2。
由表2可知,不同黄伞菌株污染栽培菌棒上真菌类杂菌的种类存在差异。在众多真菌类杂菌中,青霉属造成的黄伞栽培菌棒污染具有普遍性,如桔青霉(P.citrinum) 可污染JZB216030、JZB216011、JZB216016等黄伞菌株,而曲霉属和木霉属仅对部分黄伞菌株栽培菌棒的污染率较高,如黄曲霉(A.flavus)对JZB216049菌株的污染率高达93.55%;赭曲霉(A.ochraceus) 对PW007菌株的污染率高达83.33%。抗杂性较强的菌株JZB216061和JZB216016均只被桔青霉(P.citrinum)污染。
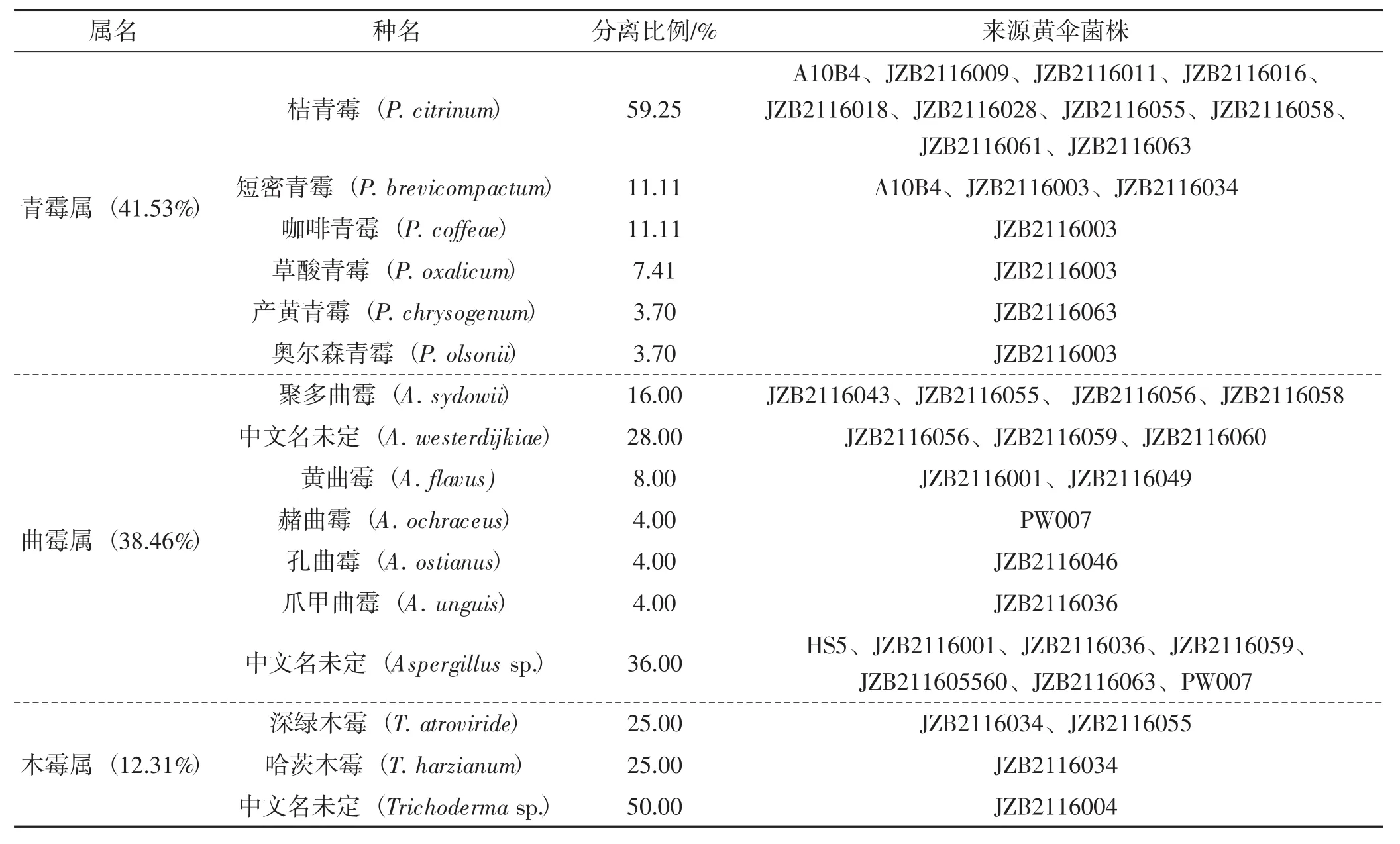
表2 分离得到的主要真菌类杂菌对不同黄伞菌株栽培菌棒的污染情况Tab.2 Aggressiveness of contaminated fungi isolated to the artificial bed-logs of different Pholiota adiposa strains
从黄伞JZB216003菌株污染栽培菌棒上分离出的真菌类杂菌最多,共分离得到了4种青霉,其株数与种类均多于其他24个黄伞菌株;污染率较高的4个黄伞菌株(JZB2116060、PW007、JZB2116056、JZB2116004)污染栽培菌棒上分离得到的真菌类杂
菌多为曲霉和木霉,如菌株JZB21160污染菌棒上分离得到的真菌类杂菌来自于2个属,曲霉属的A.westerdijkiae、Aspergillus sp.以及篮状菌属中的疣孢篮状菌(T.verruculosus),菌株PW007污染菌棒上分离得到的真菌类杂菌为曲霉属中的赭曲霉(A.ochraceus)和未鉴定种(Aspergillus sp.),菌株JZB2116056污染菌棒上分离得到的真菌类杂菌为曲霉属中的聚多曲霉(A.sydowii)和A.westerdijkiae,菌株JZB2116004污染菌棒上分离得到的真菌类杂菌为木霉属的未鉴定种(Trichoderma sp.)。
不同真菌类杂菌对黄伞菌株栽培菌棒的污染能力存在较大差异。青霉属中,桔青霉(P.citrinum)在10株不同黄伞菌棒上均能分离得到,短密青霉(P.brevicompactum) 在3株不同黄伞菌棒上分离得到,咖啡青霉(P.coffeae)、草酸青霉(P.oxalicum)和奥尔森青霉(P.olsonii)均只在黄伞菌株JZB2116003的栽培菌棒中分离得到,产黄青霉(P.chrysogenum)只在黄伞菌株JZB2116063的栽培菌棒中分离得到;曲霉属中,聚多曲霉(A.sydowii)在4株不同黄伞菌棒上分离得到,A.westerdijkiae在3株不同黄伞的栽培菌棒上分离得到,黄曲霉(A.flavus) 在2株不同黄伞菌棒上分离得到,赭曲霉(A.ochraceus) 只在黄伞菌株PW007的栽培菌棒中分离得到、孔曲霉(A.ostianus) 只在黄伞菌株JZB2116046的栽培菌棒中分离得到,爪甲曲霉(A.unguis) 只在黄伞菌株JZB2116036的栽培菌棒中分离得到;木霉属中,深绿木霉(T.atroviride) 在2株不同黄伞菌株(JZB2116034和JZB2116055) 的栽培菌棒上分离得到,哈茨木霉(T.harzianum) 只在黄伞菌株JZB2116034的栽培菌棒中分离得到。
此外,由于真菌类杂菌形态复杂,且单基因序列信息存在局限性,部分菌株很难鉴定到种,需要进一步结合多基因序列分析确定其分类地位。
3 讨论
通过传统分离培养方法研究了不同黄伞菌株污染栽培菌棒上真菌类杂菌的多样性,结果显示,发菌期间发生普遍、危害严重的真菌类杂菌主要有木霉属、青霉属及曲霉属三大类,这与前人研究结果表明食用菌生产上主要的真菌类杂菌包括木霉属、青霉属和曲霉属相吻合[3-4,10-11]。目前已知的能引起食用菌病害的木霉主要有8种[2,12-13]、青霉有13种[14-15]、曲霉有 8 种[2,4-5,16-18];对黄伞菌株污染栽培菌棒上真菌类杂菌的研究结果显示,能够污染黄伞栽培菌棒的主要真菌类杂菌有2种木霉、6种青霉、7种曲霉,且不同真菌类杂菌对黄伞菌株栽培菌棒的污染能力存在差异,如桔青霉(P.citrinum) 在黄伞栽培菌棒中污染最普遍,可污染10个不同黄伞菌株的栽培菌棒。因此在真菌类杂菌防控时应考虑杂菌的种类,对症采取措施,避免延误防控时机,造成损失。
4 结论
不同黄伞菌株的抗杂性存在差异,其中菌株JZB216061和菌株JZB216016的抗杂性较强,具有开发潜力;菌株JZB216003抗杂性最差,分离获得的真菌类杂菌的株数与种类最多。青霉属、曲霉属和木霉属是造成黄伞栽培菌棒污染的主要真菌类杂菌,其中青霉污染最为普遍,曲霉和木霉仅对部分黄伞菌株栽培菌棒的污染率很高。不同真菌类杂菌对黄伞菌株栽培菌棒的污染能力存在较大差异。因此,在黄伞栽培过程中,应差异化防控相应的真菌类杂菌,重点防控污染普遍的真菌类杂菌。在本研究中,桔青霉(Penicillum citrinum) 在黄伞栽培菌棒中的污染最普遍,甚至抗杂性较强的菌株JZB216061和菌株JZB216016也被其污染。因此,在栽培过程中应重点防护,但这两株黄伞的抗杂机制及其与桔青霉的互作机制还有待进一步研究。本文的研究结果将为黄伞安全生产及其栽培菌棒上真菌类杂菌的防控及黄伞的工厂化生产提供理论数据。
