双氢青蒿素对三阴性乳腺癌MDA-MB-231细胞的抑制作用及其机制
2021-10-14周晓艳肖姗姗
李 越,董 炜,周晓艳,尹 阳,2,肖姗姗,3,何 谦
(1.西安交通大学第二附属医院检验科,陕西西安 710004;2.西电集团医院检验科,陕西西安710002;3.空军军医大学唐都医院儿科,陕西西安 710038)
乳腺癌是威胁全球女性健康和生存的常见疾病,发病率已占据女性恶性肿瘤的首位[1]。目前,对乳腺癌转移的治疗仍缺乏明显的突破,针对三阴性乳腺癌的治疗也缺乏有效的手段。近年研究发现,青蒿素及其衍生物可抑制肿瘤细胞增殖,诱导凋亡,诱导细胞周期停滞和抑制血管生成[2-5],但其抑制肿瘤发展和转移的机制尚未完全阐明。本课题组之前的研究发现,双氢青蒿素(dihydroartemisinin,DHA)可以抑制乳腺癌MCF-7细胞生长。生物信息学结果提示,TGF-β1与CIZ1之间 存 在 蛋白 质 相 互作 用 关 系[6]。因此,本研究将重点研究DHA对三阴性乳腺癌MDA-MB-231细胞系的抑制作用及其分子机制,为后续癌症机制的实验研究和三阴性乳腺癌治疗靶标的探索提供理论基础,并为研发青蒿素等天然产物抗肿瘤新药提供理论依据。
1 材料与方法
1.1 材料高侵袭转移性的三阴性乳腺癌MDAMB-231细胞系由西安交通大学第一附属医院肿瘤科惠赠。DHA购自合肥巴斯夫生物有限公司(BOSF),重组TGF-β1因子(HEK293 derived)购自美国PeproTech公司,选择性TGF-β1/Smads通路抑制剂SD208购自上海碧云天生物公司(Beyotime),Trizol试 剂 购 自 美 国Thermal Fisher公 司,Prime⁃ScriptTMRT Reagent kit购自大连宝生物公司(TaKaRa),SYBR Green荧光定量super mix购自北京全式金生物有限公司(TransGen),兔抗人CIZ1抗体购自武汉爱博泰克公司Abclonal,兔抗人TGF-β1及兔抗人snail购自 美国Abcam公司,兔抗 人p-smad2/3及兔抗人t-smad2/3购自Cell Signaling Technology,鼠抗人GAPDH购自美国Origene公司。引物(Primer)由北京鼎国昌盛生物技术有限公司设计并合成。
1.2 方法
1.2.1MDA-MB-231细胞培养人乳腺癌细胞株MDA-MB-231培养于含100 mL/L小牛血清的1640培养基中,37℃、50 mL/L CO2培养箱中培养至对数生长期。
1.2.2CCK-8法检测细胞增殖情况当细胞进入对数生长期后分组,行不同干预措施。实验组加入含20、40、60、80、120 μmol/L DHA的完全培养液,对照组仅为不含药的完全培养基。每个药物浓度有4个平行复孔,分别继续培养细胞24 h或48 h。经CCK-8溶液处理后在450 nm波长处测定吸光度(A)值,计算细胞生长抑制率(IR)和药物半数致死量(IC50)。
1.2.3实时荧光定量PCR(qRT-PCR)检测DHA对CIZ1、Snail及TGF-β1 mRNA表达的影响药物处理细胞48 h后,得到细胞总RNA并转录得到其cDNA,采用荧光定量试剂进行qRT-PCR反应。反应程序:95℃预变性30 s,后运行95℃变性5 s,60℃退火30 s,循环40次。设计 的引物如下。CIZ1基 因Primer F:ATATCCAGAGAGGAGTGGAAGG,Primer R:GGCAGATGCGGCAGATATAG;TGF-β1基 因Primer F:CGTGGAGCTGTACCAGAAATAC,Primer R:CACAACTCCGGTGACATCAA;Snail基因Primer F:TCGGAAGCCTAACTACAGCGA,Primer R:AGATGAGCATTGGCAGCGAG;GDAPH基因Primer F:GGAGCGAGATCCCTCCAAAAT,Primer R:GGCTGTTGTCATACTTCTCATGG。以2-ΔΔCT法进行数据分析,样本平均CT值表示qRT-PCR扩增结果。
1.2.4Western blotting检测DHA对CIZ1、Snail及TGF-β1蛋白表达的影响药物处理细胞48 h后,按照总蛋白抽提试剂盒说明书操作提取蛋白质,将待测蛋白质样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离、转膜以及封闭后,加入一抗,4℃过夜后弃去一抗,加入辣根过氧化物酶偶联的二抗,室温孵育2 h后化学发光试剂显色、凝胶成像系统曝光显影,扫描结果并通过软件分析蛋白条带。
1.2.5划痕实验检测细胞迁移能力选用于对数生长期的细胞,将稀释后的细胞悬液移入6孔培养板,待细胞贴壁且融合约95%后,在孔内进行垂直划线,在各组加入含药的5 mL/L胎牛血清的RPMI 1640培 养 基:5 ng/mL TGF-β1因 子、5 ng/mL TGF-β1+40 μmol/L DHA、5 ng/mL TGF-β1+80 μmol/L DHA、5 ng/mL TGF-β1+0.5 μmol/L SD208、5 ng/mL TGF-β1+0.25 μmol/L SD208+40 μmol/L DHA。行不同干预措施后,培养48 h,分别于0、12、24、48 h在倒置显微镜下查看划痕区并拍照。
1.2.6Transwell侵袭实验检测细胞侵袭能力在Transwell小室中添加稀释好的基质胶,37℃孵育过夜成胶。在小室中加入细胞悬液,具体分组同1.2.5项所述。下室加入含药的150 mL/L胎牛血清的RPMI 1640培养基,行不同处理后继续培养16 h,使用结晶紫进行染色观察。
1.2.7统计学分析实验数据以(±s)表示,用GraphPad Prism 7.0作图,运用SPSS 18.0软件计算分析统计学差异。两组间均数比较采用t检验,3组以上的多组间均数比较采用单因素方差分析;当多组(≥3组)间差异总体具有统计学意义时,通过Dunnett法进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 DHA抑制乳腺癌MDA-MB-231细胞增殖利用CCK-8试验检测不同浓度DHA对人乳腺癌细胞增殖能力的影响,选用三阴性乳腺癌MDAMB-231细胞进行实验。结果显示,对照组细胞生长活跃,细胞增殖明显;经DHA处理后,细胞增殖活性受到药物浓度依赖性抑制(表1),说明DHA能够明显抑制MDA-MB-231细胞增殖。24、48 h处理后,DHA抑制MDA-MB-231细胞增殖的IC50分别为57.40、39.28 μmol/L。
表1 DHA对乳腺癌细胞MDA-MB-231细胞增殖的影响Tab.1 Effect of dihydroartemisinin on the proliferation of breast cancer cell MDA-MB-231 (±s,n=4)

表1 DHA对乳腺癌细胞MDA-MB-231细胞增殖的影响Tab.1 Effect of dihydroartemisinin on the proliferation of breast cancer cell MDA-MB-231 (±s,n=4)
与同处理时间的对照组比较,**P<0.01。
?
2.2 DHA抑制乳腺癌细胞CIZ1、TGF-β1、Snail转录和蛋白表达为探讨DHA抑制乳腺癌进展的潜在分子机制,使用qRT-PCR和Western blotting检测DHA对MDA-MB-231细胞TGF-β1/Smads信号通路和核基质蛋白CIZ1分子的影响。结果显示,DHA能够在mRNA表达水平上明显抑制TGF-β1/Smads信号通路核心分子TGF-β1、Snail和CIZ1的表达,且抑制效应呈剂量依赖性(图1A)。40 μmol/L DHA干预48 h,对TGF-β1、Snail和CIZ1蛋白表达水平的抑制率分别为60.18%、59.43%和52.29%(图1B)。DHA呈剂量依赖性地抑制TGFβ1、Snail和CIZ1蛋白的表达水平。

图1 TGF-β1信号通路和CIZ1参与DHA的抗肿瘤机制Fig.1 TGF-β1 signaling pathway and the role of CIZ1 as the antitumor mechanisms of dihydroartemisinin
2.3 DHA逆转TGF-β1诱导的乳腺癌细胞侵袭力增强效应多项研究表明,外源施加TGF-β1因子后,肿瘤细胞的侵袭和迁移能力均得到增强,这可能与TGF-β1因子诱导EMT过程促进肿瘤转移的作用有关[7]。通 过 添 加5 ng/mL TGF-β1,TGF-β1因 子明显增强了MDA-MB-231细胞的侵袭能力(图2)。基于DHA与TGF-β1信号通路和CIZ1的调控关系,本研究进一步探讨了DHA和TGF-β1通路抑制剂SD208对TGF-β1诱导的细胞转移力增强效应的影响,以及DHA和SD-208联合治疗(更低剂量的两种药物同时处理)的应用可能性。
Transwell实验表明,与TGF-β1处理的高侵袭性 细 胞 相 比,40、80 μmol/L DHA能 够 明 显 抑 制MDA-MB-231细胞侵袭(图2),其侵袭抑制率分别为(21.1±4.1)%、(33.6±3.5)%。结果表明,DHA以剂量依赖性的方式抑制乳腺癌细胞侵袭,逆转TGF-β1诱导的高侵袭力现象。而SD-208或联合方案均显示出明显的侵袭抑制潜能(图2),对MDA-MB-231细胞的抑制作用分别为(37.0±3.3)%、(52.3±2.5)%。

图2 对照组、TGF-β1处理的高侵袭性细胞及实验组侵袭细胞数目的定量统计结果Fig.2 Quantitative statistical results of the TGFβ1-treated highly invasive cells and corresponding experimental group cells
2.4 DHA逆转TGF-β1诱导的细胞迁移力增强效应同2.3项所述,外源应用TGF-β1因子显著增强乳腺癌细胞侵袭(图2)和迁移能力(图3),提高了乳腺癌的转移能力。与TGF-β1诱导相比,40、80 μmol/L DHA能够明显降低其迁移能力,其迁移抑制率分别为(39.6±5.6)%、(56.6±4.0)%。表明DHA呈剂量依赖性抑制乳腺癌细胞的迁移能力,发挥出对TGF-β1诱导的高迁移力现象的逆转效果。SD-208处理对TGFβ1诱导的MDA-MB-231细胞的迁移抑制率为(55.8±4.1)%,而联合处理组对其迁移抑制率为(71.95±2.6)%。表明SD-208或联合方案均能明显抑制乳腺癌细胞迁移,联合处理组表现出更优的抗转移效果。

图3 对照组、TGF-β1处理的高迁移性细胞及实验组划痕面积变化的定量统计结果Fig.3 Quantitative statistical results of changes in wound area in the TGFβ1-treated high migratory cells and correspond⁃ing experimental groups
2.5 TGF-β1/Smads通路对DHA抗转移机制的影响如图4所示,外源添加TGF-β1因子,Smad2/3蛋白的磷酸化水平和Snail蛋白表达明显高于对照组,提示细胞TGF-β1/Smads通路激活;通路抑制剂SD-208处理细胞,Smad2/3蛋白磷酸化水平和Snail表达降低。因此,促进或抑制TGF-β1/Smads通路活性,使用Western blotting评估MDA-MB-231细胞中CIZ1、P-Smad2/3等蛋白表达水平,从而反映DHA调节三阴性乳腺癌转移的分子机制。与TGF-β1诱导的高转移性细胞相比,DHA能明显下调CIZ1和Snail表达及Smad2/3蛋白的磷酸化水平(P<0.05)。DHA呈剂量依赖性抑制TGFβ1/Smads信号通路和CIZ1表达。SD-208以及联合处理组均能明显抑制CIZ1、Snail、磷酸化Smad2/3蛋白表达(P<0.05)。
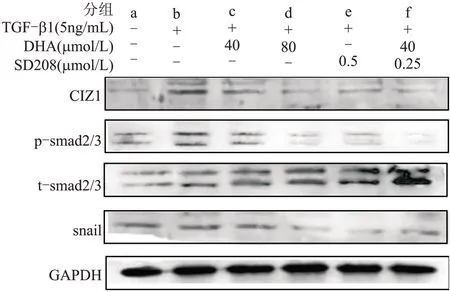
图4 促进/抑制TGF-β1通路,Western blotting检测DHA对MDA-MB-231细胞CIZ1、Smad2/3、Snail蛋白表达的影响Fig.4 Promotion/inhibition of the TGF-β1 pathway and the effects of dihydroartemisinin on CIZ1,Smad2/3 and Snail pro⁃tein levels in MDA-MB-231 cells detected by Western blotting
此外,与对照组相比,TGF-β1处理明显增强了MDA-MB-231细胞CIZ1蛋白的表达,差异有统计学意义(P<0.01);与TGF-β1处理组相比,而SD-208处理则明显下调CIZ1表达(P<0.01)。提示TGF-β1-Smad信号通路和CIZ1之间有紧密的调节关系,并且TGF-β1诱导的肿瘤细胞转移增强现象与TGFβ1/Smads和CIZ1信号通路密切相关。
3 讨 论
乳腺癌是威胁全球女性健康和生存的常见疾病[1,8]。尽管手术和放疗、化疗等治疗手段不断进步,但其复发及转移仍是乳腺癌患者死亡的主要原因,尤其是针对三阴性乳腺癌的治疗尚缺乏有效的手段,成为乳腺癌治疗的主要障碍。
DHA、青蒿琥酯是青蒿素的常见衍生物,已成为一种高效、耐受性良好的抗疟药[9]。青蒿素及其衍生物的抗癌作用极具应用前景,但其作用和分子机制尚未完全证实和阐明。研究表明,青蒿素及其衍生物可通过多种信号转导途径诱导癌细胞DNA损伤和凋亡、促进癌细胞周期阻滞、抑制肿瘤血管生成、抑制上皮间质转换(EMT)过程等,发挥一定的抗肿瘤效果[2-5]。青蒿琥酯呈剂量依赖性诱导DNA双链断裂(DSB),促进癌细胞DHA损伤,进而促进癌细胞死亡[10]。在不同的细胞模型中,青蒿素及其衍生物可以诱导细胞内源性、线粒体和外源性的Fas受体驱动的凋亡通路。DHA处理肺腺癌ASTC-a-1细胞,引发Bax移位和线粒体膜去极化、细胞色素c释放,caspase-9/8/3活化,证明了DHA通过caspase-8/Bid激活和线粒体途径诱导细胞凋亡[11]。有研究也证明了青蒿素及其衍生物可以在多种肿瘤细胞系中抑制细胞侵袭和转移[12]。例如,青蒿琥酯可以明显抑制非小细胞肺癌细胞系侵袭能力,其主要机制与下调MMP-2和MMP-7表 达 有 关[13]。
研究表明,EMT与肿瘤细胞侵袭转移能力密切相关,EMT过程的出现通常预示肿瘤恶性改变,并受到Snail、Slug和Twist等转录因 子 和TGF-β等多 通路的调控[14]。LI等[15]就报道了DHA能够明显抑制Snail、Slug和Twist的表达,促进E-cadherin表达,从而抑制卵巢癌EMT过程,发挥出抑制卵巢癌细胞迁移和侵袭的作用。已有研究证明,青蒿素类化合物在多个肿瘤细胞系中均可以上调E-cadherin蛋白表达水平,抑制间质标志物Vimentin、N-cadherin水平[2,16],说明了DHA对肿瘤EMT的抑制能力。
DHA等抗癌化合物的广谱抗癌特性,其分子机制较复杂。关于青蒿素及其衍生物的一些相关研究集 中 在 其 对WNT/β-catenin、MAPK/ERK、PI3K/AKT途径的调控[2,17-18]。目前看来,关于青蒿素及其衍生物调控肿瘤转移的分子机制,以及其如何通过信号通路调节癌细胞转移,还有待进一步探索。本课题组前期已经在乳腺癌MCF-7细胞中探讨了DHA和TGF-β1信号通路、核基质蛋白CIZ1的调控关系[6]。本研究使用了具有更高转移能力的三阴性乳腺癌MDA-MB-231细胞,从而重点探究DHA抗乳腺癌转移的作用及其分子机制。本研究发现,DHA能够抑制MDA-MB-231细胞增殖、迁移和侵袭,逆转TGF-β1诱导的乳腺癌细胞转移增强效应,并且抑制CIZ1、Snail和磷酸化Smad2/3蛋白的表达水平。
有研究表明,TGF-β1通路主要通过Smads依赖性途径调节细胞增殖、凋亡、血管生成和EMT等,从而调节肿瘤发展和转移[19]。核基质蛋白CIZ1可能在肿瘤发生发展及其恶性进展中发挥重要作用,高表达的CIZ1增强肿瘤细胞迁移、侵袭能力,提示CIZ1可能成为癌症转移的有效诊疗靶点[20-21]。在对其机制的探索中,ZHANG等[22]表明,CIZ1与转录因子TCF4相互作用,激活WNT通路,从而上调通路下游靶点c-Myc、Snail和cyclin D的转录,促进胆囊癌细胞的增殖和迁移。本研究表明,DHA通过抑制TGF-β1/Smads信号通路和核基质蛋白CIZ1,发挥抑制三阴性乳腺癌细胞增殖转移能力的作用。
同时,本研究发现,在MDA-MB-231细胞中,核基质蛋白CIZ1在TGF-β1诱导后升高,而在TGF-β 1/Smads信号通路抑制剂干预时表达水平降低,表明TGF-β1/Smads通路与CIZ1具有密切的调节关系,从而初步证实了TGF-β1/Smads信号通路与CIZ1蛋白及其级联调控关系可能成为调控三阴性乳腺癌发生发展和转移过程的新作用机制。当然,这一发现仍需要更多的实验证据。乳腺癌MDA-MB-231细胞更便于建立体内乳腺癌转移模型,并有利于探讨DHA对三阴性乳腺癌的潜在治疗前景。进一步研究DHA的抗转移作用和分子机制,从而明确乳腺癌尤其是三阴性乳腺癌的转移机制,对于肿瘤预测、早期诊断及提高治疗的成功率有着非常重要的意义。
