载miR-30a超声微泡对乳腺癌细胞上皮-间质转化进程的影响
2021-10-14叶兰凌晨
叶兰 凌晨
乳腺癌是女性最常见的恶性肿瘤,其发病率占所有恶性肿瘤的9%~10%,恶性程度与肿瘤转移是造成患者死亡的主要原因。恶性肿瘤的转移进程中上皮-间质转化(EMT)发挥着关键的调节作用,癌细胞表型发生频繁的暂时性、异质性改变,表观遗传调控可部分解释癌细胞表型灵活转变的特性,其中microRNAs(miRNAs)的转录后调控机制起着重要作用[1-2]。miR-30a可通过靶向ZEB2[3]和SLUG[4]抑制乳腺癌细胞的恶性转化以及EMT进程。超声(US)成像技术是一种实时成像技术,造影剂微泡优先分布于肿瘤中丰富的微血管,从而进行肿瘤显影[5]。近年来,超声靶向微泡破坏(UTMD)作为药物和基因的递载系统,体现出巨大的潜力,引起众多研究者的重视。笔者拟利用UTMD技术在体外研究miR-30a递载进入乳腺癌细胞后对癌细胞EMT进程的影响,现报道如下。
1 材料与方法
1.1 细胞培养 人乳腺癌细胞株MDA-MB-231购于中科院上海细胞库,细胞贴壁培养于含15%胎牛血清的L-15培养液中,在37 ℃、5% CO2的细胞恒温培养箱中常规培养。
1.2 试剂与仪器 SonoVue购于博莱科公司,细胞凋亡检测试剂盒购于碧云天生物技术公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司,Bcl-2抗体、Ki-67抗体、cl-caspase-3抗体、Vimentin抗体、N-cadherin抗体、Slug抗体、GAPDH抗体均购自美国Cell Signaling Technology公司,荧光素酶报告质粒载体由南京金斯瑞生物科技公司构建,流式细胞分析仪购自美国BD Bioscience公司,实时荧光定量PCR为瑞士Roche公司生产,Envision分析仪由美国PerkinElmer公司生产。
1.3 微泡制备和UTMD转染 SonoVue瓶内注射5 mL无菌生理盐水,振荡至全部分散。6孔板培养MCF-7细胞,按照次日达到70%接种密度进行传代培养,过夜培养后,用SonoVue进行转染,分为4组,每组3孔细胞。Cells组:无处理;Cells+US+miR-30a组:细胞中加入50 nM miR-30a,均匀分散后,以1 MHz频率、1 W/cm2辐照功率超声30 sec;Cells+MB+miR-30a组:细胞中加入等量 miR-30a,加入20%原始浓度SonoVue;Cells+UTMD+miR-30a组:细胞中加入等量miR-30a和SonoVue,以1 MHz频率、1 W/cm2辐照功率超声30 sec。
1.4 实时荧光定量PCR实验 采用SYBR Green荧光定量PCR法检测miR-30a和Slug的基因含量,严格按照Invitrogen说明书进行操作,Trizol试剂提取总RNA,经逆转录成cDNA后,对各基因表达量进行检测,引物由苏州瑞赢生物公司合成。miR-30a引物 上 游:5'-GAAGGUCAGCUCCUACAAAUGU-3',下游:5'-GAAGGUCAGCUCCUACAAAUGU-3', 以U6为内参,上游:5'-GGAACGAGAAAGATTAGC-3',下游:5'-TTGGAATTCACGAAATTCCG-3'。Slug引 物上 游:5'-TCCTGGTCAAGAAGCATT-3',下 游:5'- GAGGAGGTGTCAGATGGA-3',以ACTB为内参,上游: 5'-ACTCGTCATACTCCTGCT-3',下 游:5'-GAA ACTACCTTCAACTCC -3'。采用2-ΔΔt法计算目标基因相对内参基因的相对倍数,各实验均重复3次。
1.5 细胞凋亡检测 各组加药处理48 h后,采用胰蛋白酶收集悬浮细胞,按照凋亡检测试剂盒说明书操作,以流式细胞仪检测细胞凋亡百分比,计算早期、晚期凋亡率之和,实验重复3次。
1.6 目的蛋白的Western Blot检测 采用胰蛋白酶收集细胞,经细胞裂解液冰上裂解后,再经BCA试剂盒测定总蛋白浓度。每组取30 μg蛋白经变性和loading后,上样进行SDS-PAGE凝胶电泳分离,再经PVDF转膜蛋白印迹。用5%脱脂奶粉封闭后,再经一抗孵育过夜(4 ℃),再经二抗室温孵育1 h,加ECL显影液显色,再由成像分析仪测量各条带光密度,计算各条带相对内参蛋白的相对表达水平。
1.7 双荧光素酶报告基因实验 根据miR-30a和Slug 3'-UTR结合位点设计wt Slug 3'-UTR和mut Slug 3'-UTR,克隆至荧光素酶报告质粒载体psiCHECK2上,然后将其和miR-30a mimic、miR-NC共同转染到MDAMB-231细胞中,按照lipofectamin3000试剂盒说明书进行操作。转染24 h后,检测海肾荧光素酶活性和萤火虫荧光素酶活性,按照双荧光素酶报告基因检测试剂盒说明书操作,计算萤火虫荧光素酶与海肾荧光素酶活性值的比值,作为miR-30a同Slug的结合力。
1.8 Transwell细胞侵袭实验 采用胰蛋白酶消化各组细胞,调整至105个/孔,每个小室的上室(含基质胶)内加入100 μL细胞,下室内加入700 μL完全培养液,过夜培养后用棉签拭去上室上表面细胞,下表面经甲醇固定、结晶紫染色后封片,显微镜下计数下表面附着的细胞,并计算相对侵袭力。
2 结果
2.1 UTMD转染效率鉴定 采用qRT-PCR技术鉴定各组miR-30a的表达水平,结果显示Cells+UTMD+miR-30a组的miR-30a表达水平明显高于其他各组,差异有统计学意义(P<0.05),而Cells组、Cells+US+miR-30a组、Cells+MB+miR-30a组之间miR-30a水平无统计差异(P>0.05)。见图1。
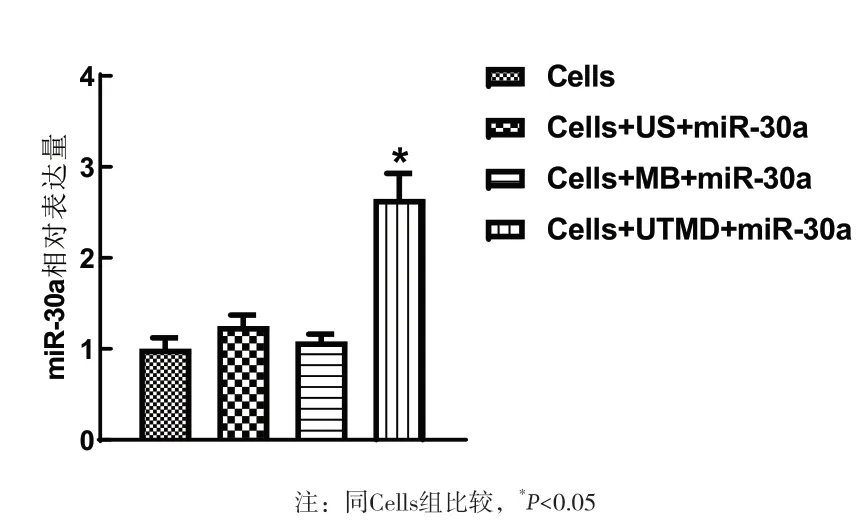
图1 4组MCF-7细胞中miR-30a的表达水平
2.2 UTMD递送的miR-30a促进MCF-7细胞凋亡 细胞凋亡结果显示,Cells组、Cells+US+miR-30a组、Cells+MB+miR-30a组、Cells+UTMD+miR-30a组 的细 胞 凋亡率分别为(3.2±1.4)%、(4.8±2.1)%、(3.5±1.1)%、(20.2±3.2)%,Cells+UTMD+miR-30a组的细胞凋亡率显著高于其余各组,差异有统计学意义(P<0.05),其余三组之间无统计学差异(P>0.05),见图2A。进一步检测各组的凋亡相关和增殖相关蛋白表达,可见癌基因Bcl-2和增殖相关基因Ki-67的蛋白表达水平在Cells+UTMD+miR-30a组中明显降低,凋亡执行者cl-caspase-3的蛋白表达水平在Cells+UTMD+miR-30a组中明显增加,与其余三组比较,差异均有统计学意义(P<0.05),而3个蛋白的表达水平在其余三组中比较无统计学差异(P>0.05),见图2B。
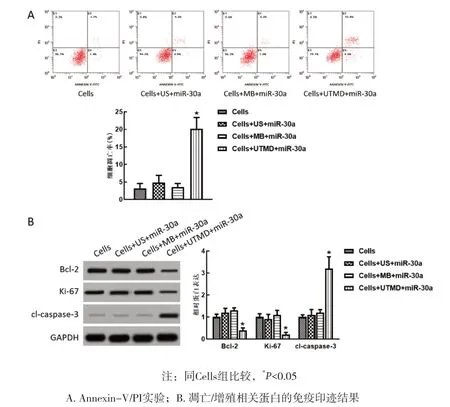
图2 4组MCF-7细胞凋亡水平和凋亡/增殖相关蛋白的表达
2.3 miR-30直接靶向结合Slug 首先采用miRanda、miRWalk和TargetScan预测miR-30a和Slug的靶向结合位点,Slug 3'-UTR包含两处进化保守的结构域,同miR-30a具有互补性,然后对Slug 3'-UTR的结合位点进行突变,见图3A,通过双荧光素酶实验证实,同时转染miR-30a mimic和Slug-wt的细胞的荧光素酶活性最低,同其他转染组相比差异具有统计学意义(P<0.05),见图3B。进一步用UTMD递送miR-30a,并检测细胞中Slug的基因表达水平,可见同Cells组、Cells+US+miR-30a组、Cells+MB+miR-30a组相比,Cells+UTMD+miR-30a组的Slug基因表达水平明显降低,差异具有统计学意义(P<0.05),见图3C。
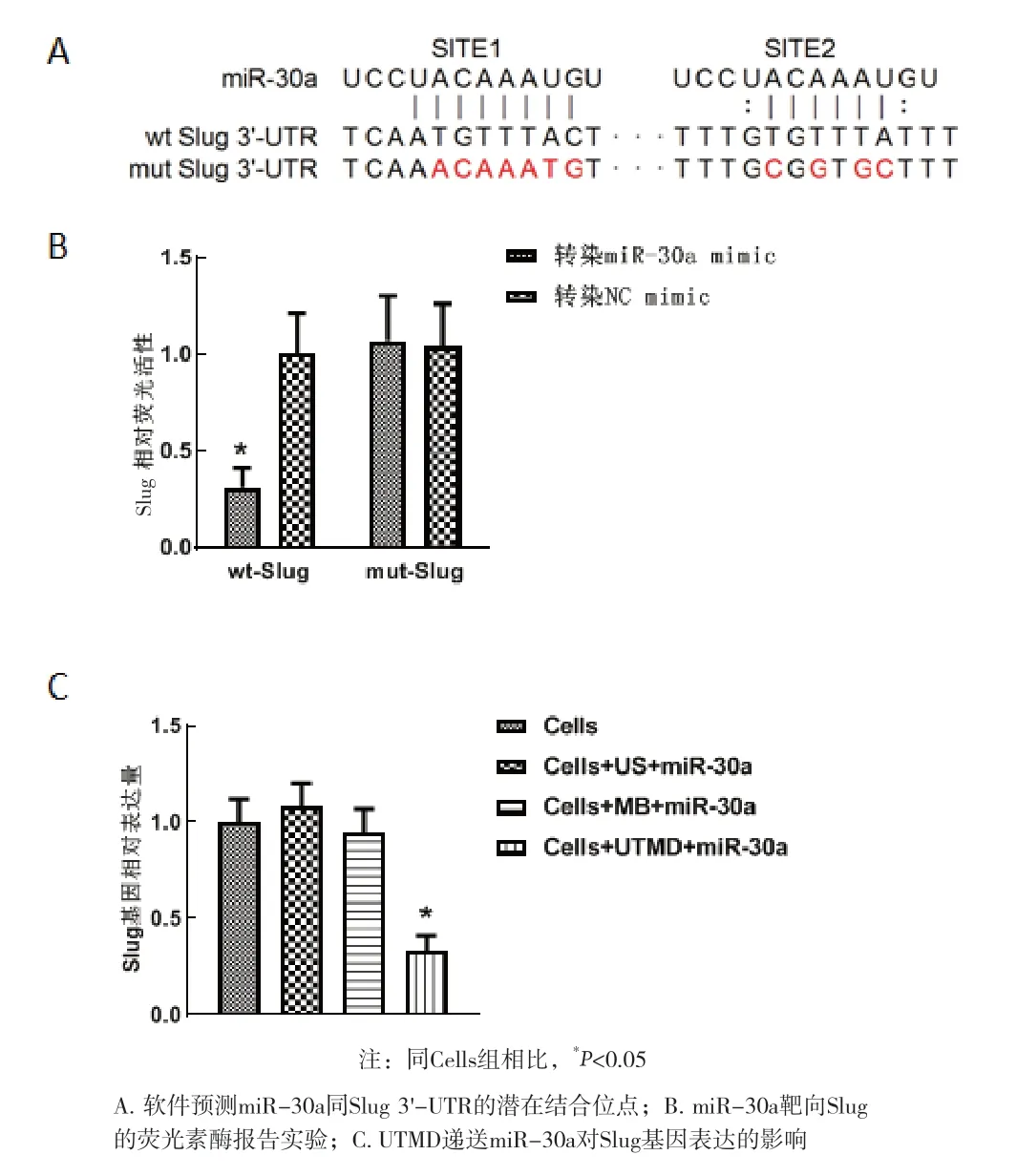
图3 miR-30a同Slug 3'-UTR的靶向关系检测
2.4 miR-30抑制细胞侵袭和EMT 与Cells组相比,Cells+UTMD+miR-30a组的细胞侵袭力显著降低(P<0.05),而Cells+US+miR-30a组、Cells+MB+miR-30a组无显著变化(P>0.05),见图4A。进一步对EMT进程标志蛋白Vimentin和N-cadherin的蛋白表达水平进行检测,可见Cells+UTMD+miR-30a组中,Vimentin和N-cadherin的蛋白表达水平明显降低,差异有统计学意义(P<0.05),而其余3组比较差异无明显统计学差异(P>0.05),同时,Cells+UTMD+miR-30a组的Slug蛋白表达水平也显著降低(P<0.05)。
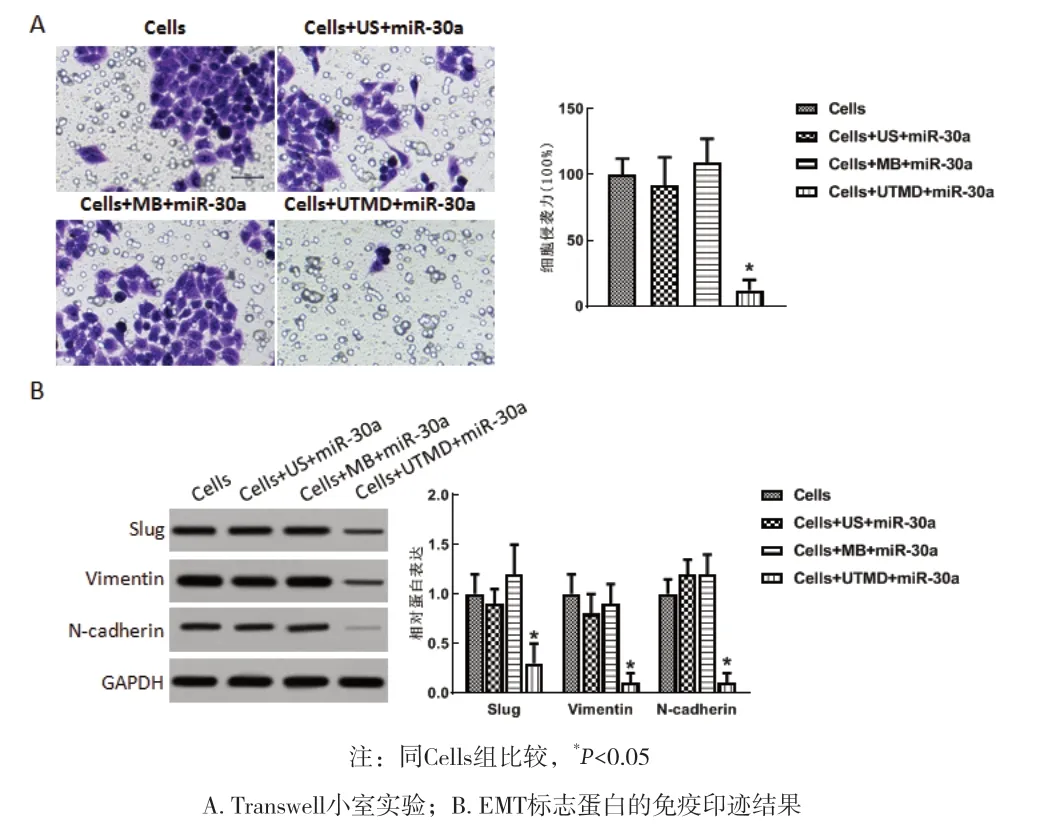
图4 4组MCF-7细胞侵袭能力和EMT能力检测
3 讨论
乳腺癌的主要治疗方式包括手术、放化疗、靶向治疗和内分泌治疗等,肿瘤转移是导致复发、治疗失败的主要原因,25%~50%的乳腺癌患者最终会出现转移,从而增加死亡风险[6],故而乳腺癌的转移机制研究是研发治疗药物的基础。随着基因技术的发展,基因治疗有可能成为治疗乳腺癌的有效方法之一,但体内基因转染的方法具有一定局限性,病毒虽然转染效率高,但容易发生脱靶反应,有着安全性的疑虑;而质粒的分子量巨大,会造成有效剂量低、靶点效率不高。研究证实,miRNA可能对乳腺癌恶化和转移的预测、诊断、治疗及患者预后具有一定指导价值,有效剂量、靶向性等方面均具有显著优势,但受限于递送方法的影响,易被体内广泛分布的RNA酶水解。
本研究通过观察超声靶向微泡破坏(UTMD)技术递送miRNA至体外人乳腺癌细胞的效果,探讨miR-30a抑制乳腺癌细胞生存、侵袭的能力及其作用机制。结果显示,单独超声或单独微泡处理,并不能将miR-30a转染进入乳腺癌细胞,但超声和微泡联合使用时,miR-30a可被转染进入癌细胞,且其在细胞中的表达水平显著提高,说明UTMD技术可以增强基因的转染效率[7]。miR-30a表达水平的提高对乳腺癌细胞的生物功能产生一系列影响,Cells+UTMD+miR-30a组乳腺癌细胞凋亡水平上调,凋亡相关蛋白cl-caspase-3水平降低,癌基因Bcl-2蛋白和增殖相关蛋白Ki-67表达降低。研究证实,经UTMD递送后,癌细胞内上调的miR-30a对乳腺癌细胞下游凋亡和增殖通路具有一定的影响。一项慢性髓系白血病细胞株的研究显示,miR-30a高表达可促进K562细胞的凋亡[8]。综前所述,miR-30a可能具有促进癌细胞凋亡的作用。本研究通过软件预测发现,miR-30a可能同Slug 3'-UTR结合,经荧光素酶报告基因实验证实,miR-30a直接结合于Slug 3'-UTR,并且UTMD递送的miR-30a造成Slug基因表达和蛋白表达降低,证实Slug是miR-30a的靶点。Transwell实验显示,UTMD递送的miR-30a减少了MDA-MB-231的侵袭能力。进一步检测EMT标志蛋白证实,Vimentin和N-cadherin的蛋白表达水平明显降低。在EMT进程中,癌细胞逐渐丢失上皮表型,缺乏细胞-细胞间的粘附性,增强间充质特性,表现为更强的游离性,是癌细胞转移的重要机制。主要的EMT标志物包括上皮标记物(如E-cadherin)以及间充质标志物(如Vimentin、N-cadherin)[9]。Snail的过度表达是EMT发生的先决条件,而Slug属于Snail家族,在肿瘤进展过程中亦会触发EMT[10-11]。Slug抑制后可增加紧密连接蛋白CLDN表达,减少癌细胞的侵袭和转移性,发挥调节乳腺癌EMT的作用[12]。Slug还可以通过转录作用激活三叶虫FSCN基因表达,而FSCN在细胞内发挥维持丝状伪足的作用,推测miR-30a抑制的Slug下调了MDA-MB-231细胞丝状伪足的组装,造成Vimentin和N-cadherin水平降低[13]。本研究结果证实,UTMD有效的递送miR-30a进入MDA-MB-231细胞,并下调了癌细胞的EMT水平和细胞侵袭能力。
综上,UTMD是一种有效的miRNA递送方法,miR-30a对乳腺癌细胞EMT具有靶向抑制作用,UTMD可以通过递送抑癌基因成为一种基因治疗方法。
