GOLPH3与VEGF在肺腺癌中的表达及其临床意义
2021-10-13臧志意魏小东
臧志意, 魏小东
癌症是目前造成人类死亡的主要原因之一,肺癌在全球癌症发病率中占据首位,并且是癌症造成死亡的主要原因[1]。肺癌患者中临床病理类型多为腺癌,以往研究显示肺癌的发生发展受多方面因素影响,而信号通路异常激活、基因位点突变等诱导细胞的癌变是其中的重要环节之一[2]。随着新辅助治疗及手术方式的发展,患者预后不断得到改善,但仍不理想。高尔基体磷蛋白3(Golgi phosphoprotein 3,GOLPH3)参与维持高尔基体带状结构及囊泡运输等。有研究显示细胞内囊泡运输的失调是导致癌症发生的机制之一[3]。以往研究发现在肺癌、乳腺癌、神经胶质瘤中GOLPH3的过表达与患者不良预后有关[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)在促进血管生成中起着主导作用,血管的供应及新血管的生成对于机体起着至关重要的稳态作用,因为血管将营养物质输送到组织和器官并去除分解代谢产物[5]。然而,不受控制的血管生长会促进许多疾病发展,在肿瘤进展中发挥着重要的作用[6]。近期临床研究已经证实抗VEGF的药物在抗癌免疫中的作用,但在癌症治疗中VEGF靶向单一疗法会产生耐药性及局限性[7]。本研究通过探讨GOLPH3与VEGF在肺腺癌组织中的表达及对患者预后的影响,分析肺腺癌生长转移的机制,为肺癌的临床治疗提供新思路。
1 资料与方法
1.1一般资料 收集安徽医科大学无锡临床学院2015年1月至2017年6月进行手术诊治的66例肺腺癌患者的临床病理资料,其中男35例,女31例;年龄45~87(64.35±9.58)岁;Ⅰ期32例,Ⅱ期14例,Ⅲ期20例;出现淋巴结转移患者28例,未出现淋巴结转移患者38例。纳入标准:(1)术前未进行新辅助治疗患者;(2)行肺癌根治术后病理结果为肺腺癌的患者。排除标准:(1)患者于术后3个月及围手术期死亡;(2)合并其他肿瘤病史。对66例肺腺癌组织及对应的30例癌旁组织进行相关蛋白的免疫组化染色。本研究经医院伦理委员会批准。
1.2病理组织免疫组化染色 蜡块组织连续切片(约4 μm),随后进行烘片、脱蜡、脱水,3%过氧化氢溶液封闭10 min,高压抗原热修复后滴加一抗(GOLPH3和VEGF 1∶100抗体购自Proteintech公司),4°孵育过夜后滴加二抗常温孵育30 min,磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)冲洗后应用二氨基联苯胺(diaminobenzidine,DAB)显色,蒸馏水冲洗后复染,盐酸酒精分化,脱水后中性树脂封片。
1.3显微镜结果判定 GOLPH3及VEGF主要表达于细胞质中,细胞质染色为阳性。所有结果由2名高年资病理科医师于(×400)倍镜下,随机选5个视野采用半定量积分法判定结果[8]。评分标准:采用半定量积分法估计免疫阳性细胞的数量及染色程度。首先,对染色强度进行评分:无色(0分)、浅黄色(1分)、棕黄色(2分)和深棕色(3分)。其次,对阳性细胞的百分比进行评分:无阳性细胞(0分)、10%或更少阳性细胞(1分)、11%~50%阳性细胞(2分)、51%~75%阳性细胞(3分)、75%以上阳性细胞(4分)。阳性细胞染色率与染色强度得分相乘得到最终得分:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中度阳性(++),7~12分为强阳性(+++);最终得分<6分的为低表达,≥6分的为高表达[9]。
1.4随访 随访时间为3~60个月,中位随访时间为32个月。采用门诊定期随访及电话随访,随访截止日期为2020年12月。
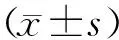
2 结果
2.1肺腺癌组织与癌旁组织中GOLPH3和VEGF的表达情况 GOLPH3及VEGF主要表达于细胞质,见图1。肺腺癌组织中的GOLPH3及VEGF蛋白的阳性表达率明显高于癌旁组织,差异有统计学意义(P<0.05)。见表1。相关性分析结果显示GOLPH3与VEGF表达水平之间存在正相关(rs=0.414,P<0.05)。见表2。

ⓐGOLPH3在肺腺癌组织中高表达;ⓑGOLPH3在肺腺癌组织中低表达;ⓒGOLPH3在癌旁组织中阴性表达;ⓓVEGF在肺腺癌组织中高表达;ⓔVEGF在肺腺癌组织中低表达;ⓕVEGF在癌旁组织中阴性表达

表1 肺腺癌组织与癌旁组织中GOLPH3和VEGF的表达情况[n(%)]
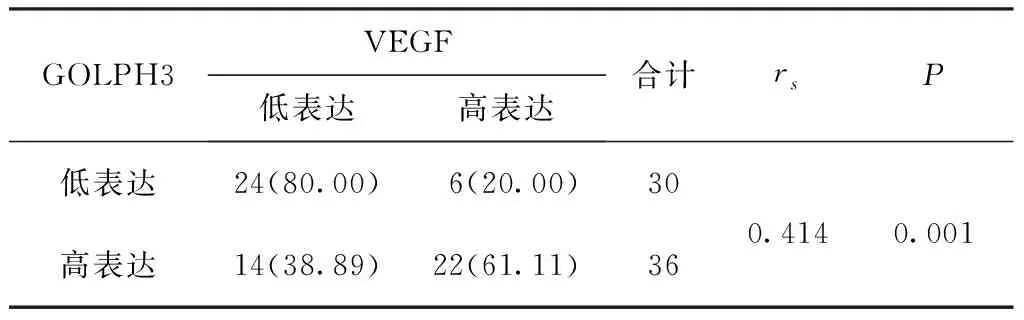
表2 GOLPH3与VEGF在肺癌组织中表达的相关性分析结果
2.2肺腺癌组织中GOLPH3及VEGF表达水平与临床病理特征的关系 GOLPH3表达水平与组织分化程度、淋巴转移、TNM分期有关(P<0.05)。VEGF的表达水平与肿块直径、淋巴转移及TNM分期有关(P<0.05)。见表3。

表3 肺腺癌组织中GOLPH3及VEGF表达水平与临床病理特征的关系[n(%)]
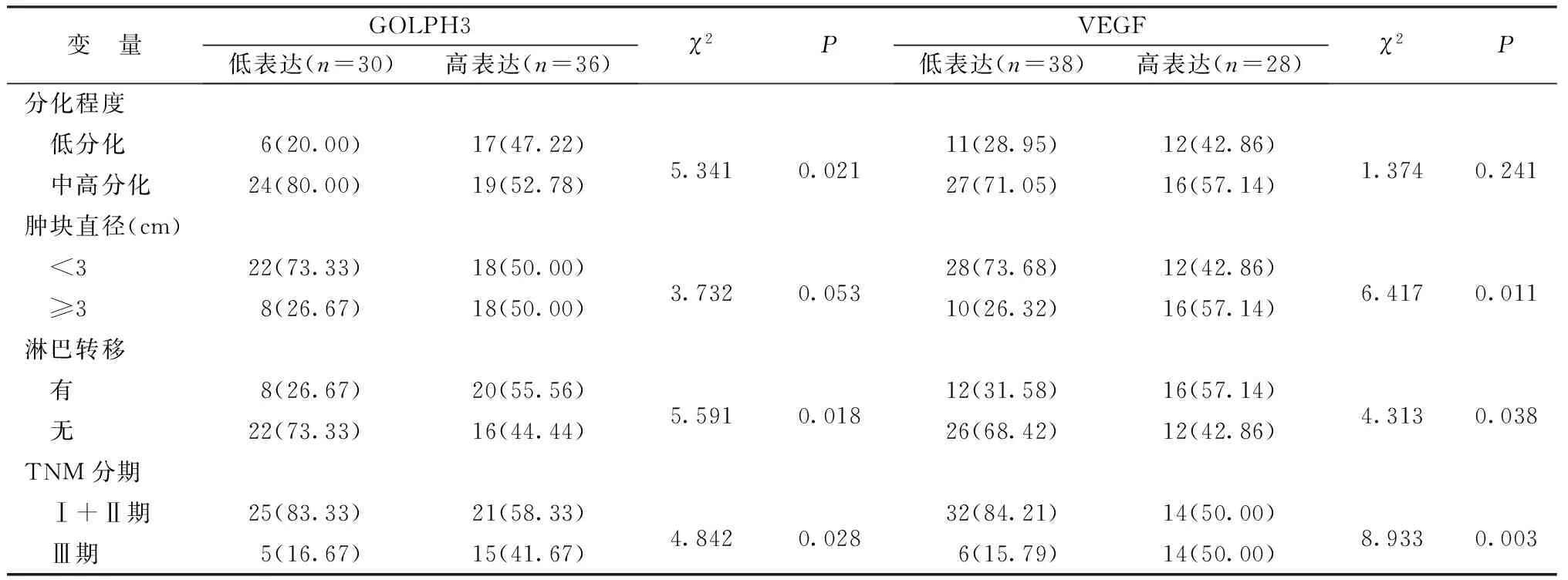
续表3
2.3影响肺腺癌患者预后的单因素分析结果 单因素分析结果显示,分化程度、肿块直径、TNM分期、GOLPH3及VEGF表达水平是影响患者预后的因素(P<0.05)。见表4。Kaplan-Meier分析显示,GOLPH3高表达组中位生存期为23个月,1年、3年及5年生存率分别为75.0%、34.3%及23.5%。见图2。VEGF高表达组中位生存期为20个月,1年、3年及5年生存率分别为67.9%、60.6%及16.4%。见图3。
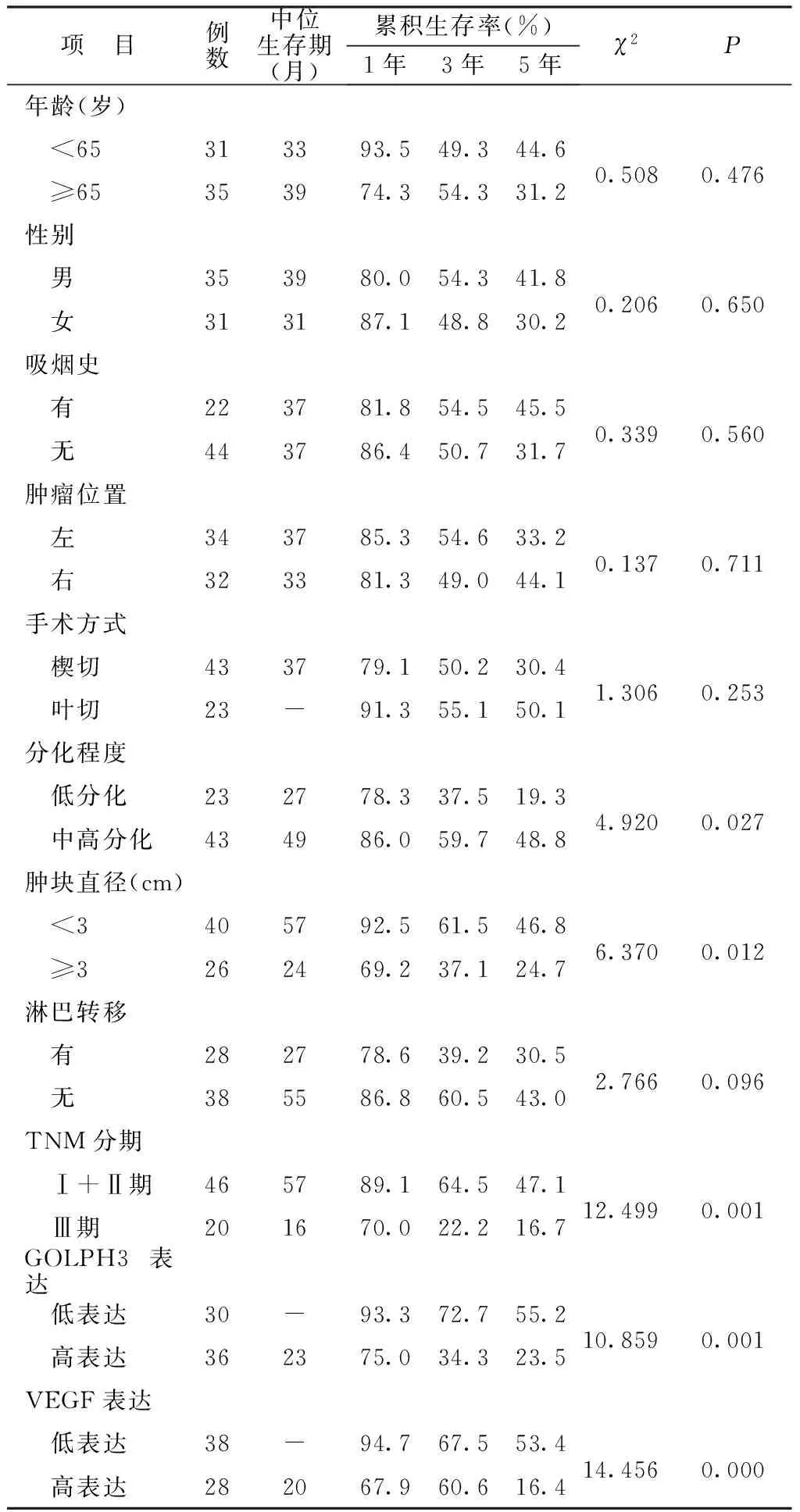
表4 影响肺癌患者预后的单因素分析结果
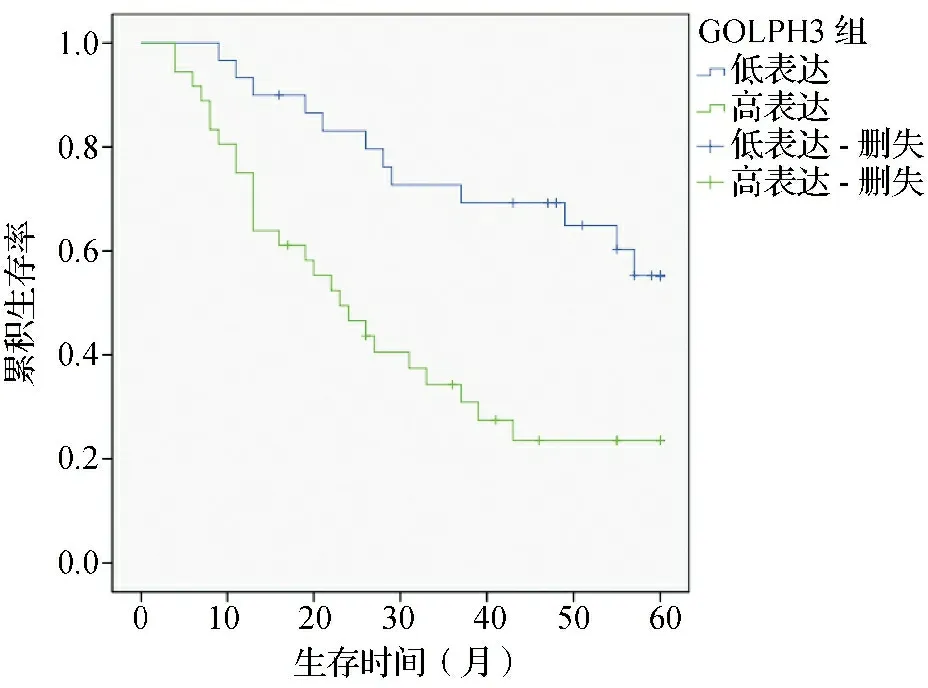
图2 GOLPH3表达水平对肺腺癌患者预后的生存曲线图
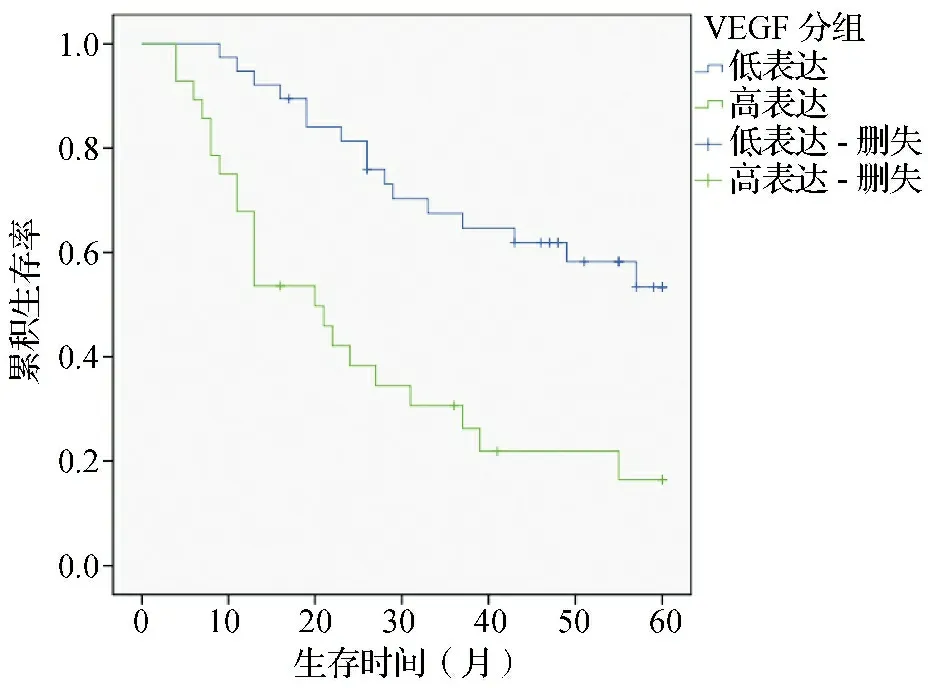
图3 VEGF表达水平对肺腺癌患者预后的生存曲线图
2.4影响肺腺癌患者预后的多因素Cox回归分析结果 将单因素分析中P<0.05的变量(分化程度、肿瘤直径、TNM分期、GOLPH3表达、VEGF表达)纳入Cox回归模型。结果显示,TNM分期(HR=2.110,95%CI:1.048~4.250,P<0.05)、VEGF高表达(HR=2.136,95%CI:1.039~4.391,P<0.05)及GOLPH3高表达(HR=2.239,95%CI:1.075~4.661,P<0.05)是影响患者生存率的独立危险因素。见表5。

表5 影响肺癌患者预后生存的多因素Cox回归分析结果
3 讨论
3.1GOLPH3基因位于5p13基因组,被证明是在癌症中激活的靶向基因,在癌症的发生发展中有着多种作用[10]。GOLPH3也是高尔基体的4-磷酸磷脂酰肌醇(phosphatidylinositol-4-phosphate,PI4P)效应物,在高尔基体到质膜运输中发挥关键作用[11]。基因组的不稳定是癌细胞的一个特征,可造成肿瘤的异质性并促进肿瘤进展[12]。研究证据表明GOLPH3是维持基因组稳定性所必需的[13-14]。同时,大量研究表明GOLPH3的致癌活性主要与其激活下游信号哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR),导致mTORC1和mTORC2复合物的活化增强相关[4]。在癌症中GOLPH3会促进高尔基体糖基转移酶的高尔基体内运输,改变细胞间粘附和获得侵袭/细胞迁移能力,促进癌症的进展及转移[15]。Wang等[9]发现在非小细胞肺癌中,GOLPH3过表达会通过上调基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)及基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)促进癌细胞的迁移和侵袭能力,过表达患者预后较差。有研究发现在乳腺癌、结直肠癌、脑肿瘤等中GOLPH3的过表达预示着患者预后较差[16-18]。在本研究中发现GOLPH3高表达的患者组织分化程度更低,淋巴转移率更高,分期更晚并且预后更差,说明在肺腺癌中GOLPH3的表达可能参与了肿瘤的发生发展与转移。同时,在多因素分析中显示GOLPH3的高表达是影响患者预后的独立危险因素,与既往研究结果一致。
3.2VEGF是一种同型二聚体糖蛋白,分子量约为45 kDa,是血管生成(新血管形成)的关键介质[19]。VEGF mRNA在许多肿瘤中过度表达,并且与肿瘤血管生成、侵袭性、转移、复发及预后相关[20]。Farhat等[21]发现非小细胞肺癌中出现VEGF高表达时患者的预后更差。有研究发现在乳腺癌、胰腺癌、食管癌等多种癌症中VEGF的高表达都预示着患者预后不良[22-24]。在本研究中肺腺癌组织中VEGF的高表达率较癌旁组织有明显差异。同时,在研究中发现VEGF高表达的患者肿瘤更大,更容易发生淋巴转移,分期更晚,多因素分析也提示VEGF的高表达是肺腺癌患者预后生存的独立危险因素。提示VEGF的表达可能参与了肿瘤的发生发展,与既往研究一致[20]。
3.3研究表明GOLPH3的致癌活性主要与其激活下游信号mTOR相关[4]。mTOR是PI3K/AKT/mTOR信号通路中的关键点,与肿瘤的生长和增殖有关[11]。有研究显示GOLPH3可通过Akt/mTOR信号通路激活下游信号mTOR[25]。而mTOR的活化可以通过上调缺氧诱导因子1a(hypoxia inducible factor-1a,HIF-1a)的表达促进下游因子VEGF激活,导致内皮细胞迁移生成新血管,增加肿瘤细胞的血流量[17]。在本研究中发现GOLPH3的表达水平与VEGF表达水平呈正相关,且VEGF低表达患者中GOLPH3蛋白表达水平明显低于VEGF高表达患者。因此,在肺腺癌中GOLPH3蛋白可能通过激活Akt/mTOR信号促进VEGF的表达和血管增殖,造成肿瘤的恶变。内在分子机制还需进一步研究。
综上所述,在肺腺癌中GOLPH3与VEGF高表达可能促进了肿瘤的发展及转移,并且提示较差的预后。同时多因素分析显示两者都是影响肺腺癌患者预后的独立危险因素。未来通过研发针对GOLPH3基因的靶向药物,可能是抑制肿瘤生长与进展的新的治疗思路,以期改善患者预后。
