补料分批发酵耦合盐析萃取高效生产虫草素
2021-10-13樊雪,霍春红,关海晴,李倩,王际辉,3,王亮
樊 雪, 霍 春 红, 关 海 晴, 李 倩, 王 际 辉,3, 王 亮
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.大连大学 生命科学与技术学院, 辽宁 大连 116622;3.东莞理工学院 化学工程与能源技术学院, 广东 东莞 523808 )
0 引 言
虫草素(cordycepin),又名蛹虫草菌素、虫草菌素,化学名称为3′-脱氧腺苷(3′-deoxya-denosine),是第一个从真菌中分离出来的核苷类抗生素[1],具有抗癌、抗肺细胞纤维化、治疗白血病、免疫调节等[2-4]药用价值。
蛹虫草菌液体发酵法是目前生产虫草素的主要方式,但因其生产周期长、产量低、分离纯化较烦琐等缺点,使虫草素的价格居高不下,限制其规模化生产及应用。目前,对提高虫草素产量的报道已有许多,但这些研究基本围绕筛选及诱变高产菌株[5]、优化培养基及培养条件[6-7]、添加虫草素合成前体及激活子[8]三个方面展开。虫草素是蛹虫草菌发酵中的重要次级代谢产物,会干扰细胞中的RNA合成及转录过程[9],从而对蛹虫草菌产生毒害作用。前期研究表明,虫草素在发酵液中积累对虫草素产量有明显影响[10]。为解决这一问题,研究者们提出生物反应与分离耦合技术[11]。
生物反应与分离耦合技术,又称原位产物分离技术或发酵分离耦合技术,是一种在生物反应过程中通过合适的分离手段持续不断的将对生物反应有抑制或毒害作用的产物或副产物或不稳定性产物选择性地从生产性细胞或生物催化剂周围原位移除的方法[12]。目前这种方法已成功应用于多种产品的生产中,尤以应用于乙醇[13]、丁醇[14]、乳酸[15]等初级代谢产物发酵的研究报道居多,而将发酵分离耦合技术应用于蛹虫草菌液体发酵产虫草素的研究较少。关海晴等[12]利用大孔树脂吸附耦合液体发酵实现了虫草素高产。利用原位产物分离技术可能成为提高虫草素产量的有效策略。构建发酵分离耦合体系,需选择合适的分离手段,其中,盐析萃取法[16]是一种新型的双水相体系,具有成相时间短、操作简便、易放大、对设备要求较低等优点。
本研究通过构建蛹虫草菌补料分批发酵耦合盐析萃取发酵体系,发酵过程中及时移除高浓度虫草素,解除产物抑制,以期探究该体系对虫草素液体发酵产量的影响。
1 材料与方法
1.1 材 料
菌种:蛹虫草CordycepsmilitarisFFCC 5111,大连工业大学生物工程学院选育保藏。
1.2 方 法
1.2.1 样品预处理
选用蛹虫草菌C.militarisFFCC 5111进行摇瓶液体培养,25 ℃、160 r/min培养20 d,收集发酵液,8 000 r/min离心10 min,取上清。
1.2.2 盐析法分离发酵液中虫草素
取一定体积上清液于10 mL具塞比色管中,加入适量无机盐,完全溶解后加入一定体积的有机溶剂,涡漩振荡1 min,静置分相,对上下相分别取样,测定体积及虫草素含量,计算盐析萃取体系的相比(R)、分配系数(K)及回收率(Y)。
R=VT/VB
(1)
K=ρT/ρB
(2)
Y=(ρTVT)/(ρFVF)
(3)
式中:VT、VB分别为上、下相体积,mL;ρT、ρB分别为上、下相虫草素质量浓度,mg/L;ρF为发酵液中虫草素质量浓度,mg/L;VF为盐析体系中发酵液体积,mL。
1.2.2.1 有机溶剂种类对虫草素分离效果的影响
取上清液4 mL于10 mL具塞比色管中,加入(NH4)2SO41.06 g,分别加入2.4 mL的甲醇、乙醇、异丙醇、丙酮、乙酸乙酯或异戊醇,涡漩振荡1 min,静置分相。计算分配系数及回收率。
1.2.2.2 无机盐种类对虫草素分离效果的影响
取上清液4 mL,分别加入K2HPO42.24 g、KH2PO40.32 g、NaH2PO41.22 g、NaCO30.15 g、(NH4)2SO41.06 g或NaCl 0.50 g,再加入乙醇2.4 mL,涡漩振荡1 min,静置分相。计算分配系数及回收率。
1.2.2.3 无机盐浓度对虫草素分离效果的影响
取上清液4 mL,加入不同量(NH4)2SO4和K2HPO4(0.66、1.06、1.46、1.86、2.26、2.66 g)待溶解后加入2.4 mL乙醇,涡漩振荡1 min,静置分相。计算相比及回收率。
1.2.2.4 相图绘制
称取一定量的无机盐(m1)加入10 mL具塞比色管中,称取一定量去离子水(m2)溶解,逐滴加入有机溶剂(m3)至溶液恰好出现浑浊,判定出现浑浊的方法为向该体系中滴加一滴水,溶液立刻澄清,多加一滴有机溶剂,溶液又出现浑浊,则可认为该点为临界点。反复操作,可得多个临界点,按公式4和5分别计算每个临界点的有机溶剂及无机盐的质量分数,以无机盐质量分数(w1)为横坐标,有机溶剂质量分数(w2)为纵坐标,绘制相图。
w1=m1/(m1+m2+m3)
(4)
w2=m3/(m1+m2+m3)
(5)
1.2.3 补料分批发酵与盐析萃取耦合工艺的建立
利用蛹虫草菌C.militarisFFCC 5111进行液体发酵,分别在第6、9、12天取出部分发酵液,8 000 r/min 离心10 min,收集上清液进行盐析分离虫草素,沉淀部分(下相)重新循环回发酵体系,并补充一定体积新鲜合成培养基,使发酵液总体积维持在100 mL,以不进行耦合实验的摇瓶为对照组。发酵15 d,每隔3 d取样,测定菌体生物量、残糖及虫草素浓度等参数。
1.2.4 分析方法
1.2.4.1 生物量的测定
取发酵液2 mL,12 000 r/min离心10 min,上清液用于残糖量及虫草素含量测定,沉淀用去离子水清洗2遍,80 ℃烘干至恒重,称重计算生物量。
1.2.4.2 残糖量测定
残糖量选用南京建成公司的F006葡萄糖测试盒进行测定。
1.2.4.3 虫草素含量测定
发酵液中虫草素含量利用高效液相色谱进行检测[12]。高效液相色谱Waters e2695,检测器为Waters 2998,紫外检测器波长260 nm,色谱柱选用Venusil MP C18(2)(4.6 mm×250 mm),柱温25 ℃,流动相为体积比20∶80的甲醇-水溶液,体积流量0.8 mL/min,进样量10 μL。
2 结果与讨论
2.1 有机溶剂种类对虫草素分离的影响
研究表明,有机溶剂的种类影响盐析萃取体系的成相能力[17],(NH4)2SO4是已报道文献中常用于构建盐析萃取体系的无机盐[18]。本研究考察了不同种类有机溶剂与(NH4)2SO4组成的盐析萃取体系对虫草素分离的效果,结果如表1所示。由表1可知,乙醇、丙酮与(NH4)2SO4组成的盐析萃取体系对虫草素的回收率与分配系数较高,回收率均达到93%以上;其次为异丙醇;而乙酸乙酯、戊醇与(NH4)2SO4组成的盐析萃取体系虫草素回收率较低,仅为12.37%和24.95%。推测是因为虫草素易溶于水,乙醇、丙酮与异丙醇在水中溶解度较高且极性较强,可争夺更多的水分子,使上相水分子含量较高,虫草素回收率较高;乙酸乙酯与戊醇在水中的溶解度较低且极性较弱,使得上相中水分子含量较少,虫草素的回收率较低。而甲醇/(NH4)2SO4体系不能成相,且有沉淀产生,这一结果与Gu等[19]的研究结论一致,推测是由于甲醇的亲水性太强,使得水分子过多分配在上相,而使(NH4)2SO4析出。综上,乙醇/(NH4)2SO4体系及丙酮/(NH4)2SO4体系对虫草素的萃取效果最好,考虑成本及溶剂毒性因素,选择乙醇作为萃取剂。
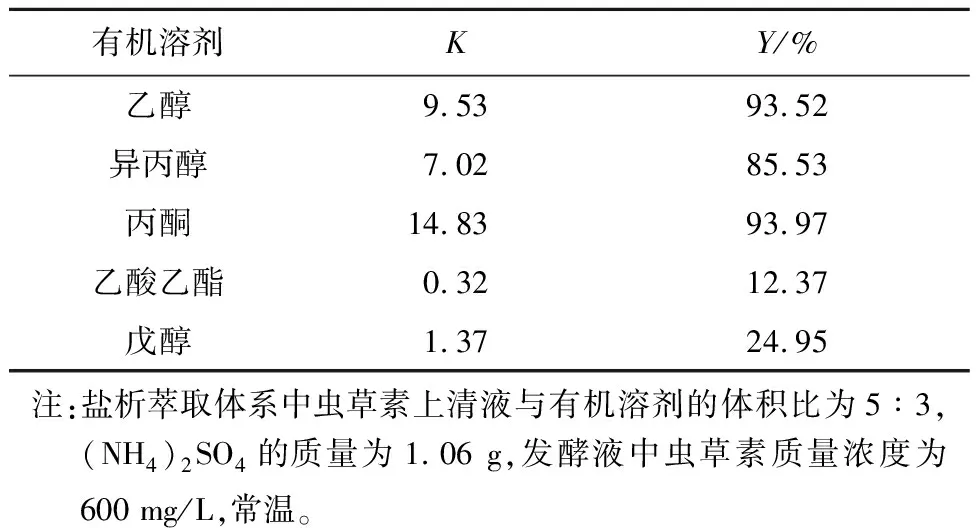
表1 虫草素在有机溶剂/硫酸铵盐析萃取体系中的分配系数及回收率
2.2 无机盐种类对虫草素分离的影响
由表2可知,除NaCl外,其余种类无机盐均可与乙醇组成双水相体系。比较不同盐析萃取体系的萃取能力,其中乙醇/(NH4)2SO4体系及乙醇/K2HPO4的回收率较高,达到98.51%和92.27%,因此选择乙醇/(NH4)2SO4体系及乙醇/K2HPO4两种体系进行研究。

表2 虫草素在乙醇/无机盐盐析萃取体系中的分配系数及回收率
2.3 乙醇/(NH4)2SO4及乙醇/K2HPO4体系相图
通过浊点法分别测定乙醇/(NH4)2SO4体系及乙醇/K2HPO4体系双结线数据,绘制相图,如图1所示。由图1可以看出,乙醇/(NH4)2SO4体系及乙醇/K2HPO4体系的分相范围均较大,对于乙醇/(NH4)2SO4体系,(NH4)2SO4质量分数在5%~41%时,添加适量的乙醇都能形成稳定的双水相体系。在(NH4)2SO4质量分数较低时,(NH4)2SO4的盐析能力较弱,因此分相需要较多的乙醇;随着(NH4)2SO4质量分数的升高,分相所需的乙醇体积分数逐渐降低。在相同质量分数的(NH4)2SO4体系中,使用虫草素发酵液代替水,需要的乙醇体积几乎不变,但成相范围变窄,推测是由于发酵液中含有的无机盐争夺了部分水分子,使得可以加入的(NH4)2SO4质量变小,成相范围变小;同样对于乙醇/K2HPO4体系,K2HPO4质量分数在10%~40%时,添加适量的乙醇都能形成稳定的双水相体系。当K2HPO4质量分数较低时,其盐析能力较弱,因此分相需要较多的乙醇;随着其质量分数的升高,分相所需的乙醇体积分数逐渐降低。
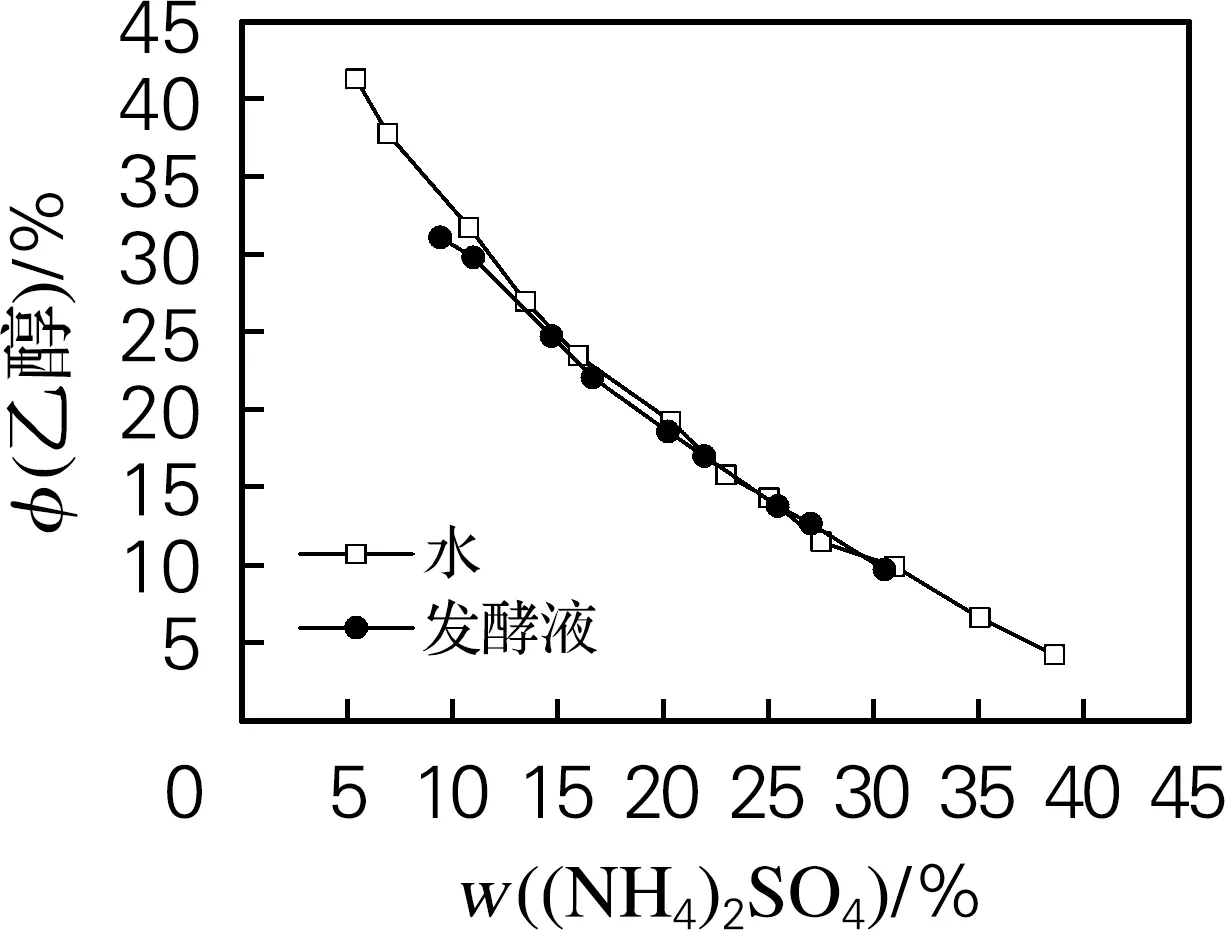
(a) 乙醇/(NH4)2SO4
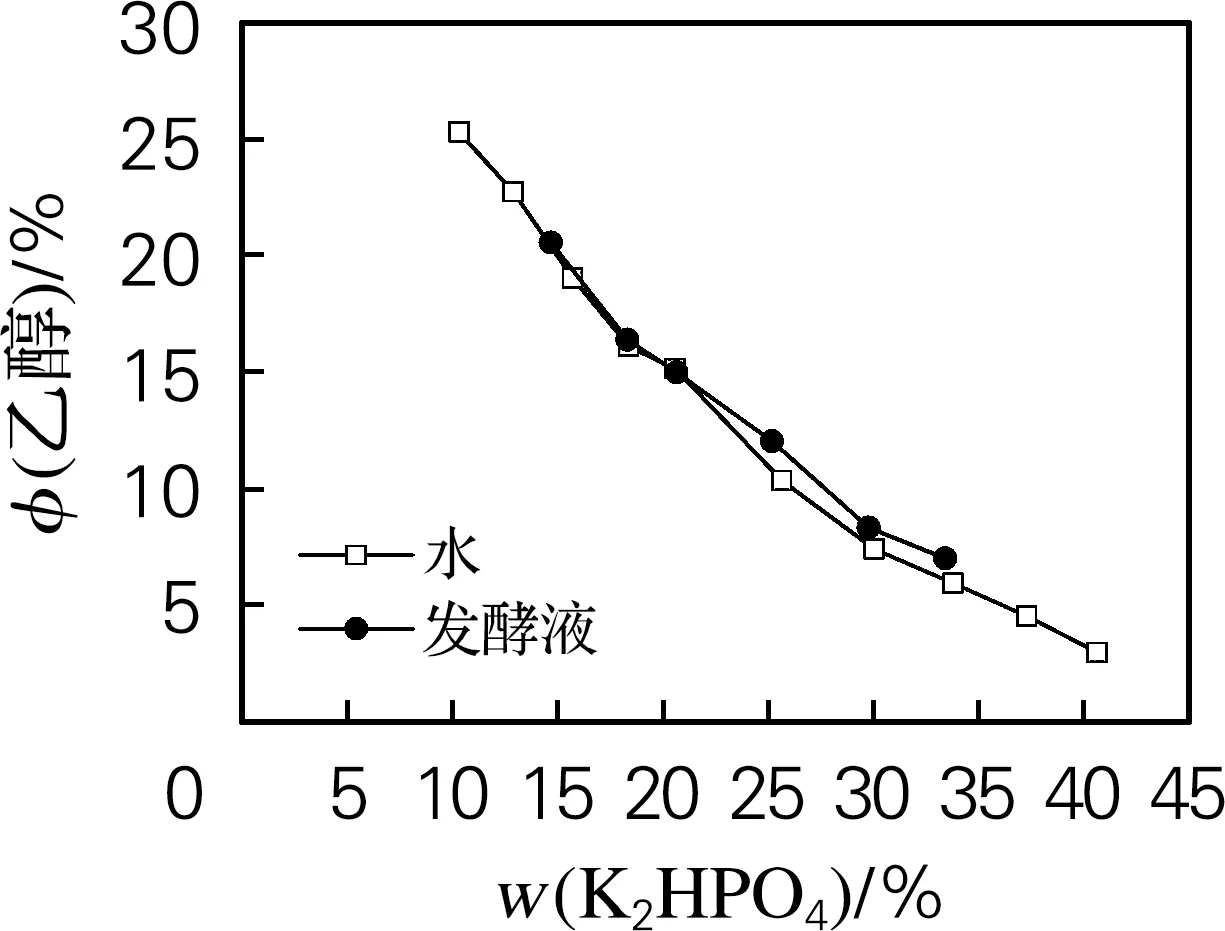
(b) 乙醇/K2HPO4
由图2可知,在乙醇体积分数相同时,成相所需的K2HPO4的质量分数小于(NH4)2SO4,乙醇/K2HPO4的双结线位置相较于乙醇/(NH4)2SO4体系更靠左,这说明K2HPO4的盐析成相能力强于(NH4)2SO4,双水相分相时所需盐的质量分数更小,这与周梦飞等[17]结论一致,该研究有效排出体积理论,比较了10种盐的盐析能力发现,K2HPO4的盐析能力远大于(NH4)2SO4。
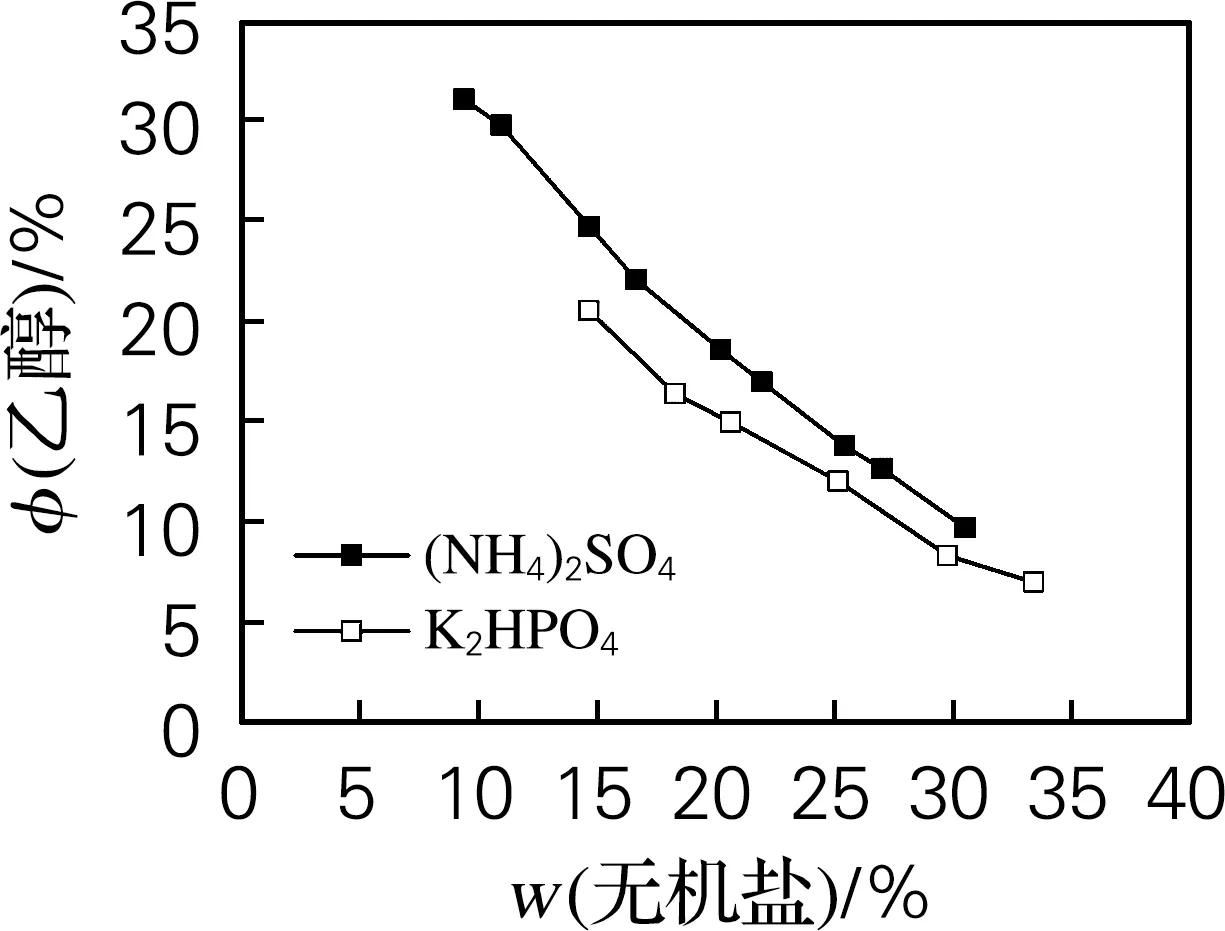
图2 乙醇/(NH4)2SO4和乙醇/K2HPO4双水相体系相图比较Fig.2 Comparison of the phase diagrams of ethanol/(NH4)2SO4 and ethanol/K2HPO4 ATPSs
2.4 无机盐质量分数对虫草素分离的影响
由图3可知,对于两种体系而言,随着无机盐质量分数的增加,相比均逐渐减小,且趋于稳定。无机盐会与有机小分子醇争夺体系中的水分子。无机盐质量分数的增大,其争夺水分子的能力增强,溶于上相的水分子会进入下相,使上相体积减小,下相体积增大,从而使相比减小。相比过大或过小,不利于回收,因此考察相比为4.0~0.8、无机盐质量分数在15%~25%时对虫草素回收率的影响。

图3 无机盐质量分数对相比的影响Fig.3 Effects of inorganic salt content on phase ratio
由表3可知,在乙醇/(NH4)2SO4体系中,增加无机盐质量分数,会降低虫草素的回收率;增加乙醇体积分数,可提高虫草素回收率。但当乙醇体积分数大于27%后,虫草素回收率不再增加,反而略有下降,这与陆秀华等[20]的研究结果一致。因此确定双水相体系中乙醇体积分数为27%,(NH4)2SO4质量分数为15%。

表3 补料分批发酵与盐析萃取耦合体系虫草素产量Tab.3 Production of cordycepin by coupling fed batchfermentation with ATPS
由表4可知,在乙醇/K2HPO4体系中,无机盐质量分数对虫草素回收率的影响结果与乙醇/(NH4)2SO4体系相似。当乙醇体积分数为27%、K2HPO4质量分数为15%时,虫草素回收率最高,为93.79%,因此确定双水相体系中乙醇体积分数为27%,K2HPO4质量分数为15%。比较表3、表4发现,在乙醇体积分数及无机盐质量分数相同时,乙醇/(NH4)2SO4体系回收率高于乙醇/K2HPO4体系回收率,推测是因为K2HPO4的盐析能力强于(NH4)2SO4,当乙醇体积分数及无机盐质量分数相同时,K2HPO4可争夺更多水分子,其下相体积更大,使得部分虫草素随水分子转移至下相,造成虫草素的部分损失,因此乙醇/(NH4)2SO4体系回收率略高于乙醇/K2HPO4体系回收率。
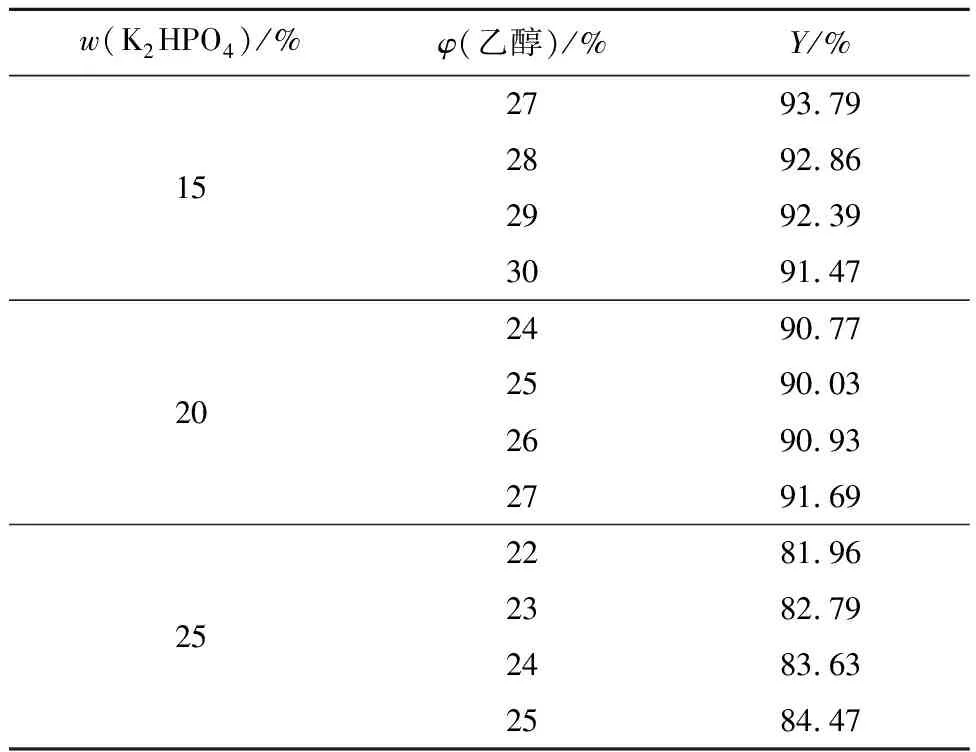
表4 乙醇/K2HPO4体系中K2HPO4质量分数对虫草素回收率的影响
2.5 补料分批发酵耦合盐析萃取工艺的建立
在发酵过程中,以新鲜培养基替换含有高浓度虫草素的发酵液,通过盐析萃取体系对替换出的发酵液中的虫草素进行分离提取。通过这种方法可对发酵液中虫草素浓度进行稀释,从而弱化其对菌体自身生长的反馈抑制,添加新的营养物质可促进细胞生长及虫草素积累。探究耦合时间对虫草素产量及生物量浓度的影响,结果如表5所示。由表5可知,通过补料方式可有效提高虫草素产量,在第6天补料,虫草素产量最高,为793.85 mg/L,较对照组提高了25.83%。同时,通过补料手段对细胞生长也有较好的促进作用,在第6天补料可将生物量提高45.11%,虽然此策略对提高虫草素产量效果显著,但同时需要提供更多的营养物质。

表5 耦合启动时间对细胞生长及虫草素积累的影响Tab.5 Effect of the starting time on cell growth andcordycepin production mg/L
发酵结束后,利用乙醇/(NH4)2SO4盐析萃取体系对虫草素进行分离提取,结果表3所示。由表3可知,乙醇/(NH4)2SO4盐析萃取体系可有效分离虫草素,回收率均可达98%左右。
3 结 论
虫草素是蛹虫草菌发酵中的重要次级代谢产物,本研究构建了一种补料分批发酵与盐析萃取相耦合的体系生产虫草素。筛选出乙醇/(NH4)2SO4及乙醇/K2HPO4两种盐析萃取分离体系,且当无机盐质量分数、乙醇体积分数分别为15%和27%时,虫草素回收率最高,乙醇/(NH4)2SO4体系为98.73%,乙醇/K2HPO4体系为93.79%。在第6天补料效果最好,虫草素产量可达793.85 mg/L,较对照组提高25.83%,虫草素回收率可达98.83%。
