盐巴戟天有效成分在体肠灌流研究
2021-10-13华悦魏晓峰李喆张超史辑
华悦,魏晓峰,李喆,张超,史辑,2,3
1.辽宁中医药大学药学院,辽宁 大连 116600;2.国家中医药管理局炮制原理解析重点实验室,辽宁 大连 116600;3.辽宁省中药炮制工程技术研究中心,辽宁 大连 116600
巴戟天为茜草科植物巴戟天Morinda officinalisHow 的干燥根,是我国四大南药之一。2020 年版《中华人民共和国药典》记载巴戟天有补肾壮阳、强筋骨、祛风湿功效,用于治疗阳痿遗精、宫冷不孕、少腹冷痛、月经不调、筋骨萎软、风湿痹痛等,其常用炮制品为巴戟肉、盐巴戟天、制巴戟天[1]。巴戟天主要含蒽醌、环烯醚萜苷、多糖及寡糖类成分[2-3],其中环烯醚萜苷类成分在心血管疾病、抗肿瘤、免疫调节等方面有很好的作用[4],寡糖类成分补肾壮阳、抗抑郁作用较好[5]。本课题组前期对巴戟天盐蒸前后化学成分的体外和体内变化规律进行研究,发现盐蒸后巴戟天中寡糖类成分和环烯醚萜苷类成分的变化较大,耐斯糖等寡糖类成分含量明显增加,而以水晶兰苷为代表的环烯醚萜苷类成分则降低[6]。口服巴戟天饮片提取液后,其有效成分的吸收效率可能对临床疗效产生影响。本试验采用在体单向肠灌流方法对巴戟天盐制前后的环烯醚萜苷类和寡糖类成分在小肠不同肠段(十二指肠、空肠、回肠)的吸收规律进行研究,探索盐蒸是否对巴戟天有效成分的在体吸收产生影响。
1 仪器、试药与动物
AE240 型1/10 万电子分析天平(瑞士梅特勒-托利多公司),FA1004 电子天平(上海精密科学仪器有限公司),Agilent1100 高效液相色谱仪(Agilent 公司),超纯水仪(法国Millipore 公司),DZTW 型调温电热套(北京市永光明医疗仪器有限公司),RE52CS 型旋转蒸发仪(上海亚荣生化仪器厂),HH-S4 型水浴锅(郑州长城科工贸有限公司),电热恒温干燥箱(上海市跃进医疗器械一厂),H-Class/Xevo TQD 型三重四极杆液相质谱联用仪(配有Masslynx4.1 色谱工作站,美国Waters 公司)。
巴戟天药材(批号BJTBZ2013-2),购自安徽亳州药材市场,产地广西南宁,经辽宁中医药大学翟延君教授鉴定为茜草科植物巴戟天Morinda officinalisHow 的干燥根。水晶兰苷对照品(批号O0605AS,纯度≥98.0%)、去乙酰车叶草苷酸对照品(批号J0329AS,纯度≥98.0%),大连美仑生物技术有限公司;耐斯糖对照品(批号292-64121,纯度≥99.0%),日本Wako 公司。乌拉坦(批号330H031),北京索莱宝科技有限公司;碳酸氢钠、磷酸二氢钠均为分析纯,天津市大茂化学试剂厂;氯化钠、氯化钙、氯化钾和氯化镁均为分析纯,天津市科密欧化学试剂有限公司;葡萄糖为分析纯,东北制药总厂;95%乙醇、乙酸乙酯、正丁醇为分析纯;水为超纯水;乙腈、甲醇为色谱纯。
雄性SD 大鼠30 只,体质量180~220 g,购自辽宁长生生物有限公司,动物许可证号SCXK(辽)2017-0001。实验前于相对湿度30%~50%、温度25 ℃、12 h 光照/黑暗循环环境中适应性饲养1 周,自由摄食饮水。
2 方法与结果
2.1 盐巴戟天及其活性部位制备
取净巴戟天,蒸透,趁热除去木心,切段,干燥,得巴戟肉。巴戟肉加盐拌匀(100 g 巴戟肉加入1.5 g盐),用1.05 倍量水浸泡5.48 h,蒸2.9 h,烘干,即得盐巴戟天。取盐巴戟天,依次用10、8、8 倍量80%乙醇回流提取,各1 h,合并提取液,浓缩回收乙醇。浸膏加入适量蒸馏水混悬,依次用相同体积的乙酸乙酯、正丁醇各萃取3~5 次,减压回收乙酸乙酯和正丁醇,分别得到乙酸乙酯萃取物(总蒽醌)、正丁醇萃取物(总环烯醚萜苷)和剩余水部分(总寡糖)[7]。
2.2 溶液制备
2.2.1 Krebs-Ringer 试液
称取氯化钙0.37 g、葡萄糖1.40 g,分别用适量水溶解。再分别称取氯化钠7.80 g、氯化钾0.35 g、氯化镁0.02 g、碳酸氢钠1.37 g、磷酸二氢钠0.32 g,用适量水溶解,将氯化钙溶液和葡萄糖混合溶液缓慢加入上述盐溶液中,定容至1 L,用时以HCl 或NaOH调节pH 值[8]。
2.2.2 对照品溶液
精密称取水晶兰苷5.11 mg、去乙酰车叶草苷酸2.52 mg、耐斯糖对照品5.08 mg,以Krebs-Ringer 试液定容至5 mL 容量瓶中,制得混合对照品溶液。
2.2.3 肠灌流液
用Krebs-Ringer 试液将盐巴戟天正丁醇部位和水部位配制成135、270、540 g/L 灌流液,分别含水晶兰苷17.29、32.25、49.28 g/L,去乙酰车叶草苷酸7.02、12.55、20.11 g/L,耐斯糖10.80、15.78、27.96 g/L。
2.2.4 供试品溶液
取肠灌流液样品3 mL,4 ℃、12 000 r/min 离心10 min,取上清液,按高剂量(540 g/L)1∶8、中剂量(270 g/L)1∶1、低剂量(135 g/L)4∶3 稀释,过0.22 μm 微孔滤膜,取续滤液,即得。
2.3 色谱及质谱条件
2.3.1 环烯醚萜苷类成分
采用Agilent1100 高效液相色谱仪,Venusil MP C18 色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-0.1%磷酸水溶液,梯度洗脱(0→15 min,5∶95→28.8∶71.2),检测波长235 nm,流速0.8 mL/min,进样量2.0 µL,柱温25 ℃。
2.3.2 寡糖类成分
采用H-Class/Xevo TQD 型三重四极杆液相质谱联用仪,Masslynx4.1色谱工作站。色谱条件:ACQUITY UPLC BEH Amide 色谱柱(2.1 mm×100 mm,1.7 µm),流动相为0.1%甲酸-乙腈-0.1%甲酸水溶液,洗脱程序见表1,流速0.3 mL/min,进样量1.0 µL。质谱条件:电喷雾离子源,以多反应监测模式进行负离子扫描,用于定量分析的离子对m/z 665.51→179.13,碰撞能量20 eV,运行时间13 min。
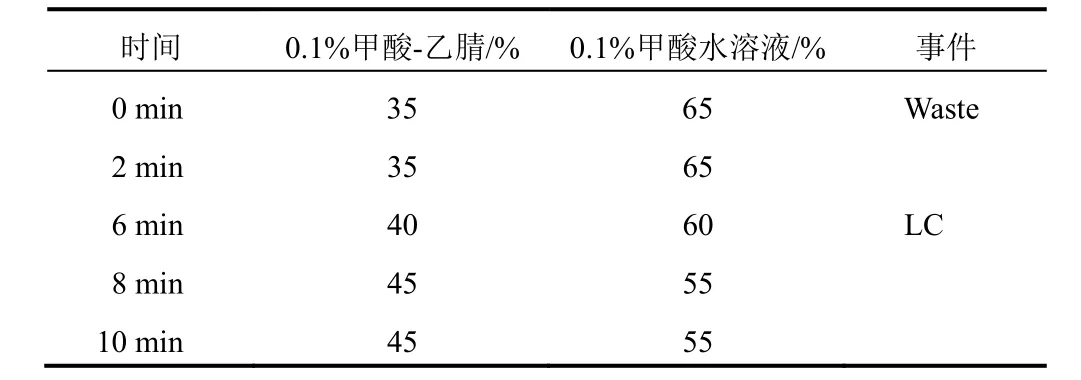
表1 寡糖类成分测定流动相洗脱程序
2.4 方法学考察
2.4.1 专属性试验
分别取空白灌流液、对照品溶液、含环烯醚萜苷类和寡糖类成分的灌流液,按“2.3”项下条件进样分析,结果见图1、图2。
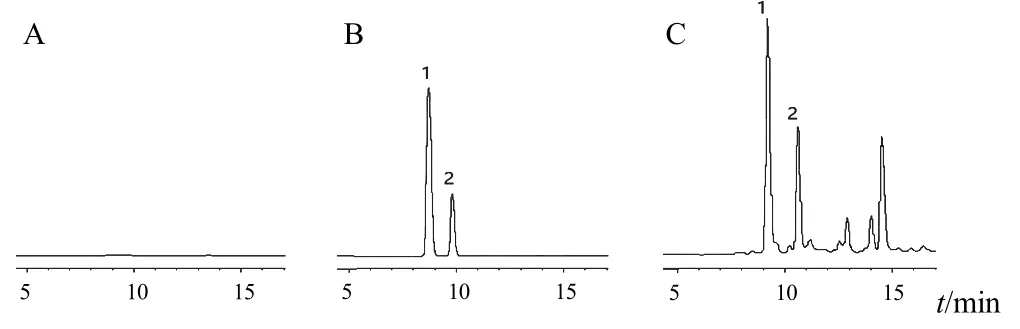
图1 盐巴戟天环烯醚萜苷类成分HPLC 图

图2 盐巴戟天寡糖类成分UPLC-QqQ-MS/MS 总离子流图
2.4.2 线性关系考察
取“2.2.2”项下对照品溶液,水晶兰苷和去乙酰车叶草苷酸混合对照品分别进样2.0、4.0、6.0、8.0、10.0、12.0 μL,耐斯糖对照品分别进样1.0、1.2、1.4、1.6、1.8、2.0 μL,得到各成分的线性方程,见表2。

表2 3 种成分线性关系考察结果
2.4.3 精密度试验
精密吸取“2.2.2”项下对照品溶液,于1 d 内分别进样5 次和连续5 d 每日同一时间各进样1 次,测得各成分日内峰面积RSD 分别为水晶兰苷1.7%、去乙酰车叶草苷酸1.6%、耐斯糖1.7%,日间峰面积RSD分别为水晶兰苷1.7%、去乙酰车叶草苷酸1.7%、耐斯糖1.9%。
2.4.4 稳定性试验
取“2.2.3”项下灌流液,按“2.2.4”项下方法处理后分别于0、2、4、8、12、24 h 进样,将各时间点测得的峰面积与0 h 峰面积比较,考察其稳定性。测得峰面积RSD 水晶兰苷为1.9%,去乙酰车叶草苷酸为1.7%,耐斯糖为1.7%,均小于2.0%,表明此空白灌流液中3 种成分稳定性良好。
2.4.5 物理吸附考察
分别取肠段和灌流管,分别置于中剂量灌流液(含水晶兰苷32.25 g/L,去乙酰车叶草苷酸12.55 g/L,耐斯糖15.78 g/L),37 ℃恒温水浴孵育30 min,孵育前后的灌流液按“2.2.4”项下方法处理,以孵育后灌流液各组分峰面积与孵育前各成分峰面积比值计算绝对回收率,结果各成分绝对回收率均大于95%,见表3。表明肠壁和灌流管对这3 种成分均无物理吸附。
表3 肠段及灌流管对盐巴戟天灌流液中3 种成分的 物理吸附回收率(,%,n=3)
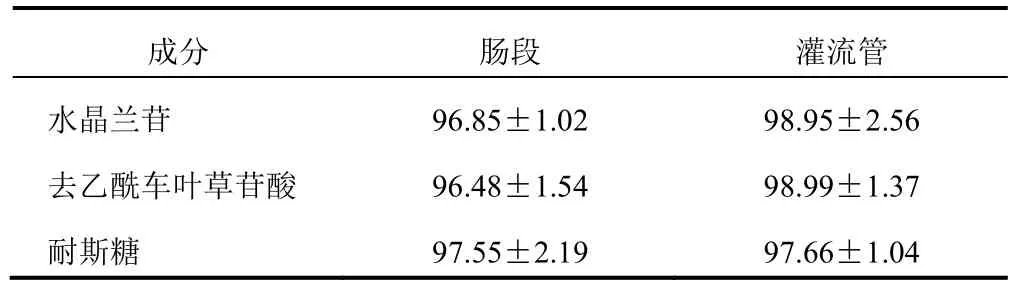
表3 肠段及灌流管对盐巴戟天灌流液中3 种成分的 物理吸附回收率(,%,n=3)
2.5 单向肠灌流实验
参照文献[8]方法。将生理盐水、灌流液、Krebs-Ringer 试液和收集瓶置于37 ℃水浴锅中预热。雄性SD 大鼠禁食不禁水12 h,腹腔注射20%乌拉坦溶液0.6 mL/100 g 麻醉,背位固定,沿腹中线打开腹腔,取全肠段或待测肠段(十二指肠、空肠、回肠)10~15 cm,于两端切口插管,用生理盐水冲洗肠腔,洗净内容物,将伤口用浸泡过生理盐水的脱脂棉盖住保湿,红外灯保温。先用Krebs-Ringer试液以1 mL/min速度灌流10 min 平衡,然后用灌流液以1 mL/min 速度灌流10 min 使肠段内充满灌流液,再调节速度至0.2 mL/min 灌流2 h,每隔30 min 更换一次收集瓶。灌流结束后剪下肠段,测量其长度(L)和横截面半径(r)。每个条件平行处理3 只大鼠。
采用重量法计算灌流液进出体积。精密称取0.5 mL灌入液质量(min),计算其密度ρin,再精密称取0.5 mL接出液质量(mout),计算其密度ρout,则灌流液流入体积Vin=min/ρin,灌流液流出体积Vout=mout/ρout。按下列公式计算药物表观渗透系数(Papp)、吸收速率常数(Ka)及每小时单位面积肠壁各组分累计吸收量(A)。

式中,Vin、Vout为灌流液流入和流出体积(mL),Cin和Cout为流入和流出灌流液的药物浓度(g/L),L和r 为被测肠段的长度和横截面半径(cm),Qin为灌流速度(0.2 mL/min),t 为灌流时间(h)。测定结果用表示,采用SPSS19.0 统计软件进行分析,组间比较采用方差分析,P<0.05 表示差异有统计学意义。
2.6 pH 值对盐巴戟天中3 种成分在体肠吸收的影响
分别以pH 5.4、6.8、7.4 的中剂量(270 g/L)灌流液(含水晶兰苷32.25 g/L、去乙酰车叶草苷酸12.55 g/L、耐斯糖15.78 g/L)对全肠段进行灌流,考察pH 值对环烯醚萜苷类成分和寡糖类成分全肠段吸收的影响,结果见表4。水晶兰苷和去乙酰车叶草苷酸在pH 7.4 灌流液中的Papp和Ka与pH 5.4 灌流液比较差异均有统计学意义(P<0.05),与pH 6.8 灌流液比较差异无统计学意义(P>0.05);耐斯糖在pH 7.4、6.8、5.4 灌流液中的Papp差异无统计学意义(P>0.05),Ka差异有统计学意义(P<0.05)。水晶兰苷、去乙酰车叶草苷酸和耐斯糖在pH 7.4 灌流液中的Papp和Ka均大于pH 6.8 和pH 5.4 灌流液,表明巴戟天中环烯醚萜苷类成分在酸性条件下肠吸收较弱,原因可能是水晶兰苷在酸性条件下不稳定,会部分转化成去乙酰车叶草苷酸[9]。因此灌流液pH 值选择7.4。
表4 盐巴戟天中3 种成分在不同pH 值灌流液中的 吸收参数比较(,n=6)
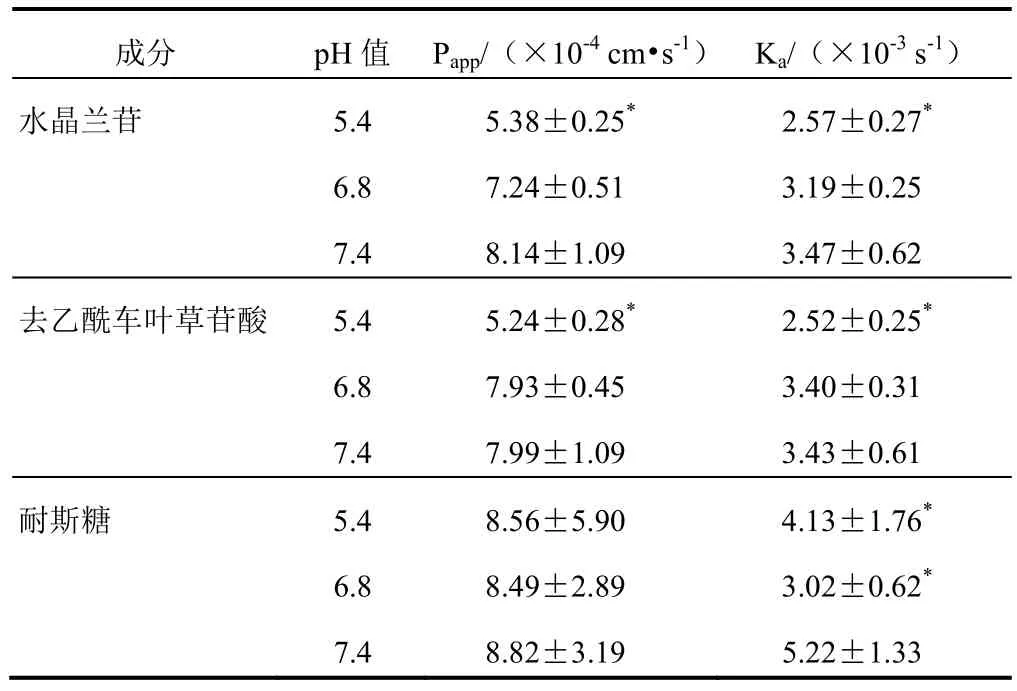
表4 盐巴戟天中3 种成分在不同pH 值灌流液中的 吸收参数比较(,n=6)
注:与同组pH 7.4 比较,*P<0.05
2.7 灌流液浓度对盐巴戟天中3 种成分在体肠吸收的影响
分别以135、270、540 g/L 灌流液(pH 7.4)对全肠段灌流,考察灌流液的浓度对环烯醚萜苷类成分和寡糖类成分的全肠段吸收影响,结果见表5。水晶兰苷、去乙酰车叶草苷酸在中剂量(270 g/L)灌流液中的Papp和Ka与高剂量(540 g/L)比较差异均有统计学意义(P<0.05);中剂量(270 g/L)与低剂量(135 g/L)比较,水晶兰苷和去乙酰车叶草苷酸差异无统计学意义,耐斯糖差异有统计学意义(P<0.05)。其药物累积吸收量在中剂量时最高,表明这3 种成分存在自身浓度抑制现象。
表5 盐巴戟天中3 种成分在不同浓度灌流液中的吸收参数比较(,n=6)

表5 盐巴戟天中3 种成分在不同浓度灌流液中的吸收参数比较(,n=6)
注:与同组270 g/L 比较,*P<0.05
2.8 盐巴戟天中3 种成分在小肠不同肠段的吸收特性
取pH 7.4 的中剂量灌流液,分别对十二指肠、空肠和回肠进行灌流,考察环烯醚萜苷类成分和寡糖类成分在3 个肠段的吸收状况,结果见表6。水晶兰苷、去乙酰车叶草苷酸、耐斯糖在十二指肠、空肠、回肠的吸收参数差异均无统计学意义。比较Ka发现,水晶兰苷在空肠部位吸收速率较大,不同肠段依次为空肠>十二指肠>回肠,表明水晶兰苷的主要吸收部位在空肠;去乙酰车叶草苷酸在回肠部位吸收速率较大,不同肠段依次为回肠>空肠>十二指肠,表明去乙酰车叶草苷酸的主要吸收部位在回肠;耐斯糖在回肠部位吸收速率较大,不同肠段依次为回肠>十二指肠>空肠,表明耐斯糖的主要吸收部位在回肠。
表6 盐巴戟天3 种成分在小肠不同肠段的吸收参数比较(,n=6)

表6 盐巴戟天3 种成分在小肠不同肠段的吸收参数比较(,n=6)
注:与同肠段水晶兰苷比较,*P<0.05;与同肠段去乙酰车叶草苷酸 比较,#P<0.05
比较3 种成分在同一肠段的吸收速率发现,在十二指肠和空肠,水晶兰苷与去乙酰车叶草苷酸的吸收参数差异无统计学意义(P>0.05);而二者在回肠的Ka差异有统计学意义(P<0.05)。耐斯糖与另2 种成分比较,不同肠段Ka差异均有统计学意义(P<0.05),且均大于另2 种成分,吸收速率依次为耐斯糖>去乙酰车叶草苷酸>水晶兰苷。
2.9 巴戟天盐蒸前后3 种成分在小肠中的吸收特性
按“2.6”“2.7”项下筛选出的最佳pH 值和最佳给药浓度,即pH 7.4 的中剂量(270 g/L)灌流液(含水晶兰苷32.25 g/L,去乙酰车叶草苷酸12.55 g/L,耐斯糖15.78 g/L),分别对小肠3 个肠段进行灌流,考察巴戟肉和盐巴戟天中环烯醚萜苷类成分和寡糖类成分的Papp,结果见表7。在小肠不同肠段中,盐巴戟天中3 种成分的Papp均大于巴戟肉,其中水晶兰苷、去乙酰车叶草苷酸差异无统计学意义(P>0.05),耐斯糖在十二指肠和空肠差异有统计学意义(P<0.05),表明巴戟天经盐制后水晶兰苷、去乙酰车叶草苷酸及耐斯糖在小肠的肠吸收增加。
表7 盐巴戟天与巴戟肉中3 种成分Papp 比较(,×10-3 cm•s-1,n=6)

表7 盐巴戟天与巴戟肉中3 种成分Papp 比较(,×10-3 cm•s-1,n=6)
注:与盐巴戟天同一成分比较,*P<0.05
3 讨论
肠吸收是中药的主要吸收途径,研究中药在肠道中的吸收状况对改善生物利用度、给药剂量等具有指导意义[10]。对于炮制研究,比较炮制前后饮片中的有效成分的吸收特性,有助于解析其炮制机理。目前常用的在体肠吸收模型有肠襻法和肠灌流法[11]。肠灌流法是最接近体内肠道吸收状态的一种模型,分为在体单向肠灌流和在体循环肠灌流[12-13]。单向灌流法结合人体肠灌流实验灌流速度,以人体实验1/10 的灌流速度(0.2~0.3 mL/min)对大鼠进行实验,灌流时间较短(不超过2 h)。此状态接近大鼠肠道正常蠕动状态,且与人体具有良好相关性,因此本实验选用在体单向肠灌流法进行测定[14]。
小肠既能吸收药物,也能吸收水分。传统方法采用加入难吸收标记物如酚红等标记灌流液,以便计算时校正灌流液体积[15]。但酚红可被少量吸收,且对一些药物的吸收测定产生影响[16],故目前多采用重量法对药物及水分的吸收进行评价,操作更加简便、安全。依据Papp可将肠道对药物的吸收分为三类:当Papp<0.03×10-4cm•s-1时,表明肠道对此物质基本不吸收;当Papp>0.2×10-4cm•s-1时,表明此物质在肠道中吸收良好;当Papp介于上述两者之间时,表明有吸收但吸收不完全[17]。本研究显示,水晶兰苷、去乙酰车叶草苷酸、耐斯糖Papp均大于0.2×10-4cm•s-1,表明这3 种成分在小肠段吸收良好,但吸收肠段各有不同,水晶兰苷的主要吸收部位在空肠,去乙酰车叶草苷酸和耐斯糖的主要吸收部位在回肠。
盐巴戟天中环烯醚萜苷类成分和寡糖类成分在小肠中吸收良好,且经盐制后这两类成分的肠吸收特性均优于巴戟肉。但水晶兰苷、去乙酰车叶草苷酸和耐斯糖在小肠吸收时存在自身浓度抑制现象,应注意给药剂量。另外,肠道菌群对药物的肠吸收特性也会产生一定影响,为更好阐释盐巴戟天的炮制机理,还需深入进行相关研究。
