基于miR-223-3p研究淫羊藿苷治疗大鼠颅脑外伤后神经损伤的作用机制
2021-10-12房正华马宝林宋湖平代景伟孙晓欧
房正华,马宝林,宋湖平,代景伟,孙晓欧
1.厦门大学附属第一医院 神经外科,福建 厦门 361022
2.厦门大学附属第一医院 麻醉科,福建 厦门 361022
3.苏州大学附属第一医院 神经外科,江苏 苏州 215000
颅脑外伤是指由外力造成的脑组织损伤,属于神经外科常见多发病,其发病率和致残率位居各种创伤性损伤之首,给社会和家庭造成沉重负担。颅脑外伤包括原发性脑损伤和继发性脑损伤,外力机械性冲击瞬间引起原发性脑损伤,机体启动一系列生化过程,进一步损伤脑组织,导致“损伤-炎症-损伤”的恶性循环,涉及炎症、氧化应激及细胞凋亡等多个分子机制和信号通路[1]。因此,研究颅脑损伤发病机制及治疗方法对于改善患者预后及提高生存率具有重要意义。
淫羊藿是我国传统中药材,其主要活性成分为淫羊藿苷,具有抗氧化、抗炎、抗肿瘤、抗抑郁、抗骨质疏松等活性[2-4]。现代药理学研究表明,淫羊藿苷可维持神经元细胞的正常形态和功能,促进神经突出生长,减轻神经元损伤,在阿尔茨海默症、抑郁症等神经系统疾病的治疗中发挥重要作用[5-6]。微小RNA(microRNA,miRNA)参与细胞增殖、分化及凋亡等过程,在脑损伤炎症过程中发挥重要调节作用[7]。淫羊藿苷可通过调节miRNA 在软骨损伤中发挥保护作用,但其在颅脑损伤中是否可通过调节miRNA 发挥神经保护作用值得进一步研究[8]。miR-233-3p是miRNA 家族成员之一,与炎性反应密切相关,参与调节细胞凋亡过程[9]。目前尚未见miR-233-3p参与颅脑损伤后引起的炎症及神经细胞凋亡过程的相关报道。本研究通过建立颅脑外伤大鼠模型,探讨淫羊藿苷是否通过miR-233-3p对颅脑外伤引起的神经损伤发挥保护作用,为临床治疗颅脑外伤提供依据。
1 材料
1.1 动物
SPF级雄性SD大鼠85只,7周龄,体质量200~220 g,购自上海斯莱克实验动物有限责任公司,动物许可证号SCXK(沪)2017-0005。动物于温度24~26 ℃、相对湿度55%~70%、光照12 h 明/暗交替的环境下适应性饲养7 d,自由进食饮水。动物实验经厦门大学附属第一医院伦理委员会审核通过(批准号XΜULL20190061)。
1.2 细胞
人皮质神经元购自美国ATCC。
1.3 药品与试剂
淫羊藿苷(质量分数>98%,批号171123)购自南京泽郎生物科技有限公司;miR-223-3p拮抗剂(miR-223-3p antagomir)及其阴性对照(NC)由广州锐博生物科技有限公司合成;miR-223-3p拟似物(miR-223-3p mimic)、miR-223-3p抑制剂(miR-223-3p inhibitor)及其NC 由上海吉玛制药技术有限公司合成;TUNEL 试剂盒(批号GS008)购自上海碧云天生物技术有限公司;大鼠白细胞介素-18(interleukin-18,IL-18)ELISA 试剂盒(批号ab213909)、IL-1β ELISA 试剂盒(批号ab235646)、兔抗大鼠核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)单抗(批号ab264468)、半胱氨酸蛋白酶-1(Caspase-1)单抗(批号ab238972)、B 淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)多抗(批号ab194583)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)单抗(批号ab182733)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和HRP 标记的山羊抗兔IgG 抗体(批号ab6721)购自英国Abcam公司;双荧光素酶报告基因检测试剂盒(批号GΜ-040502A)购自美国Genomeditech 公司;引物由上海生工生物工程有限公司合成。
1.4 仪器
脑立体定位仪(深圳市瑞沃德生命科技有限公司);InfiniteF50 酶标仪(瑞士Tecan 公司);RΜ2050石蜡切片机(德国Leica 公司);qRT-PCR 分析系统(美国ABI 公司);Μini-Protean4 电泳仪(美国Bio-Rad 公司)。
2 方法
2.1 造模与分组
随机选取70 只大鼠,ip 1%戊巴比妥钠(50 mg/kg)麻醉,俯卧固定。选择颅顶外力打击位置,对该部位备皮消毒,沿矢状正中线无菌切开头皮,采用改良Feeney 方法[10],使用40 g 击锤从25 cm高处自由落下,撞击控制杆,经骨窗直接打击大鼠脑部,造成局部脑挫裂伤,碘伏消毒,缝合包扎伤口。撞击后大鼠出现数秒钟呼吸暂停、四肢抽搐,且麻醉消失后未出现瘫痪,视为造模成功。剔除撞击过程中死亡大鼠,另取大鼠补充造模,最终造模成功大鼠60 只,随机分为模型组、淫羊藿苷(30 mg/kg)组、淫羊藿苷(30 mg/kg)+NC 组和淫羊藿苷(30 mg/kg)+miR-223-3p antagomir组,每组15 只。另取15 只大鼠,切开头皮,但不撞击,其余操作同造模大鼠,设为对照组。
2.2 给药
2.2.1miR-223-3p antagomir及其NC给药方式 大鼠麻醉后,消毒头皮,固定于脑立体定位仪,根据脑立体定向图谱颅脑中线纵向切口,前囟前方约1.0 mm、右侧约1.5 mm 处钻孔,深度约2.5 mm,使用微量注射器将5 μLmiR-223-3p antagomir或其NC(1 nmol/L)注入侧脑室,5 min 内注射完毕,留针10 min 后拔出。骨蜡封孔,缝合切口。
2.2.2 给药 淫羊藿苷溶于双蒸水配制成质量浓度为1 mg/mL 的溶液。造模前7 d 至造模后3 d 各给药组大鼠ig 淫羊藿苷,对照组和模型组ig 双蒸水,1 次/d。淫羊藿苷组造模后30 min 侧icv 0.9%氯化钠溶液;淫羊藿苷+NC 组造模后30 min 侧icvmiR-223-3p antagomirNC;淫羊藿苷+miR-223-3pantagomir组造模后 30 min 侧 icvmiR-223-3p antagomir;对照组和模型组ig 造模后30 min 侧icv 0.9%氯化钠溶液。
2.3 淫羊藿苷对颅脑外伤大鼠改良神经功能缺损评分(modified neurological severity scores,mNSS)的影响
末次给药2 h 后,按照mNSS 评分标准[11]评价各组大鼠神经功能,观察大鼠运动(包括肌肉状态及异常动作)、感觉(包括视觉、触觉、深感觉及平衡觉)和反射状态。mNSS 评分为0~18 分,神经功能正常为0 分;分值越高,表明神经功能损伤越严重。
2.4 淫羊藿苷对颅脑外伤大鼠脑组织含水量的影响
mNSS 评分结束后,各组随机选取5 只大鼠,麻醉后处死,断头取脑,取骨窗边缘挫裂伤灶中心脑组织约200 mg,电子天平称定湿质量,放入干燥箱中,110 ℃干燥24 h,称定干质量,计算脑组织含水量。
含水量=(湿质量-干质量)/干质量
2.5 淫羊藿苷对颅脑外伤大鼠脑组织IL-18 和IL-1β 水平的影响
取脑组织100 mg,按1∶10 比例加入0.9%氯化钠溶液,制备10%脑组织匀浆,10 000 r/min 离心15 min,收集上清,按照ELISA 试剂盒说明书检测脑组织匀浆中IL-18 和IL-1β 水平。
2.6 淫羊藿苷对颅脑外伤大鼠脑组织病理变化的影响
各组随机选取5 只大鼠,麻醉大鼠,开胸暴露心脏,进行左心室-升主动脉灌注,先用0.9%氯化钠溶液进行灌注,至右心耳流出液体变清澈时,改用4%多聚甲醛灌注,大鼠表现四肢僵硬时停止灌注,断头取脑,以挫裂伤灶为中心,冠状取材(0.5 cm厚脑组织),于4%多聚甲醛中固定,乙醇脱水,二甲苯透明,制作石蜡切片(厚4 μm),苏木素-伊红(HE)染色,于显微镜下观察大脑皮质组织病理变化。
2.7 淫羊藿苷对颅脑外伤大鼠脑组织神经元凋亡的影响
取脑组织切片,常规脱蜡、水化,双蒸水冲洗,加入蛋白酶K 于37 ℃孵育30 min,以PBS 溶液冲洗;加入TUNEL 反应液于37 ℃反应60 min,以PBS 溶液冲洗;加入Counter-AP 于37 ℃孵育30 min,以PBS 溶液冲洗;加入BCIP/NBT 于37 ℃显色,自来水冲洗;加入FastRed 于37 ℃显色,晾干后封片,于显微镜下取5 个互不重叠视野,观察棕褐色TUNEL 阳性细胞,计算凋亡率。
凋亡率=TUNEL 阳性细胞数/总细胞数
2.8 淫羊藿苷对颅脑外伤大鼠脑组织miR-223-3p和NLRP3 mRNA 表达的影响
处死各组剩余大鼠,断头取脑,取挫裂伤灶中心脑皮质70 mg,按照试剂盒说明书提取总RNA 并合成cDNA,进行qRT-PCR 分析。将U6作为miR-223-3p内参,将β-actin作为NLRP3内参。引物序列:miR-223-3p上游引物5’-ACGTAGCTAGCGCCATGGTC-3’,下游引物5’-CATCGGCTAGCGATGCATCG-3’;U6上游引物5’-AGGCTAGCGCATCGCGATGC-3’,下游引物5’-ATTAGCCCAGCTAGCGCCGA-3’;NLRP3上游引物5’-CGATCGGACATCGATAGAT-3’,下游引物5’-TCGATCAGCGATGCACATG-3’;β-actin上游引物5’-ATCCGATCGAGCAGATCACGT-3’,下游引物5’-TCAGGACTGACGCATGCATCG-3’。
2.9 淫羊藿苷对颅脑外伤大鼠脑组织NLRP3、Caspase-1、Bcl-2 和Bax 蛋白表达的影响
取挫裂伤灶中心脑皮质70 mg,冰上研磨匀浆,加入裂解液,4 ℃、12 000 r/min 离心15 min,取上清,采用BCA 蛋白定量试剂盒测定蛋白质量浓度,蛋白煮沸变性,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入含5%脱脂奶粉的封闭液封闭2 h;加入NLRP3 抗体(1∶1000)、Caspase-1 抗体(1∶500)、Bcl-2 抗体(1∶500)、Bax 抗体(1∶800)和β-actin 抗体(1∶800),4 ℃孵育过夜,TBST 溶液洗涤;加入HRP 标记的IgG抗体(1∶2000),室温孵育1 h,TBST 溶液洗涤,加入ECL 发光液显色,采用Image J 软件分析蛋白条带灰度值。
2.10 双荧光素酶报告基因系统检测miR-223-3p 靶基因
运用TargetScan 等软件在线预测miR-223-3p与NLRP3互补序列,将NLRP3 的3’-UTR 序列插入报告载体中,构建野生型NLRP3 wt和突变型NLRP3 mut,使用LipofectamineTΜ2000,分别将miR-223-3p mimic、miR-223-3p inhibitor及NC 与NLRP3 wt、NLRP3 mut共转染至人皮质神经元,使用试剂盒测定荧光值。
2.11 统计学方法
分析数据采用SPSS 24.0 统计学软件,计量资料以±s表示,多样本比较采用单因素方差分析,两两比较采用LSD-t检验。
3 结果
3.1 淫羊藿苷对颅脑外伤大鼠mNSS 的影响
如图1所示,与模型组比较,淫羊藿苷组大鼠mNSS 显著降低(P<0.05);与淫羊藿苷组、淫羊藿苷+NC 组比较,淫羊藿苷+miR-223-3p antagomir组大鼠mNSS 显著升高(P<0.05)。

图1 淫羊藿苷对颅脑外伤大鼠mNSS 的影响 (±s,n=12)Fig.1 Effect of icariin on mNSS of rats with craniocerebral trauma (±s,n=12)
3.2 淫羊藿苷对颅脑外伤大鼠脑组织含水量的影响
如图2所示,与对照组比较,模型组脑组织含水量显著升高(P<0.05);与模型组比较,淫羊藿苷组脑组织含水量显著降低(P<0.05);与淫羊藿苷组、淫羊藿苷+NC 组比较,淫羊藿苷+miR-223-3p antagomir组脑组织含水量显著升高(P<0.05)。
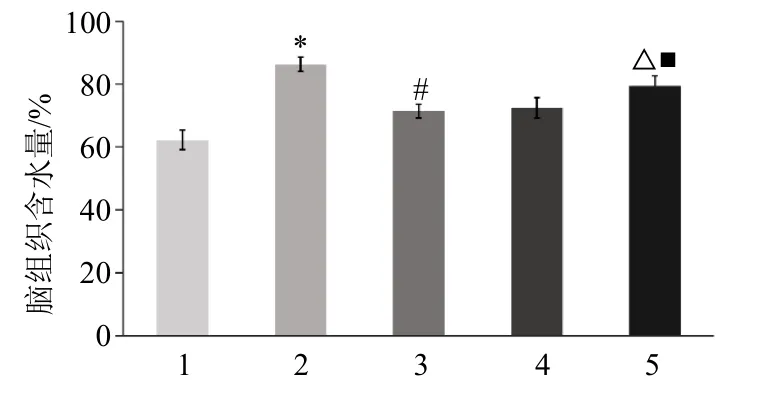
图2 淫羊藿苷对颅脑外伤大鼠脑组织含水量的影响(±s,n=5)Fig.2 Effect of icariin on brain water content of rats with craniocerebral trauma (±s,n=5)
3.3 淫羊藿苷对颅脑外伤大鼠脑组织IL-18 和IL-1β 水平的影响
如表1所示,与对照组比较,模型组脑组织IL-18 和IL-1β 水平显著升高(P<0.05);与模型组比较,淫羊藿苷组脑组织IL-18 和IL-1β 水平显著降低(P<0.05);与淫羊藿苷组、淫羊藿苷+NC组比较,淫羊藿苷+miR-223-3p antagomir组脑组织IL-18 和IL-1β 水平显著升高(P<0.05)。
表1 淫羊藿苷对颅脑外伤大鼠脑组织IL-18 和IL-1β 水平的影响 (±s,n=5)Table 1 Effect of icariin on IL-18 and IL-1β levels in brain tissue of rats with craniocerebral trauma (±s,n=5)

表1 淫羊藿苷对颅脑外伤大鼠脑组织IL-18 和IL-1β 水平的影响 (±s,n=5)Table 1 Effect of icariin on IL-18 and IL-1β levels in brain tissue of rats with craniocerebral trauma (±s,n=5)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与淫羊藿苷组比较:△P<0.05;与淫羊藿苷+NC 组比较:■P<0.05*P <0.05 vs control group;#P <0.05 vs model group;△P <0.05 vs icariin group;■P <0.05 vs icariin+NC group
组别 剂量/(mg·kg-1) IL-18/(pg·mL-1) IL-1β/(pg·mL-1)对照 — 65.26±15.12 112.58±20.15模型 — 512.36±26.36* 735.84±32.56*淫羊藿苷 30 259.47±21.15# 326.87±26.81#淫羊藿苷+NC 30 263.48±23.58 345.12±23.45淫羊藿苷+miR-223-3p antagomir 30 405.91±25.49△■ 568.48±31.72△■
3.4 淫羊藿苷对颅脑外伤大鼠脑组织病理变化的影响
如图3所示,对照组大鼠大脑皮质结构正常,神经元细胞形态规整,未见损伤灶;模型组可见明显损伤灶,神经元细胞发生空泡化,细胞减少,结构松散,红细胞聚集;淫羊藿苷组和淫羊藿苷+NC组损伤面积、神经元空泡化及红细胞数较模型组均减少;淫羊藿苷+miR-223-3p antagomir组损伤灶较损伤组有所减小,但效果不及淫羊藿苷组和淫羊藿苷+NC 组,仍可见空泡化细胞,红细胞聚集。
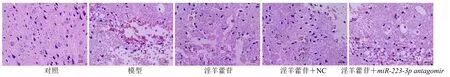
图3 淫羊藿苷对颅脑外伤大鼠脑组织病理变化的影响 (HE,×400)Fig.3 Effect of icariin on pathological changes of brain tissue of rats with craniocerebral trauma (HE,× 400)
3.5 淫羊藿苷对颅脑外伤大鼠脑组织神经元凋亡的影响
如图4所示,与对照组比较,模型组大脑皮质神经元凋亡率显著升高(P<0.05);与模型组比较,淫羊藿苷组大脑皮质神经元凋亡率显著降低(P<0.05);与淫羊藿苷组、淫羊藿苷+NC 组比较,淫羊藿苷+miR-223-3p antagomir组大脑皮质神经元凋亡率显著升高(P<0.05)。

图4 淫羊藿苷对颅脑外伤大鼠脑组织神经元凋亡的影响Fig.4 Effect of icariin on neuronal apoptosis of brain tissue of rats with craniocerebral trauma
3.6 淫羊藿苷对颅脑外伤大鼠脑组织miR-223-3p和NLRP3 mRNA 表达的影响
如图5所示,与对照组比较,模型组脑组织miR-233-3pmRNA 表达水平显著降低(P<0.05),NLRP3mRNA 表达水平显著升高(P<0.05);与模型组比较,淫羊藿苷组脑组织miR-233-3pmRNA 表达水平显著升高(P<0.05),NLRP3mRNA 表达水平显著降低(P<0.05);与淫羊藿苷组、淫羊藿苷+NC 组比较,淫羊藿苷+miR-223-3p antagomir组脑组织miR-233-3pmRNA 表达水平显著降低(P<0.05),NLRP3mRNA 表达水平显著升高(P<0.05)。

图5 淫羊藿苷对颅脑外伤大鼠脑组织 miR-223-3p 和NLRP3 mRNA 表达的影响 (±s,n=5)Fig.5 Effect of icariin on miR-223-3p and NLRP3 mRNA expressions in brain tissue of rats with craniocerebral trauma (±s,n=5)
3.7 淫羊藿苷对颅脑外伤大鼠脑组织NLRP3、Caspase-1、Bcl-2 和Bax 蛋白表达的影响
如图6所示,与对照组比较,模型组脑组织NLRP3、Bax 和Caspase-1 蛋白表达水平显著升高(P<0.05),Bcl-2 蛋白表达水平显著降低(P<0.05);与模型组比较,淫羊藿苷组脑组织NLRP3、Bax和Caspase-1蛋白表达水平显著降低(P<0.05),Bcl-2 蛋白表达水平显著升高(P<0.05);与淫羊藿苷组、淫羊藿苷+NC 组比较,淫羊藿苷+miR-223-3p antagomir组脑组织NLRP3、Bax 和Caspase-1 蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平显著降低(P<0.05)。

图6 淫羊藿苷对颅脑外伤大鼠脑组织NLRP3、Caspase-1、Bcl-2 和Bax 蛋白表达的影响 (±s,n=5)Fig.6 Effect of icariin on NLRP3,Bcl-2,Bax,Caspase-1 protein expressions in brain tissue of rats with craniocerebral trauma (±s,n=5)
3.8 双荧光素酶报告基因系统检测miR-233-3p 对NLRP3 的靶向性
如图7所示,转染miR-233-3p mimic后,NLRP3 wt相对荧光素酶活性显著降低(P<0.05),转染miR-233-3p inhibitor后,NLRP3 wt相对荧光素酶活性显著升高(P<0.05)。

图7 miR-233-3p 靶向调控NLRP3Fig.7 miR-233-3p target and regulate NLRP3
4 讨论
本研究成功建立颅脑外伤大鼠模型,损伤部位准确一致,与临床脑组织局部创伤发生机制相似,能够反映颅脑损伤相关生理病理机制。颅脑损伤包括原发性损伤和继发性损伤,氧化应激反应、炎性反应、自由基损伤以及神经毒性均在损伤过程中发挥重要作用,其中炎性反应在继发性损伤中至关重要[12]。颅脑损伤后即引起局部炎性反应,造成局部神经组织变性坏死、血脑屏障破坏、神经毒性增加等,加重患者病情,因此抑制炎性反应引起的坏死性凋亡是治疗颅脑损伤的重要环节[13]。
脑水肿和细胞凋亡是颅脑外伤主要病理表现,外力损伤脑部后导致脑水肿,引起血脑屏障通透性增加,产生大量自由基,不仅加重水肿症状,产生炎症级联反应,同时还可导致神经兴奋性增加,损伤神经元细胞,进而导致细胞凋亡,引起神经缺损症状[14]。通过药物抑制神经炎性反应、防治神经元细胞凋亡、减少继发性脑损伤,可有效改善患者预后。研究发现,淫羊藿苷具有明显的抗炎作用,注射淫羊藿苷可减轻猪牙周炎局部炎性反应,促进牙周组织再生[15]。淫羊藿苷在皮瓣缺血再灌注损伤动物模型中也具有明显的抗炎作用,可提高皮瓣存活率,减轻皮瓣再损伤[16]。此外,淫羊藿苷还具有明显的神经保护作用,可抑制帕金森小鼠中促炎因子产生,减轻神经毒性[17]。IL-18、IL-1β 在脑损伤炎症中发挥重要作用,抑制二者水平可明显减轻缺血性脑卒中炎性反应,改善神经缺陷[18]。本研究结果显示,与模型组比较,淫羊藿苷组大鼠mNSS 降低,脑组织含水量降低,脑组织IL-18 和IL-1β 水平降低,神经元细胞凋亡率降低,脑组织病理学改善明显,提示淫羊藿苷可减轻颅脑外伤大鼠炎性反应,改善继发性脑损伤,还可抑制神经元细胞凋亡,从而发挥神经保护作用。
miRNA 是高度保守的小分子RNA,参与调控多种基因表达,其表达水平与组织、细胞的病理生理过程有关,其异常表达反映机体病理状态,可作为疾病治疗靶点。miR-223是一种重要miRNA,可通过多种途径调节炎性反应,在肺炎、结肠炎等炎症性疾病中发挥免疫调节作用[19-20]。miR-223-3p在幽门螺旋杆菌相关性胃炎中异常表达,诱导促进胃癌发生发展[21]。脑损伤后,NLRP3 炎症小体激活,Caspase-1 表达增加,促使IL-18、IL-1β 等促炎因子成熟和分泌,诱导细胞凋亡,表现为抑凋亡基因Bcl-2 表达降低,促凋亡基因Bax 表达升高[22]。miR-223-3p可靶向调控NLRP3,减轻炎性反应,减少神经元细胞损伤,从而发挥脑保护作用[23]。淫羊藿苷可抑制NLRP3 介导的细胞凋亡,减轻骨关节炎症状[24]。本研究结果显示,模型组脑组织miR-223-3pmRNA 表达水平低于对照组,而淫羊藿苷组miR-223-3pmRNA 表达水平升高,提示淫羊藿苷可能对miR-223-3p表达具有调节作用。为验证淫羊藿苷是否通过miR-223-3p发挥作用,大鼠ig 淫羊藿苷同时注射miR-223-3p antagomir,发现miR-223-3pmRNA 表达水平低于淫羊藿苷组,表明淫羊藿苷可调节颅脑外伤大鼠脑组织miR-223-3p表达;NLRP3mRNA 表达与miR-223-3pmRNA 表达趋势相反,双荧光素酶实验结果显示,miR-223-3p可直接靶向调节NLRP3 表达;抑制miR-223-3p表达后,与淫羊藿苷组比较,淫羊藿苷+antagomir组脑组织NLRP3、Bax 和Caspase-1 蛋白表达水平升高,Bcl-2 蛋白表达水平降低,提示淫羊藿苷通过上调miR-223-3p表达,靶向抑制NLRP3 炎症小体功能,从而抑制下游Caspase-1 蛋白表达,减少神经元细胞凋亡。
综上所述,淫羊藿苷对颅脑外伤大鼠具有神经保护作用,可能通过调控miR-223-3p表达、抑制其靶蛋白NLRP3 表达、减轻炎性反应、减少神经元细胞凋亡从而发挥脑保护作用。
利益冲突所有作者均声明不存在利益冲突
