无血清扩增犬脐带间充质干细胞治疗犬急性肾损伤研究
2021-10-12赵文亮蔺春恒卢宏宇孙玉忠朱大帷张树义
赵文亮,张 宏,蔺春恒,郭 洋,,卢宏宇,孙玉忠,朱大帷,张树义
(1.沈阳农业大学动物科学与医学学院,沈阳 110161;2.辽宁派美特生物技术有限公司,沈阳 110041;3.辽宁省农业发展服务中心,沈阳 110065)
急性肾损伤(AKI)是一种常见的临床综合征,其特征是肾功能突然丧失,导致酸碱失衡、电解质代谢紊乱、内分泌功能障碍,最终导致多器官功能障碍和严重肾功能损伤[1]。急性肾功能损伤是宠物,特别是年长犬的常见病,通常会导致严重的并发症和高死亡率[2]。除支持性治疗外,目前最有效的治疗方法是透析和肾移植[4],这些治疗效果有限,费用昂贵。因此,迫切需要一种新的治疗AKI的方法。
越来越多的研究表明,间充质干细胞(MSCs)可能是治疗AKI的一种有前途的治疗应用。由于它们没有免疫原性,因此不需要免疫抑制,并且能够迁移到损伤部位,通过多种机制改善肾损伤器官的结构和功能损害,包括调节免疫系统[5]。大量试验表明,MSCs,包括脂肪来源的间充质干细胞(AD-MSCs),可以缓解急性肾损伤或慢性肾脏损伤[6-9]。
然而,细胞疗法在兽医再生医学中的应用日益增加,作为间充质干细胞来源的脐带组织在兽医再生医学中的应用仍处于起步阶段,仍需要更详细的方法来分离、培养和鉴定这些细胞[10]。此外,随着无血清培养基的发展,已经有研究表明,无血清培养基商品能够稳定扩增犬间充质干细胞[11-12]。因此,本试验通过胶原酶法分离脐带组织,无血清培养犬UC-MSCs并进行鉴定,应用到犬急性肾损伤的临床治疗,以期为细胞治疗在兽医再生医学领域的应用提供新选择。
1 材料与方法
1.1 材料
1.1.1 犬肾损伤病例13岁雌性吉娃娃病犬,体重4kg,就诊前于当地其他动物医院进行双后肢髌骨手术,术后发生急性肾功能不全。临诊精神沉郁,无食欲饮欲,脱水状态评估8%;犬主人主诉有呕吐及腹泻情况,尿量较少。
1.1.2 临床检查对病犬进行血常规检查、常规传染病检查、超声检查及血液生化检查。
1.1.3 主要试剂I型胶原酶(Gibco)、无血清培养基套装(友康生物)、诱导分化试剂盒(Cyagen)、RNA提取试剂盒(QIAGEN)、反转录试剂盒(TaKaRa)。
1.1.4 主要仪器超净工作台(AIRTECH)、倒置显微镜(Nikon)、CO2培养箱(Thermo)、PCR仪(Applied Biosystems)。
1.2 方法
1.2.1 UC-MSCs的分离与培养脐带间充质干细胞来源于犬在剖腹产手术时所产生的废弃脐带组织,将脐带组织无菌带回实验室。用PBS缓冲液反复清洗脐带组织,挑除血管,尽量剪碎,用0.2%Ⅰ型胶原酶,37℃震荡消化60min。终止消化后用80目的细胞筛网过滤,在1500r·min-1离心5min后得到细胞悬液,将所得沉淀用无血清完全培养基重悬,并接种于T25瓶中,放于37℃、5%CO2培养箱中培养。原代细胞培养48h时进行第1次换液,以后每隔3d换1次液,待原代细胞生长至80%~90%汇合度时,进行传代计数,按5000·cm-2接种于T25瓶中培养,选用P3代细胞进行临床治疗及鉴定。
1.2.2 UC-MSCs的形态在倒置显微镜下观察培养瓶中的细胞形态。
1.2.3 细胞生长曲线制作取生长良好的P2、P5代细胞,以2×104·mL-1接种于24孔板,每天同一时间点随机选取3孔进行消化计数,连续8d,未消化的细胞每隔3d进行换液。以天数为横坐标,以细胞数量为纵坐标,绘制细胞生长曲线。
1.2.4 计算群体倍增时间(PDT)为比较不同代数MSCs的增殖速率,使用以下公式来计算细胞群体倍增时间(PDT)。
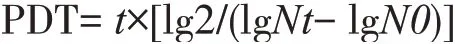
式中:t为细胞培养的时间(h);Nt为培养t时间后细胞的数量;N0为初始接种的细胞数量。
1.2.5 PCR验证MSCs表面标记基因表达情况总RNA提取,cDNA合成和PCR基因检测引物设计如表1。检测CD90、CD44、CD73、CD90、CD105等间充质干细胞表面标志物的相关基因。取P3代传代细胞,试剂盒提取总RNA,浓度由酶标仪测定。反转录成cDNA,-20℃保存备用。并将cDNA作为模板,在95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸40s,进行35个循环;72℃延伸8min进行PCR扩增。在1.5%的琼脂糖凝胶中电泳检测PCR扩增产物。

表1 MSC表面标记基因引物序列Table 1 Primer sequence of MSC surface marker gene
1.2.6 UC-MSCs成骨诱导分化选取P3代的UC-MSCs,以细胞浓度为5×104·mL-1接种到6孔板中,每孔加入2mL无血清干细胞完全培养基,置于37℃、5%CO2培养箱中培养,直到细胞长满整个底面后,更换成骨诱导分化培养基,每3d进行1次换液,连续培养21d后,通过4%多聚甲醛固定细胞,再进行茜素红染色,将培养板置于显微镜下观察成骨诱导结果。
1.2.7 UC-MSCs成脂诱导分化选取P3代的UC-MSCs,以细胞浓度为5×104·mL-1接种到6孔板中,每孔加入2mL无血清干细胞完全培养基,置于37℃、5%CO2培养箱中培养,直到细胞长满整个底面后,更换成脂诱导分化培养基,A液和B液交替换液,连续培养21d后,通过4%多聚甲醛固定细胞,再进行油红O染色,将培养板置于显微镜下观察成脂诱导结果。
1.2.8 UC-MSCs成软骨诱导分化选取P3代的UC-MSCs,将细胞悬液以2×106·mL-1离心后放入15mL离心管中,加入成软骨诱导分化培养基,置于37℃、5%CO2培养箱中培养,每3d进行1次换液,连续培养21d后,对管中软骨球进行福尔马林固定,再经石蜡包埋后切片后进行阿利辛蓝染色,在显微镜下观察成软骨诱导结果。
1.2.9 常规治疗调整酸碱度,治疗及防止代谢性酸中毒情况。大量输液及视情况使用利尿剂,增加肾脏灌流量及排尿量。选择对肾脏损伤小的抗生素进行抗感染治疗。及时观察患犬的精神状态,对体温、心率、血压、脉搏、可视粘膜和尿量等进行实时监控。
1.2.10 干细胞治疗在常规治疗的基础上,采取联合干细胞治疗的方式。将犬UC-MSCs按照病犬体重(1×106·kg-1)用生理盐水稀释,再通过静脉注射的方式移植到病犬体内,共回输3次,每次间隔1周。
2 结果与分析
2.1 病例检测结果
由表2和表3可知,生化肝肾功能指标(肌酐389μmol·L-1、尿素氮>46.4mmol·L-1、无机磷4.40mmol·L-1、丙氨酸转氨酶186U·L-1、碱性磷酸酶1544U·L-1)均明显超过正常参考值范围;血常规检查显示白细胞为26.83×109·L-1,超过正常参考值范围;超声结果显示肾肿大;常规传染病检查为阴性。结合各项的检测指标,诊断该犬为急性肾损伤。
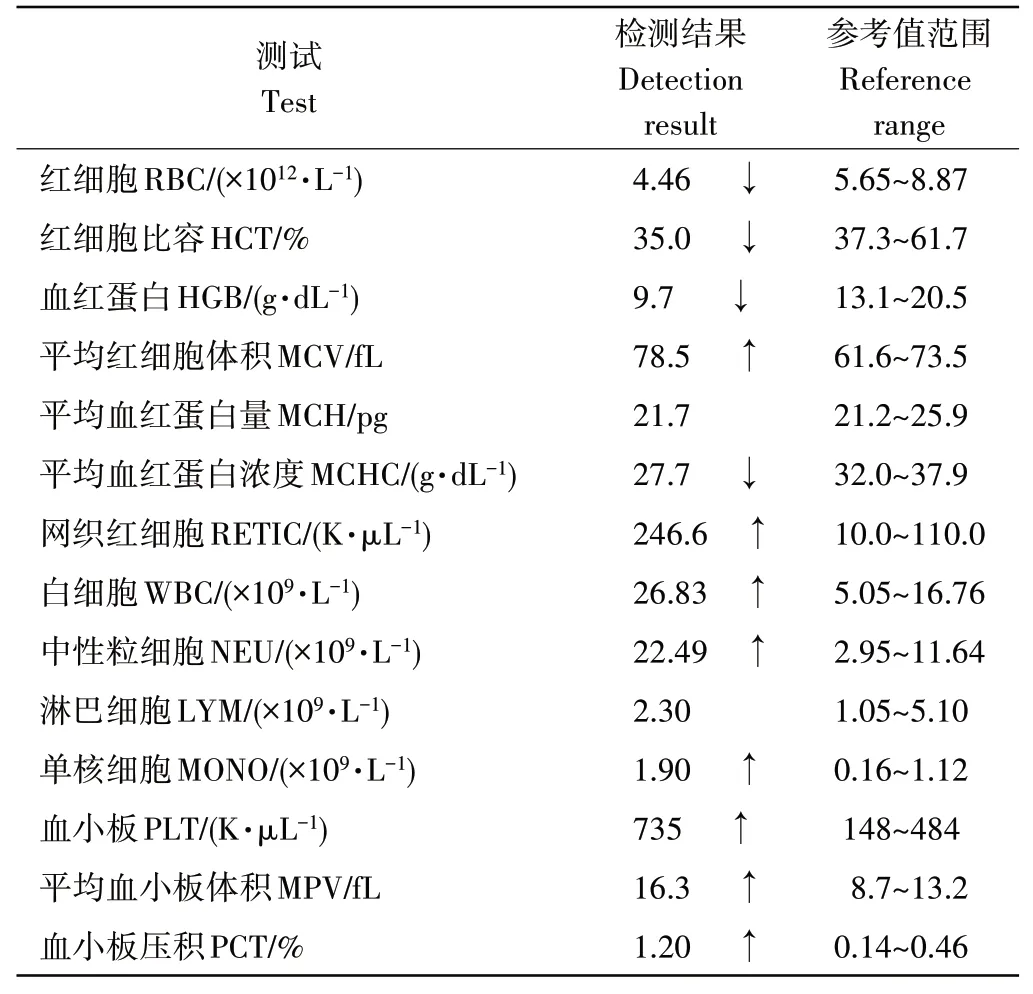
表2 血常规检测结果Table 2 Blood routine test result
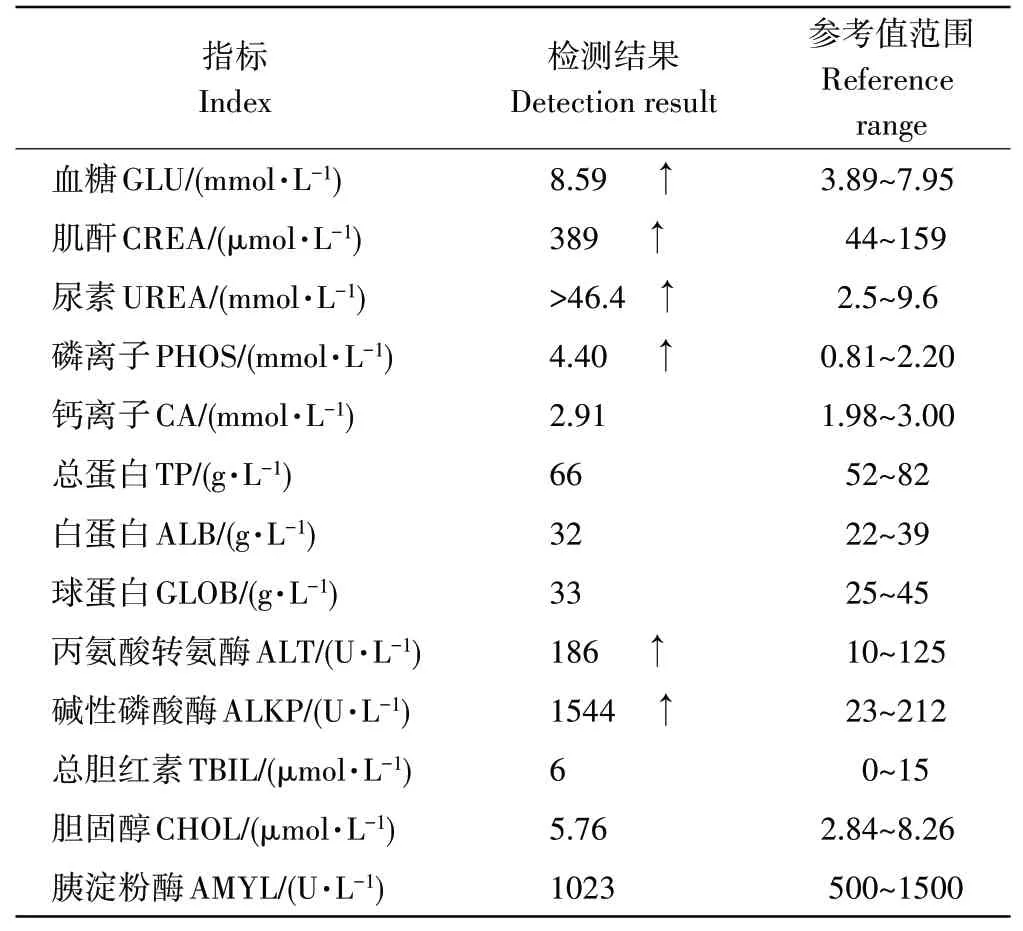
表3 血液生化指标检测结果Table 3 Blood biochemical indexes test result
2.2 UC-MSCs的形态特征
在显微镜下观察原代培养的细胞,可见到长梭形等不规则形状(图1A)。细胞培养到P3代时,在显微镜下可以观察到细胞呈长梭形或多边形等,聚集性生长,局部可形成漩涡状(图1B)。
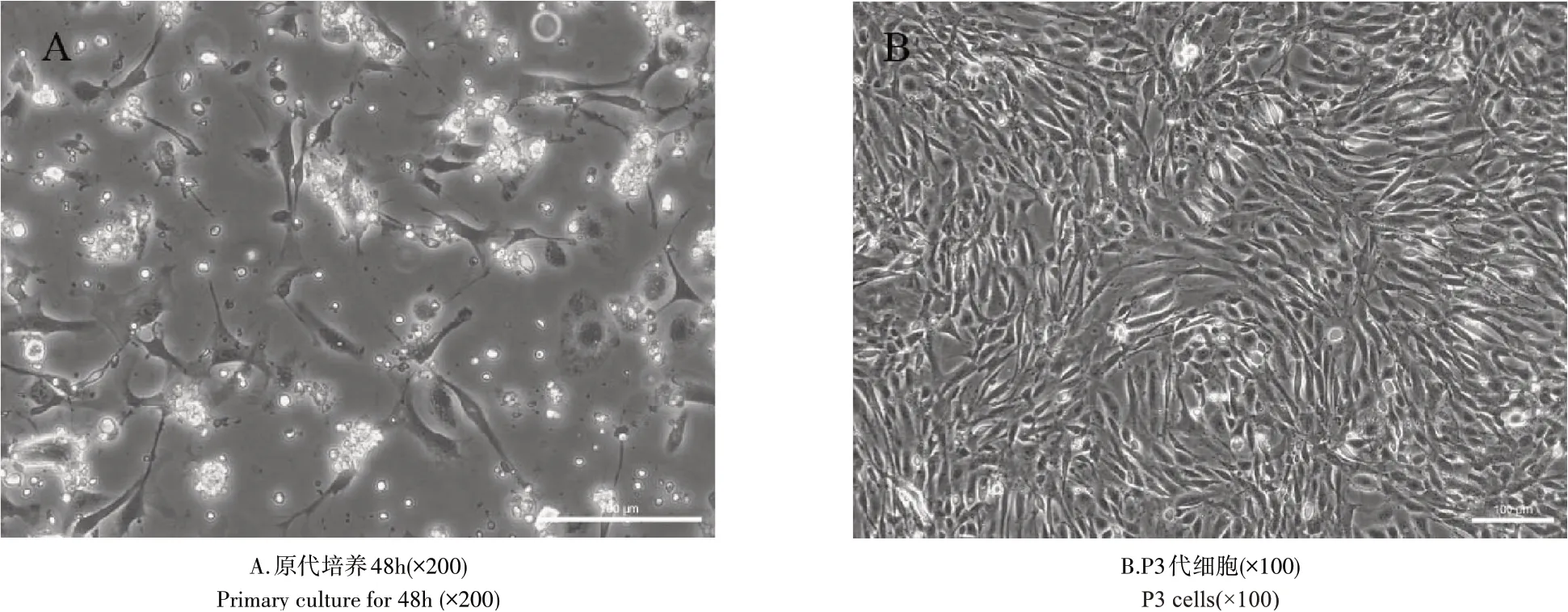
图1 犬UC-MSCs的细胞形态Figure 1 Cell morphology of canine UC-MSCs
2.3 犬UC-MSCs生长曲线及群体倍增时间
犬UC-MSCs在传代后1~2d为潜伏期,细胞增殖不明显,第3~5天为对数生长期,第6~8天为平台期(图2)。根据P3、P6代细胞生长曲线得到UC-MSCs的平均群体倍增时间分别为(26.65±1.48)h和(36.87±1.65)h(图3)。说明随着代数的增加,细胞增殖能力降低。
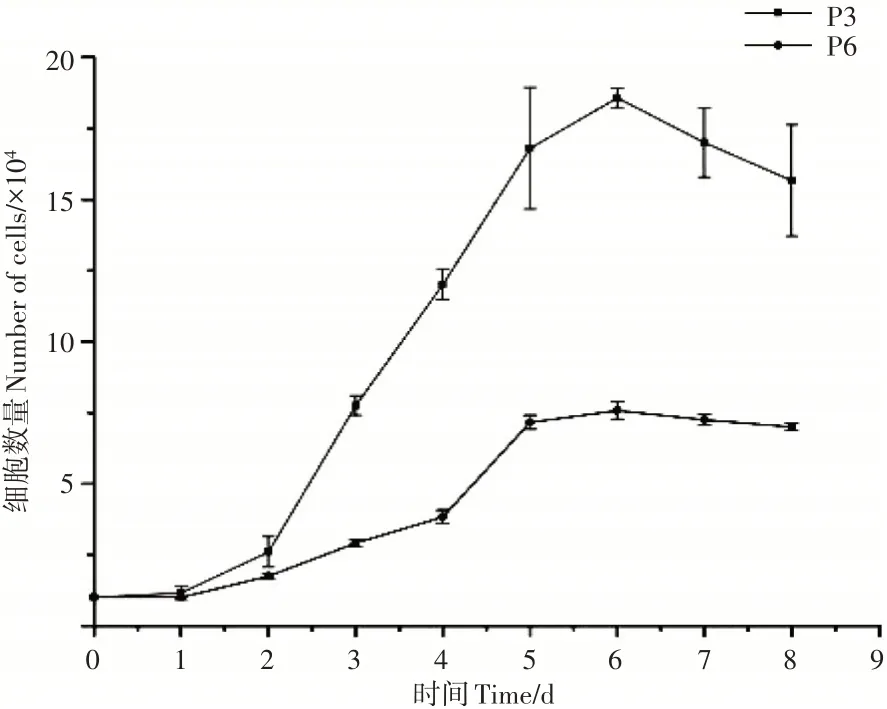
图2 犬UC-MSCs生长曲线Figure 2 Growth curve of canine UC-MSCs
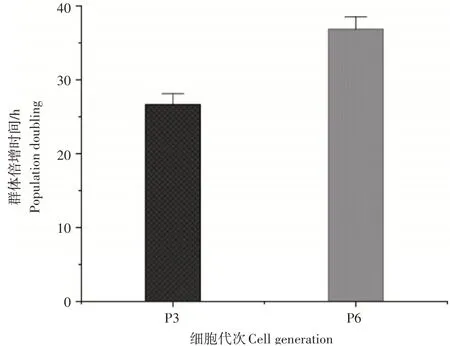
图3 犬UC-MSCs群体倍增时间Figure 3 Multiplication time of canine UC-MSCs population
2.4 犬UC-MSCs表面标记基因表达
由图4可知,除国际细胞治疗协会认定的3个MSCs表面标记CD73、CD90、CD105外,犬UC-MSCs还表达CD44,但不表达CD34、CD45,符合MSCs的鉴定标准。
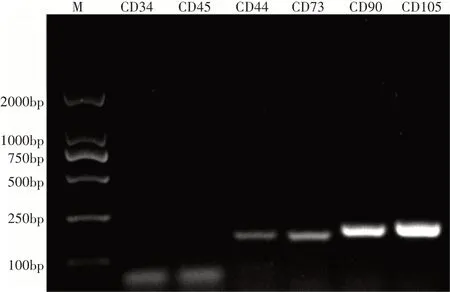
图4 PCR验证细胞表面标记基因表达Figure 4 PCR verification of cell surface marker genes
2.5 犬UC-MSCs诱导分化
成骨诱导液对细胞进行21d诱导培养后进行茜素红染色,在显微镜下观察,可见UC-MSCs中钙结节被染成红色(图5A)。成脂诱导液对细胞进行21d诱导培养后进行油红O染色,在显微镜下观察,可UC-MSCs胞质中的小脂滴被染成红色(图5B)。软骨诱导液对细胞进行21d立体诱导培养后对软骨球进行福尔马林固定和石蜡包埋切片,最后进行阿利辛蓝染色,在显微镜下观察,软骨组织中的内酸性粘多糖被染成蓝色(图5C)。

图5 犬UC-MSCs的多向诱导分化Figure 5 Multi-directional induced differentiation of canine UC-MSCs
2.6 UC-MSCs的联合治疗效果
在常规的治疗基础上,联合干细胞的治疗,每周进行1次干细胞静脉回输移植,连续回输3周。在治疗前,该病犬精神沉郁、食欲不振、不能站立。由表4可知,在第1次回输1周后,肾脏的生化指标均有下降如肌酐下降至119μmol·L-1、尿素下降至21.0μmol·L-1、磷离子下降至1.88μmol·L-1,除尿素数值外,其他指标都恢复到正常范围内,病犬的精神状态也基本恢复正常,食欲增加;干细胞连续治疗3周后,病犬状态有所好转。在干细胞治疗结束两周后进行复查,尿素14.7μmol·L-1接近参考范围,其余各项指标稳定在正常参考值范围内。

表4 干细胞治疗前后犬的血液生化指标变化结果Table 4 Changes of blood biochemical indexes in dogs before and after stem cell treatment
3 讨论与结论
目前,MSCs在兽医临床治疗方面具有良好的安全性和应用前景[14-15],然而,UC-MSCs在动物治疗肾脏疾病方面的临床应用研究较少,并且在动物细胞疗法上,无血清的应用还尚未有相关报道,无血清扩增的MSCs与胎牛血清扩增的MSCs具有相似的生物学特性,同时能够避免胎牛血清存在的安全隐患[11]。UC-MSCs的获取方式便捷、道德伦理限制较低,是一种理想的干细胞来源,更重要的是,收集过程不会对母体或胎儿造成任何的损害[16]。UC-MSCs拥有较强分化能力,几乎没有免疫排斥反应等优点,在MSCs治疗中是一种新的研究方向[17-18]。
有研究表明,烧伤对大鼠模型可造成AKI损伤,通过静脉注射UC-MSCs,能够促进烫伤后肾脏细胞的存活,防止细胞凋亡,减轻肾脏损伤,表明UC-MSCs移植是治疗肾损伤的一种潜在的治疗方法[19]。同时,姚惟琦[20]的研究表明,MSC注射对顺铂诱导的AKI大鼠肾脏组织结构和功能均有十分明显的修复作用,试验数据表明,AD-MSCs无论是体内或者体外试验,均显示出对顺铂诱导的AKI极强的恢复作用。还有文献表明,使用MSC以静脉注射的方式治疗犬AKI,通过观察患病犬血清中肌酐、尿素和磷离子等指标,发现MSC治疗对肾脏都有明显的治疗效果[21-22]。本研究病例是通过常规治疗的方式联合静脉注射UC-MSCs来治疗AKI,临床结果表明,联合治疗1周后,肌酐、尿素和磷离子的数值都有所下降,并且肌酐与磷离子都恢复到了正常范围内,尿素的数值下降到接近正常值。
MSC治疗急性肾损伤修复的主要机制:MSC回输到体内后,会识别受损肾脏组织释放的信号并迁移至受损区域[23],分化成肾小管上皮细胞等肾脏细胞[24-25],恢复肾脏的形态和功能。还有研究发现,MSC回输后,肾脏中炎症因子和氮氧化合物等物质明显减少,而白介素10,转化生长因子等物质明显增加,从而促进了受损肾脏细胞的存活和修复[26]。总之MSC对肾损伤快速修复、减轻肾组织炎症、促进肾细胞增殖等起到了重要作用。
MSCs用于临床细胞疗法的前提是经体外培养,得到足够数量的细胞,并进行鉴定。生物学特性是鉴定MSCs的标准,主要是其贴壁生长,能够自我更新,在体外诱导可分化为成骨细胞、脂肪细胞、软骨细胞等,以及对其表面标记进行鉴定。本研究通过体外无血清培养犬UC-MSCs,所培养的细胞符合以上鉴定标准,并且在临床移植后的安全性和有效性得到了确定。
