番茄Dicer-like蛋白基因家族生物信息学与表达分析
2021-10-12高振华李漾漾齐明芳李天来刘玉凤
高振华,李漾漾,王 峰,齐明芳,李天来,刘玉凤
(沈阳农业大学园艺学院/设施园艺省部共建教育部重点实验室/北方园艺设施设计与应用技术国家地方联合工程研究中心(辽宁),沈阳 110161)
植物生长发育过程中会遇到各种逆境胁迫,植物会通过基因调控网络参与逆境胁迫的反应。其中,植物产生一种RNA干扰(RNAi)途径,以抑制包括胁迫反应在内的不同生命阶段的不同生物过程[1-2]。Dicer-like蛋白是RNAi途径不可缺少的参与者,Dicer-Like蛋白通过将互补的双链RNA(dsRNA)生成小RNA双链体(21~24个核苷酸)来启动RNAi过程。植物Dicer-like protein(DCL)蛋白是一个保守的dsRNA特异性核糖核酸内切酶,属于RNaseⅢ家族,在RNA降解、转录后基因表达调控和抗逆、抗病毒侵染等方面具有重要作用[3]。
DCL家族蛋白是miRNA和siRNA生物合成途径中的关键成分,它们是将长的双链RNA加工为成熟mi⁃croRNA的关键[4]。DCL蛋白特异性切割dsRNA或者pre-miRNA(前体RNA),最终产生包括microRNA(miR⁃NA)以及small/short interfering RNA(siRNA)在内的2种非编码小RNA。这2种小RNA在双链RNA结合蛋白的作用下以反义单链的形式与Argonaute(AGO)蛋白以及其他的核糖核酸酶(RNase)结合形成RNA诱导的沉默复合体(RISC),RISC能够在AGO的作用下特异性与同源靶标mRNA结合,并降解这些靶标mRNA[5]。miRNAs和siRNAs都能诱导RNA沉默,并在调节基因组稳定性、植物生长发育以及适应逆境方面发挥重要作用[6]。
番茄中鉴定出7个DCLs,包括SlDCL1、SlDCL2s、SlDCL3和SlDCL4,共4个亚类。分析逆境下DCLs蛋白基因的变化,可以更好地理解RNAi途径在番茄抗逆途径中起到的作用。
1 材料与方法
1.1 材料
试验于2019年10月在沈阳农业大学北山基地的现代化日光温室内进行,供试番茄(Solanum lycopersicum)品种为辽园多丽。试验所用激素ABA、GA、SA、IAA和Me-JA皆为索莱宝公司产品(分析纯,浓度大于99.9%)。NaCl为国药集团化学试剂有限公司产品(浓度大于96%),PEG2000(15%)为Sigma产品。
核酸与蛋白质序列数据来自NCBI(https://www.ncbi.nlm.nih.gov/)与番茄基因组数据库(http://solgenomics.net),用于蛋白质基本理化性质分析、蛋白结构域的预测、染色体定位分析、进化树构建与设计qRT-PCR引物。
1.2 方法
穴盘育苗,待植株长到4叶1心时,移植于12cm×13cm的塑料钵内,并移至人工气候室,低温处理幼苗。低温处理的植株每晚18∶00将温度调至6℃,翌日6∶00将温度调至25℃,对照组昼/夜温度为25℃/15℃。激素与胁迫处理幼苗位于对照组人工气候室,分别喷施ABA(40mg·L-1)、GA(40mg·L-1)、SA(2mmol·L-1)、IAA(20mg·L-1)、Me-JA(0.1mmol·L-1)、PEG(15%)和NACl(2mmol·L-1),8∶00使用微量喷雾器均匀喷洒番茄全株,以叶面有水珠为准。持续处理2d,处理期间光周期均为12h,光照为自然光照(300~600μmol·m-2·s-1),每个处理15株,3次重复,采用单株取样,测定叶为完全展开的第4片功能叶,对叶、茎、根、花柄、花萼、花瓣、花托、雄蕊、雌蕊、总花、以及绿熟期、转色期、坚熟期和完熟期4个时期的果实中的RNA进行提取并鉴定SlDCLs的表达水平。
1.2.1 番茄SlDCLs蛋白家族成员序列获得与进化树构建在番茄基因组数据库,通过关键词Dicer-like搜索,得到SlDCLs家族基因的基因号(SlDCL1,Solyc10g005130.2;SlDCL2a,Solyc06g048960.2;SlDCL2b,Solyc11g 008540.1;SlDCL2c,Solyc11g008520.1;SlDCL2d,Solyc11g008530.1;SlDCL3,Solyc08g067210.2;SlDCL4,Solyc07g 005030.2),获得SlDCLs基因家族成员的CDS序列与蛋白序列。NCBI搜索拟南芥、烟草、马铃薯、水稻、葡萄、玉米的基因序列,使用MEGA7构建系统发育进化树。
1.2.2 生物信息学分析采用在线软件对SlDCLs蛋白家族成员进行理化性质分析(ExPASy,https://web.expasy.org/protparam)和蛋白基本结构域预测分析(http://www.ebi.ac.uk/interpro/search/sequence/),利用TBtools进行染色体定位分析[7]。
1.2.3 番茄总RNA提取与DNA提取选取番茄幼苗第4片功能叶分别在处理0,1,4,8,12,24,48h取样,液氮冷冻,-80℃保存,用于RNA提取。使用康为世纪植物总RNA提取试剂盒提RNA,1%琼脂糖凝胶电泳检测纯度和完整性,具有合格OD值以及完整性高的RNA用于cDNA合成。采用PrimeScript™RT Master MiX(Perfect Real Time)(Takara)试剂盒反转录不同处理的RNA获得cDNA用于qRT-PCR。采用Vazyme公司的ChamQ Uni⁃versal SYBR qPCR Master Mix说明书进行qRT-PCR,验证各基因在不同胁迫处理中的表达量。每个样品3次重复,以番茄actin为内参基因,使用2-ΔΔCT值方法计算DCLs,家族基因在不同胁迫处理下不同处理时间的相对表达量。
1.2.4 顺势作用元件预测与可视化参考番茄基因组数据库(http://solgenomics.net),选取SlDCLs基因上游的2200bp序列作为启动子参考序列,利用PlantCare在线软件对测序正确的启动子序列进行启动子顺式作用元件预测分析,使用TBtools工具进行顺势作用元件可视化。
1.2.5SlDCLs基因家族成员的表达分析为进一步了解SlDCLs基因的表达情况,利用qRT-PCR方法检测SlDCLs基因在辽源多丽番茄不同逆境和不同组织部位的表达情况。设计SlDCLs基因的定量引物,并以actin基因作为内参基因,采用荧光定量qPCR仪进行实验,重复3次。采用2-△△CT法计算表达量,采用Excel和SPSS进行数据处理和差异显著性分析。引物序列见表1。

表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 番茄DCLs蛋白的基本理化性质
使用在线软件对7个SlDCLs蛋白进行基本理化性质分析(表2),发现DCLs都属于大分子蛋白,其相对分子量都大于5000,氨基酸数目为1370aa(SlDCL2d)~1914aa(SlDCL1),等电点为5.95(SlDCL1)~7.07(SlDCL2b),为带负电荷蛋白,除此之外,SlDCLs都属于不稳定蛋白,亲疏水性预测7个蛋白的值都为负值,属于亲水性蛋白。由于DCLs是核蛋白,预测SlDCLs的亚细胞位置,发现SlDCLs可能位于细胞核,与已经报道的AtDCLs相似[8-11]。
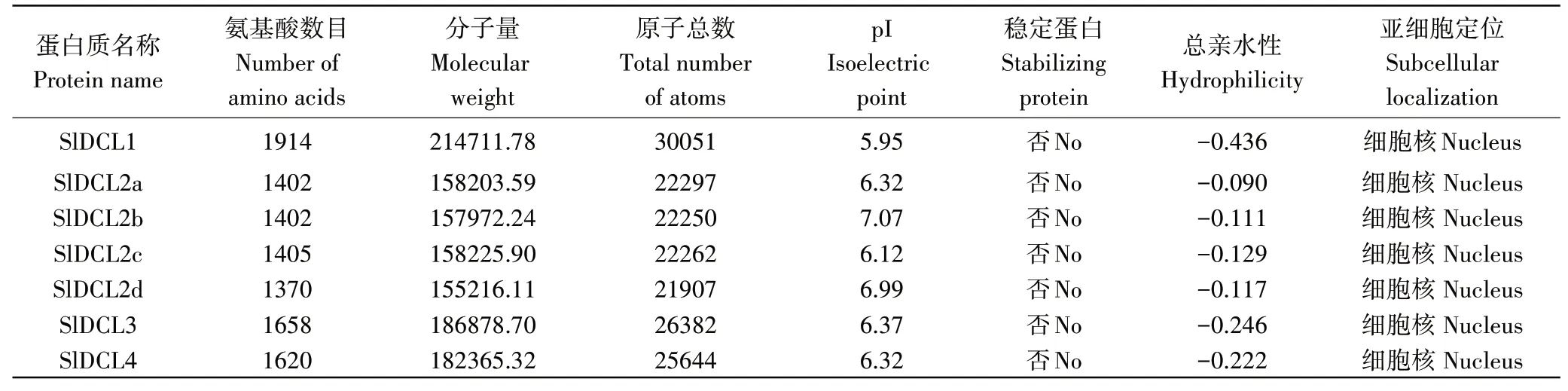
表2 SlDCLs蛋白质的基本理化性质Table 2 Analysis of basic physical and chemical properties of SlDCLs protein
2.2 染色体定位
为了解番茄DCLs在染色体上的分布情况,对7个番茄DCLs进行了染色体定位分析(图1),发现7个DCLs不均匀的分布于5个不同的染色体上,其中SlDCL1位于10号染色体上,SlDCL2a位于6号染色体,SlDCL2b,SlDCL2c和SlDCL2d位于11号染色体上,SlDCL3定位于8号染色体,SlDCL4在7号染色体上。进一步分析发现在11号染色体上有基因簇存在的特点。
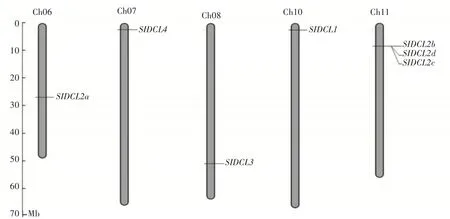
图1 番茄DCLs基因家族成员在染色体上的分布Figure 1 Distribution of tomato DCLs gene family members on chromosome
2.3 DCLs蛋白结构域
为更好的了解DCLs蛋白的信息,使用InterPro预测DCLs家族蛋白的保守结构域(图2)。DCL蛋白主要有DEAD box、RNA解旋酶结构域(Helicase)、PAZ、RNaseⅢ和dsRBD。同一家族蛋白基因基本都有相似的结构域,SlDCL2a、2b、2c和2d缺少dsRBD,而SlDCL3仅具有1个dsRBD。DEAD box、RNA解旋酶结构域在RNA代谢中起着重要的作用,包括mRNA的修复、转录和pre-mRNA和rrRNA的加工、基因的剪接和编辑、RNA稳定性的调节和翻译、调节植物的生长发育[12];PAZ,RNase III和dsRBD结构域在双链RNA结合和切割中起作用。研究认为DCL蛋白的RNaseⅢ和PAZ结构域之间的距离,是miRNA长度的主要决定因素[13]。通过分析得到的SlD⁃CLs的蛋白结构域,可以明确SlDCLs家族的主要功能,对后续的研究可以提供理论支持。

图2 番茄DCL家族成员蛋白结构域Figure 2 Tomato DCL family member protein domain
2.4 系统发育进化树分析
构建番茄、烟草、马铃薯、水稻、葡萄、玉米和拟南芥DCLs系统发育进化树(图3),番茄与同为茄科的马铃薯、烟草的同源性最高,与同为园艺作物的葡萄同源性较高,其次是拟南芥,番茄DCLs与玉米、水稻的DCLs同源性自展值较低,说明番茄与玉米、水稻之间进化关系较低。
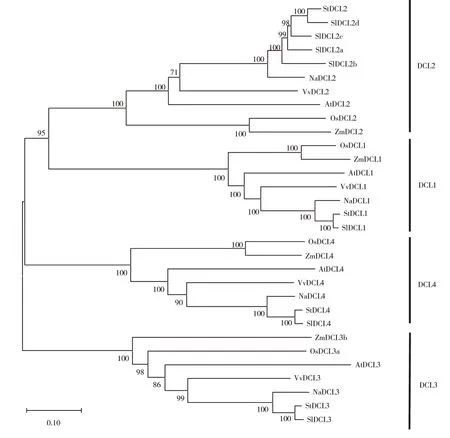
图3 DCLs基因家族成员氨基酸系统进化分析Figure 3 Phylogenetic analysis of amino acids of DCLs gene family members
2.5 启动子顺式作用元件分析
从番茄基因组网站得到SlDCLs各基因启动子上游2200bp左右的启动子序列,通过PLANTCARE在线预测启动子序列的顺式作用元件。并利用作图软件进行顺式作用元件可视化,可在图4中清楚的看到各响应元件所在启动子区域位置。可以发现多个激素响应元件和非生物胁迫响应元件。SlDCLs的启动子中含有光响应元件(sp1、G-box、TCT-motif)最多,这些元件说明SlDCLs基因对光敏感。此外还含有ABA(ABRE)、Me-JA(CGTCA-motif)、GA(GARE-motif)、IAA(TGA-element)和SA(TCA-element)的激素应激响应元件,这些元件的存在说明这些基因处在激素调控的下游,可能在特定的信号通路中发挥作用。低温(LTR)、干旱(MBS)和防御应激(TC-rich repeats)的作用元件也存在于SlDCLs家族基因的启动子区域,这些元件的存在说明这些基因在植物应对低温、干旱和其他环境胁迫过程中起作用,所有成员均含有多个启动增强(CAAT-box)和核心启动子(TATA-box)元件,说明该家族基因具有较强的表达潜力。
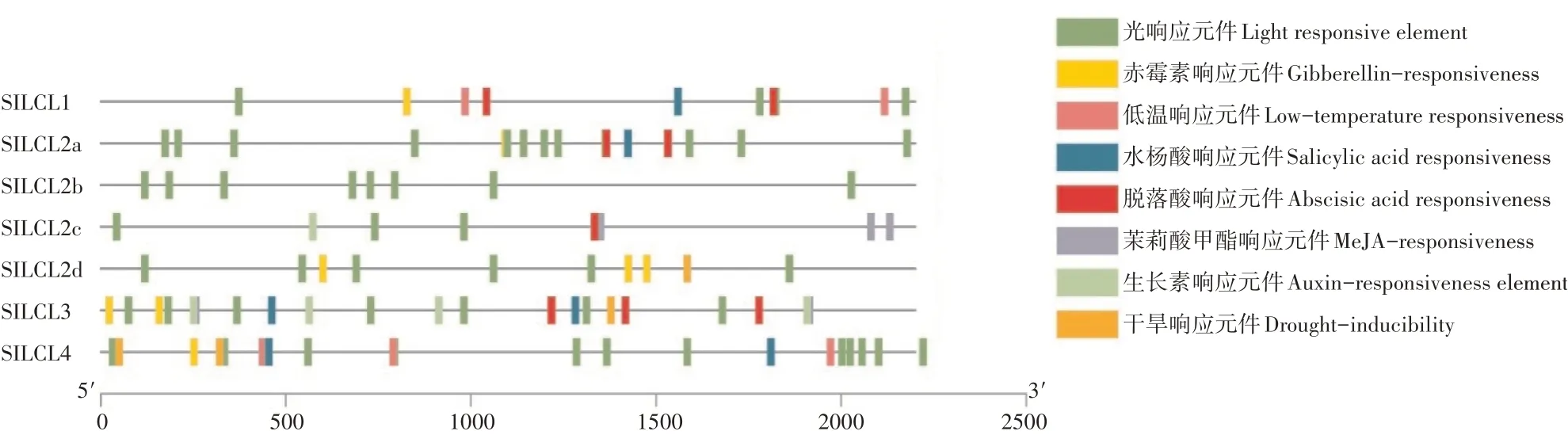
图4 SlDCLs启动子顺式作用元件可视化Figure 4 Visualization of cis-acting elements of the SlDCLs promoter
2.6 SlDCLs时空表达规律
由图5可知,SlDCLs家族在番茄各组织以及各发育阶段的果实都有表达。其中,SlDCL1在各组织以及各发育阶段的果实都有表达,SlDCL1在根茎叶中的表达量较低,花部位也有较低的转录水平,在转色期与成熟期的果实中有很高的表达量;SlDCL2a在9个组织与果实的4个发育时期中都有表达,SlDCL2a在花柄中的表达量最高,在绿熟期与转色期的果实中也有较高的表达;SlDCL2b在各组织中的表达量都较低,果实中SlDCL2b的含量最高;SlDCL2c在各组织以及各发育阶段的果实中都有表达,其中在茎,整个花器官,绿熟期以及坚熟期的表达量最高;SlDCL2d在各组织以及果实中的表达量都较低,根中的SlDCL2d的表达量最高,其余位置的SlDCL2d的表达量较低;SlDCL3在各组织以及发育阶段的果实都有表达,其中在花的各个组织中的表达量较高,在果实中低表达或者不表达;SlDCL4在各组织与发育阶段的果实中都有表达,除在花托、花瓣中的表达量较高外,其余部位的表达量较低。
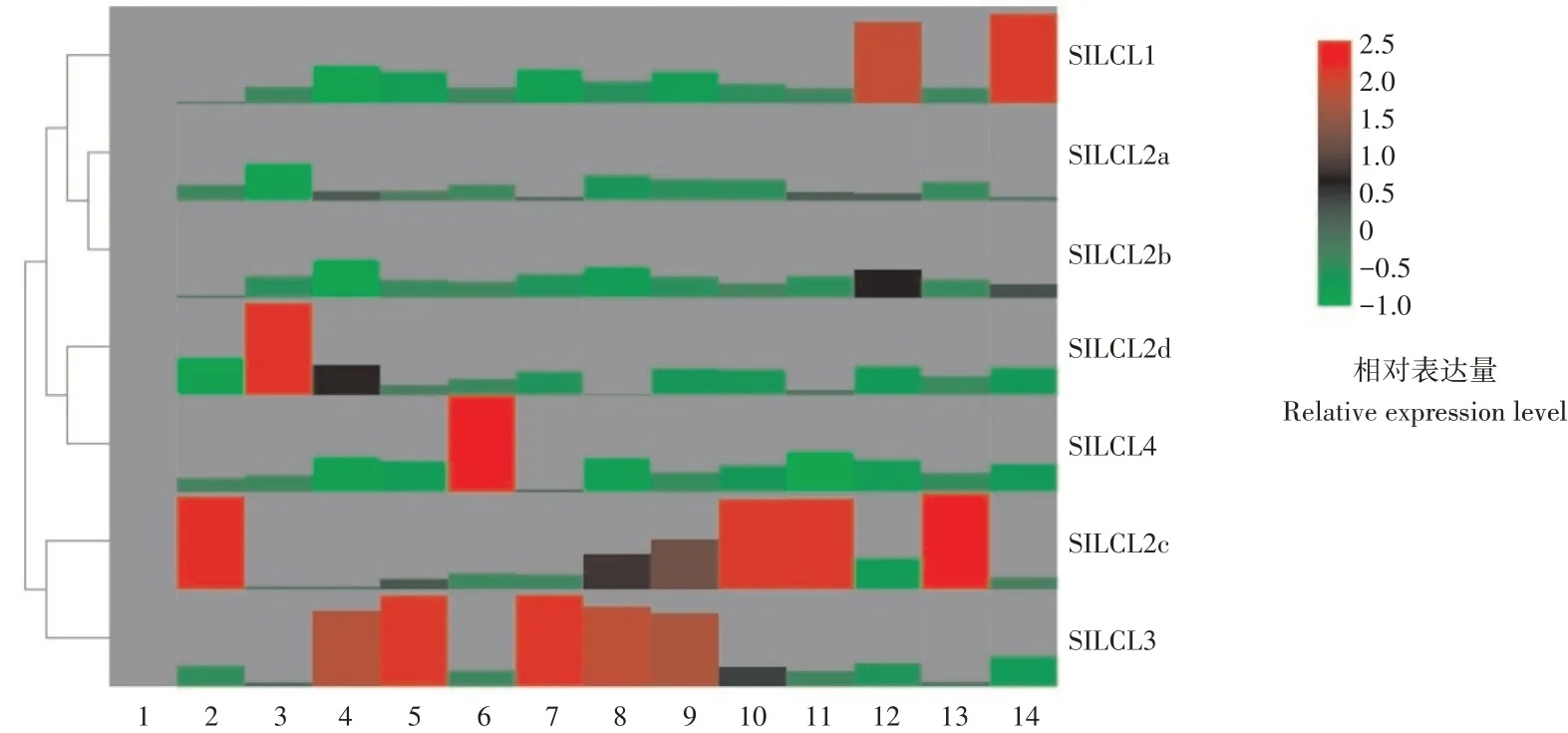
1.叶;2.茎;3.根;4.花柄;5.花萼;6.花瓣;7.花托;8.雄蕊;9.雌蕊;10.总花;11.绿熟期果实;12.转色期果实;13.坚熟期果实;14.完熟期果实The quantitative data were calculated using 2-ΔΔt,and the different colors in the graphs indicate the level of expression.1.Leaf;2.Stem;3.Root;4.Stalk;5.Calyx;6.Petal;7.Receptacle;8.Stamen;9.Pistil;10.Total flower;11.Green ripening fruit;12.Turning color fruit;13.Firm ripening fruit;14.Complete ripening fruit
2.7 不同逆境和激素下SlDCLs的表达分析
由图6可知,SlDCL1对低夜温响应明显,0.5h就发生变化,并在48h内持续高表达;SlDCL2a与SlDCL2d受低夜温负调控,表达量显著降低;SlDCL2b与SlDCL2c在低夜温处理下表达量明显增加,对低夜温响应明显且受低夜温的正调控;SlDCL3未发生明显表达量的变化,SlDCL4的表达量在4~48h持续受低夜温的负调控。
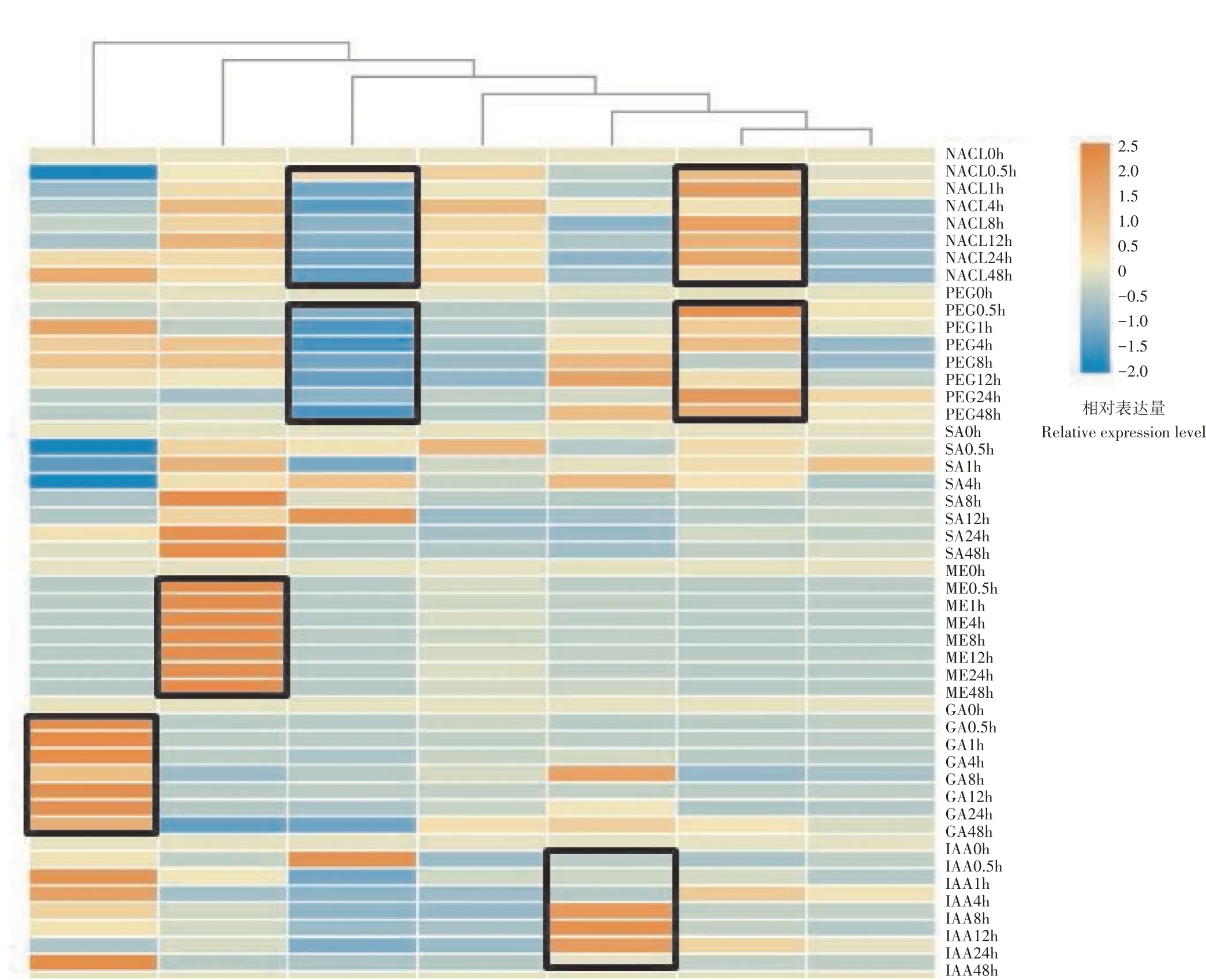
图6 SlDCLs在激素、低夜温、PEG和NACl胁迫下的表达分析Figure 6 Expression analysis of SlDCLs under hormone,low night temperature,PEG and NaCl stress
NACl处理番茄幼苗后,SlDCL1表达量0.5h开始增加,并在4h达到最高值,SlDCL2a在24h内表达量持续增加,显著高于0h时的表达量;SlDCL2b表达量在0~48h呈现先增加后降低的趋势,0.5~12h表达量持续降低,SlDCL2c、SlDCL2d和SlDCL4受NACl的负调控,表达量显著低于0h的表达量。
在PEG处理番茄幼苗后,SlDCL1和SlDCL2d在0.5h表达量就开始降低,说明PEG可能抑制SlDCL1与SlDCL2d的转录水平,PEG促进SlDCL2a和SlDCL4的表达,其余SlDCLs变化不显著。
ABA处理番茄幼苗后,SlDCL1在0.5h做出应答,表达量升高后又迅速降低,SlDCL2d受ABA的负调控,0.5~48h内的表达量都低于0h的表达量。SlDCL4可能间接响应ABA,4h才发生表达量的变化,且一直处于低表达,SlDCL4间接被ABA抑制。其余SlDCLs变化无明显规律。
IAA处理番茄幼苗后,发现SlDCL1受IAA的负调控,在0.5~48h都呈现低表达,IAA可以促进SlDCL2b和SlDCL4的表达,SlDCL2a直接响应IAA在0.5h表达量就增加,SlDCL4间接响应IAA在8h才增加;其余SlDCLs变化不明显。
GA处理后,SlDCL2b的表达被GA促进,0.5~24h都处于高表达,在24~48h表达量才开始降低;SlDCL2d和SlDCL3被GA抑制表达,在0.5~48h内的表达量持续降低,并在48h达到最低值;其余SlDCLs对GA的响应不明显。
Me-JA处理后,除SlDCL1与SlDCL3的表达量增加外,其余SlDCLs都呈现出表达量降低,SlDCL3的表达量增加明显,SlDCL3被Me-JA促进且直接响应Me-JA;SlDCL2s表达量变化类似,0.5~48h持续降低,Me-JA抑制SlDCL2s表达。
SA处理后,SlDCL1表达量先升高后降低,0.5h的表达量到达最高值,随后表达量逐渐降低;SlDCL2s表达量变化不明显,总体都呈先增加后降低的趋势;SlDCL3对SA的响应最明显,0.5~48h内持续增加,并在48h达到最高值;SlDCL4表达量先增加后降低,在4h达到最高值后,8~48h表达量持续降低。
3 讨论与结论
在水稻、拟南芥等模式植物中都有对DCLs基因家族的鉴定及分析,拟南芥有4个DCL成员,水稻有8个DCLs成员等。在本研究中,发现番茄有7个DCL成员:SlDCL1、SlDCL2a、SlDCL2b、SlDCL2c、SlDCL2d、SlDCL3和SlDCL4。蛋白质基本理化性质分析发现7个SlDCLs都为亲水的大分子蛋白,亚细胞定位预测在细胞核中,与拟南芥中的研究结果一致[8-11],说明番茄的DCL可能与拟南芥、水稻的DCLs具有相同功能。分子进化树构建分析发现SlDCLs分为4类,SlDCL1、SlDCL2s、SlDCL3和SlDCL4,其中番茄的DCL家族与水稻DCL家族关系更近。蛋白结构域预测发现番茄DCLs基因家族主要有5个结构域,包括DEAD box、RNA解旋酶结构域(Heli⁃case-C)、PAZ、RNaseⅢ和dsRBD,各个结构域在其他植物中的作用已有报道[12-14]
对SlDCLs基因家族进行表达规律分析,发现SlDCLs在番茄中存在特异表达,SlDCL2a、SlDCL2d和SlDCL3在花托中的表达量最高,SlDCL2c在坚熟期果实中表达量最高,SlDCL1在果实成熟阶段的表达量较高。柑橘果实中CsDCL1与CsDCL3的表达量较高,种子中CsDCL4有较高的表达量[15]。辣椒中的DCLs表达模式与番茄相似,CaDCLs在花中都有较高的表达量,CaDCL1在果实中有较高的表达量,CaDCL2在除根以外的组织中都高度表达,CaDCL3与CaDCL4在果中表达量较高[16]。
启动子是植物中重要的调控元件,在植物基因表达及生长发育中起重要作用,高等植物的启动子除含有起始转录的TATA-box核心区外,还含有起关键作用的顺式作用元件。本研究分析了番茄的启动子顺式作用元件,用预测出的可能响应的环境进行处理。本研究表明,SlDCL1直接响应低夜温,48h内高度表达;SlDCL2a对渗透胁迫响应明显,无论是盐胁迫或是干旱胁迫,都有显著的表达量变化;SlDCL2b的转录水平受到NACl的负调控,在0.5~12h表达量持续降低,后又逐渐恢复正常水平;SlDCL2c受到低温以及ABA的正调控;SlDCL2d受NACl与PEG的负调控;PEG可以促进SlDCL3和SlDCL4的表达。辣椒中DCLs对各类逆境也有不同响应,冷胁迫与PEG促进了CaDCL1的表达,而CaDCL3对PEG的响应明显,表达量显著增加[16]。黄瓜受渗透胁迫后,除CsDCL2外,所有的CsDCLs在花与茎中高度表达,相反,所有CsDCLs在根、叶和卷须中的表达水平都较低[17],而番茄叶片中的SlDCL4在渗透胁迫下表达量增加,SlDCL2d被干旱胁迫抑制,盐胁迫下SlDCL2a的表达量上升,发现番茄DCLs在干旱胁迫下的表达模式与黄瓜DCLs有所不同。
喷施激素会引起内源激素以及基因表达量的变化[18]。对番茄幼苗喷施激素后发现:SlDCLs家族对生长素响应明显,外源喷施生长素后除SlDCL1和SlDCL2d表达量显著增加;GA处理后,SlDCL2b显著增加;SlDCL2c在IAA的影响下高度表达;ABA处理对SlDCL2d表达量的促进最为明显;Me-JA促进SlDCL3的转录;IAA和GA可以促进SlDCL4的表达。辣椒中,激素处理下的CaDCLs也发生不同变化:ABA和SA促进了所有CaDCLs的表达,而MeJA抑制CaDCL3的转录水平,促进其余CaDCLs的表达[16]。番茄SlDCL3也对Me-JA敏感,说明DCL3响应Me-JA且对其敏感。
研究发现拟南芥和水稻中DCLs族参与RNAi过程从而增加植株对逆境的抵抗能力[19],推测番茄DCL家族也在番茄抵抗逆境中通过RNAi途径起作用。拟南芥DCL家族中DCL3参与了RNA指导的DNA甲基化(Rd⁃DM),通过转录基因沉默响应生物和非生物应激,生长和发育信号,在表观遗传调控中发挥重要作用[8,20]。其中有DCLs中的DCL3与DCL4参与。拟南芥水稻等都发现在逆境胁迫下SlDCLs及其下游AGOs、RDRs家族基因发生变化,协同参与RNAi过程来抵抗逆境胁迫。拟南芥除AtDCL3外,其余基因都对盐胁迫、干旱、冷胁迫的响应明显,且下游AGOs、RDRs家族基因也有不同程度的变化,而水稻OsDCL2与OsDCL3a对各逆境的响应明显,说明这些基因参与到RNAi过程[18]。
综上可知,番茄DCL家族能参与响应外源激素、低夜温与渗透胁迫等,可为番茄中SlDCLs的抗逆性研究提供参考,但SlDCLs基因具体的调控机制和参与的途径需要进一步探究。
