东北地区玉米大斑病菌交配型组成及遗传多样性分析
2021-10-12马周杰何世道庞欣宇王禹博张照然唐爽爽高增贵
马周杰,何世道,庞欣宇,王禹博,张照然,唐爽爽,高增贵
(沈阳农业大学 植物保护学院,沈阳 110161)
玉米大斑病作为世界玉米生产的一种叶部病害,在玉米生育期的多数阶段均可造成为害,该病害在温度15~25℃以及降水过多的地区普遍流行[1]。20世纪初,玉米大斑病已在世界所有玉米产区发生并流行[2]。据报道,在法国、奥地利以及美国等地区,由玉米大斑病造成的田间产量损失达到30%,有些年份甚至近50%[3-4]。1899年,在我国东北地区首次报道了玉米大斑病的发生,20世纪30年代后期,该病害遍及我国玉米主产区,主要流行于东北、华北北部、西北和南方山区等冷凉玉米产区[5]。80年代初,随着抗病品种的广泛应用和推广,玉米大斑病曾一度得到有效控制,但后期由于生理小种的变异以及先玉335等感病品种的大面积种植,玉米生产再次遭受玉米大斑病的威胁,经济效益遭受严重影响,特别是在东北地区的春玉米种植区[6]。
玉米大斑病菌有性态为大斑刚毛座腔菌[Setosphaeria turcica(Luttr.)K.J.Leonard&Suggs],属子囊菌门刚毛座腔菌属真菌,其有性生殖受MAT基因控制[7]。作为异宗配合真菌,玉米大斑病菌交配型分为仅含StMAT1-1基因的A交配型、仅含StMAT1-2基因的a交配型和2种基因都包含的Aa交配型[8]。玉米大斑病菌交配型存在明显的分化现象,其A交配型和a交配型被指在热带地区分布均匀,而在温带地区表现出明显的不平衡现象[3],且同一国家的不同地区间交配型均存在显著差异[9]。在国内,孙淑琴[10](2005)指出我国玉米大斑病菌主要存在3种交配型(A、a和Aa),Aa交配型的两性菌株数量最大,而a交配型比例最小。王利智等[11](2011)对云南省玉米大斑病菌进行交配型检测,发现A交配型比例明显大于a交配型。杨贝贝[12](2020)报道a交配型已在组成上占据绝对优势。可见,不同年份、不同地理区域间,玉米大斑病菌交配型组成及比例不同,自然条件下玉米大斑病菌遗传变异加剧。
近几年,SRAP分子标记技术被越来越多的应用于分析植物病原真菌遗传多样性[20-21]。但在国内外尚未有关SRAP技术检测玉米大斑病菌遗传多样性的报道。本试验利用SRAP技术对东北地区玉米大斑病菌遗传多样性进行分析,并确定所有分离菌株的交配类型,进一步讨论遗传多样性、交配类型以及地理来源之间的关系,明确东北地区玉米大斑病菌遗传动态,为玉米大斑病的科学合理防治提供理论依据。
1 材料与方法
1.1 材料
2017年9月在东北地区的黑龙江、吉林、辽宁、内蒙古4个省(自治区)34个市县采集玉米大斑病病叶标样,用标本纸压制后带回实验室进行病原菌分离。
供试水琼脂培养基为琼脂18g,蒸馏水1000mL;PDA培养基为马铃薯200g,葡萄糖20g,琼脂18g,蒸馏水1000mL;PD培养液为马铃薯200g,葡萄糖20g,蒸馏水1000mL。
供试2×Power Taq PCR Master Mix、DL2000 DNA Marker和植物基因组DNA提取试剂盒均购自北京天根生化科技有限公司;TAE和4S Green Plus Nucleic Acid Stain均购自上海生工生物工程股份有限公司;PCR引物均由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 病原菌分离培养采用单孢分离法[22]从病叶标样上分离病原菌,首先通过敲打叶子将孢子转移到水琼脂培养基上,然后使用挑孢针在普通光学显微镜4倍物镜下直接挑取单个孢子转移至PDA培养基上培养,将平板置于25℃光暗交替(12h/12h)培养7d后,4℃保存,同时用PD培养液振荡培养,富集菌丝进行DNA提取。通过分离培养,共从病叶标样上获得57株病菌,其地理来源信息见表1,菌株编号由采集省份(自治区)汉语拼音首字母缩写加数字组成。
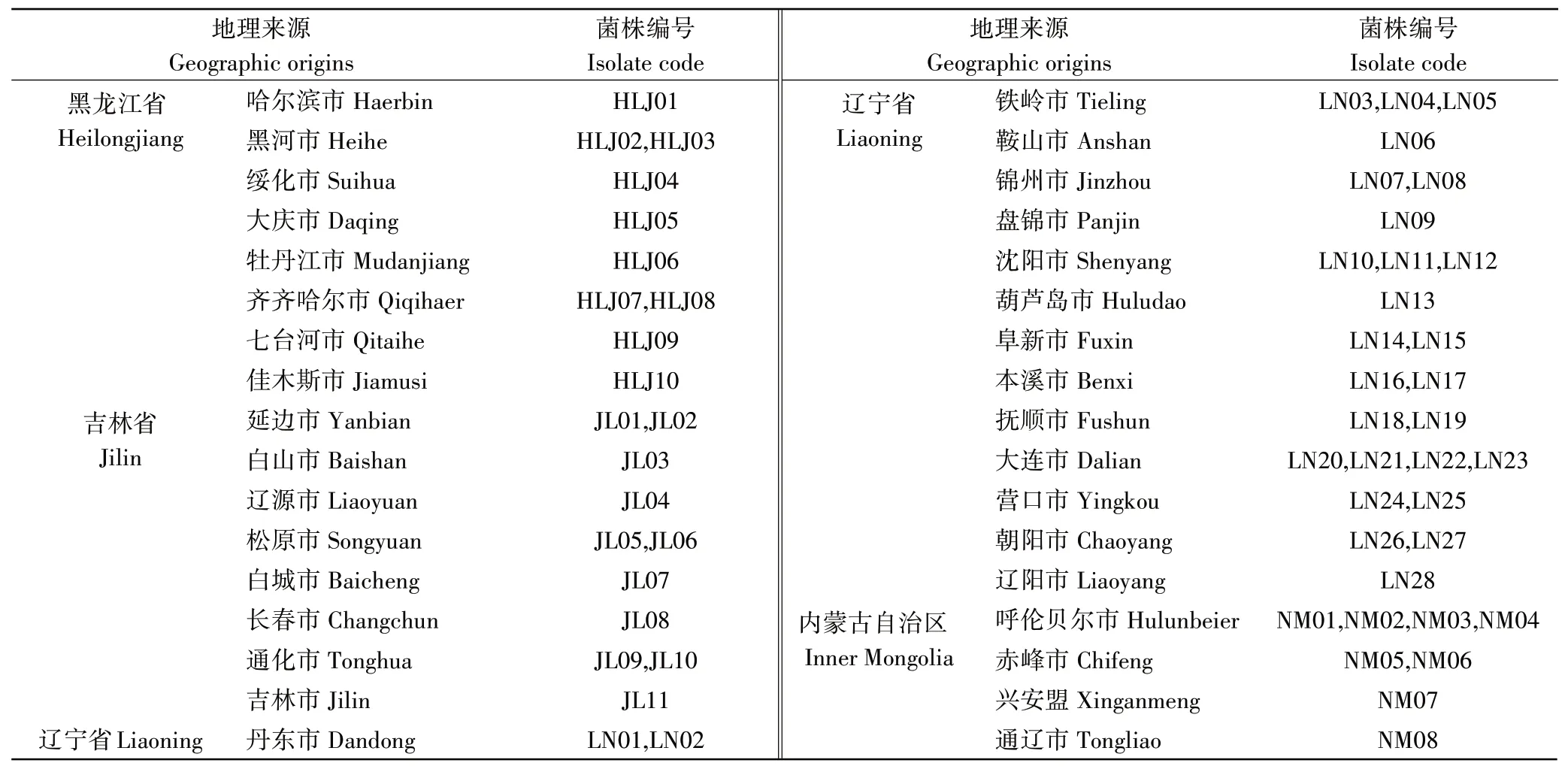
表1 供试菌株地理来源信息及编号Table 1 Information of geographic source and codes of tested isolates
1.2.2 DNA提取及检测挑取PD培养液振荡培养后的菌丝用无菌双层纱布过滤,用无菌蒸馏水洗涤3次后转移至离心管中,-20℃冰冻后,使用真空冷冻干燥机干燥24h,置于预冷的研钵中,加入液氮迅速研磨,利用植物基因组DNA提取试剂盒提取各菌株DNA,测定OD260/OD280,确定其浓度与纯度,-20℃保存备用。
1.2.3 病原菌鉴定将纯化后的单菌落接种至PDA培养基平板上,置于25℃恒温光照培养箱中培养7d,观察菌落特征,并置于普通光学显微镜下观察各菌株的微观结构。同时,以提取的DNA为模板,利用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)对ITS区序列进行扩增。PCR反应体系(25μL):2×Power Taq PCR Master Mix,12.5μL;DNA模板,1μL;引物ITS1,1μL;引物ITS4,1μL;ddH2O补足至25μL。PCR反应程序:94℃预变性5min;94℃变性40s,54℃退火1min,72℃延伸1min,35个循环;72℃最终延伸10min;4℃保存产物。PCR扩增产物经1.0%(w/v)琼脂糖凝胶电泳检测拍照后,交于上海生工生物工程股份有限公司测序。将ITS测序结果与GeneBank中的Setosphearia turcica菌株序列(NCBI accession No.KJ380909.1)进行比对。
1.2.4 交配类型分子鉴定以提取的DNA为模板,参照张泗举[23]提出的玉米大斑病菌交配型测定引物进行PCR鉴定。交配型基因StMAT1-1片段(A交配型)引物为MAT1-1-F(5’-ACAGGCTACTACATCACAATCC-3’)和MAT1-1-R(5’-ATAGTCGATCAATTCAGGCATG-3’),交配型基因StMAT1-2片段(a交配型)引物为MAT1-2-F(5’-CGTCCGATGAACTGCTGGATC-3’)和MAT1-2-R(5’-ACGCAGGTGTTCTTCTTTCGC-3’)。PCR反应体系(25μL):2×Power Taq PCR Master Mix,12.5μL;DNA模板,1μL;上游引物,1μL;下游引物,1μL;ddH2O补足至25μL。A交配型PCR反应程序:95℃预变性5min;94℃变性1min,55℃退火40s,72℃延伸90s,35个循环;72℃最终延伸10min;4℃保存产物。a交配型PCR反应程序:95℃预变性5min;94℃变性1min,53℃退火45s,72℃延伸30s,35个循环;72℃最终延伸10min;4℃保存产物。PCR扩增产物经1.2%(w/v)琼脂糖凝胶电泳检测,根据扩增条带有无及大小确定交配型。
1.2.5 SRAP分析根据表2提供的10条正向随机引物和10条反向随机引物共产生了100对引物组合。随机选择5个菌株DNA用于引物筛选,选择条带清晰、丰富且稳定的引物组合进行SRAP分析。PCR反应体系(25μL):2×Power Taq PCR Master Mix,12.5μL;DNA模板,1μL;上游引物,1μL;下游引物,1μL;ddH2O补足至25μL。PCR反应程序:94℃预变性5min;94℃变性1min,30~40℃退火1min(各引物组合最适温度不同),72℃延伸1min,5个循环;94℃变性1min,50~56℃退火1min(各引物组合最适温度不同),72℃延伸1min,35个循环;72℃最终延伸10min;4℃保存产物。PCR扩增产物经2.0%(w/v)琼脂糖凝胶电泳检测并拍照,对电泳图谱条带进行统计,在相同迁移率下,同一位置出现条带记为“1”,没有观察到条带记为“0”,以所得数据构建二元数据矩阵,利用NTSYS pc 2.1软件分析遗传多样性,聚类分析通过算术平均法(UPGMA)进行。
由表2可知,不同配方制作的油茶汤色不同。加入花生及鱼粉的油茶汤色为乳状绿色,加入冰鲜乌龙茶的油茶汤色偏黄、稍暗,加入罗汉果和石崖茶油茶的茶汤色颜色较相同,对比原料嫩度相同无辅料添加的配方,汤色较浅。各配方制作的油茶汤色排名为配方2>(配方3,配方4,配方5) >配方1>配方 6>配方 7>配方 8>配方 9>CK。

表2 SRAP引物序列Table 2 Sequences of SRAP primers
2 结果与分析
2.1 病原菌的鉴定
利用普通光学显微镜观察,所有供试菌株的菌落正圆形,呈黑褐色(图1A);菌丝为灰黑色,分生孢子梗单生或簇生,呈直立状或弯曲状,褐色,具2~6个横隔膜,(30.2~180.6)×(2.7~5.2)μm(图1B);分生孢子顶侧生,淡黄褐色,呈长梭形或纺锤形,中下部较宽,存在明显脐点,具2~8个横隔膜,(58.7~106.8)×(11.2~23.6)μm(图1C)。同时,所有分离菌株均用ITS1/ITS4引物扩增出约600bp的条带,PCR扩增产物序列结果与GeneBank中的Setosphearia turcica菌株序列(NCBI accession No.KJ380909.1)进行比对,同源性性均高达100%。因此,所有分离株均被鉴定为凸脐蠕孢菌,为玉米大斑病病原菌。
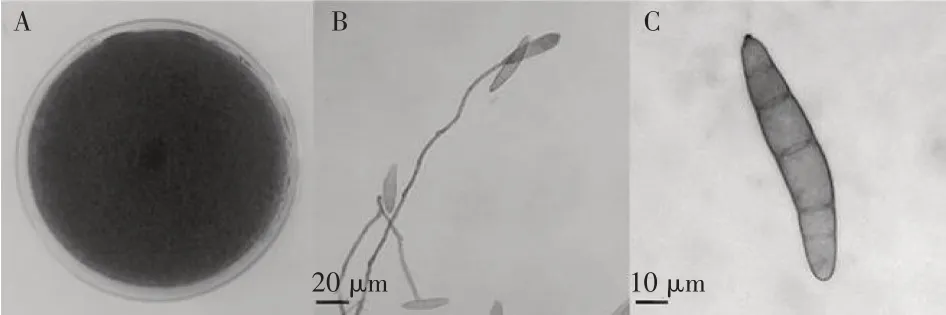
图1 供试菌株形态学特征Figure 1 Morphology of tested isolates
2.2 玉米大斑病菌交配型组成分析
利用鉴定交配型的2对特异性引物对57株供试菌株DNA进行PCR扩增,电泳结果显示(图2),只扩增出800bp左右目的条带的菌株为A交配型菌株,只能扩增出250bp左右目的条带的菌株为a交配型菌株,同时可以扩增出2个目的条带的菌株为Aa交配型菌株,无条带扩增结果的菌株为中性菌株。
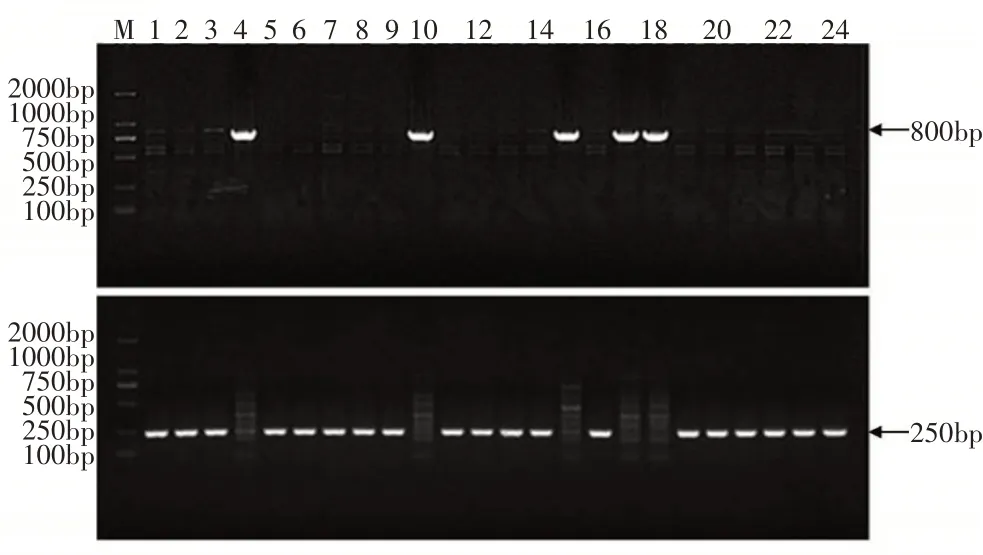
图2 部分供试菌株交配型基因MAT1-1和MAT1-2电泳图谱Figure 2 The electrophoresis results of mating type genes MAT1-1 and MAT1-2 of some tested isolates
在供试的57个菌株中,A交配型的(仅包含MAT1-1)共有12株,占菌株总数的21.05%,而a交配型的(仅包含MAT1-2)共有45株,占菌株总数的78.95%,并未检测到Aa交配型菌株和中性菌株(表3)。从东北地区各省(自治区)交配型的分布情况来看,a交配型菌株数量均明显大于A交配型,表明a交配型为东北地区玉米大斑病菌优势交配型,玉米大斑病菌交配型种类在地理分布上存在随机性。
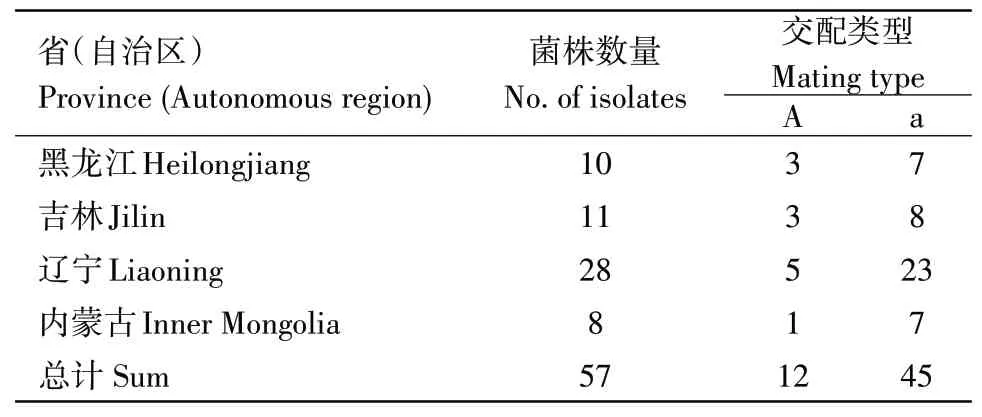
表3 东北地区玉米大斑病菌交配型鉴定Table 3 Mating type determination of Setosphaeria turcica in Northeast China
2.3 玉米大斑病菌遗传多样性分析
2.3.1 SRAP-PCR扩增结果对100对引物组合进行初筛,最终有8对引物能够扩增出清晰、多态性丰富、分布均匀且稳定性较好的条带。利用这8对SRAP引物进行2轮退火温度的筛选,根据PCR扩增产物电泳图谱各条带的明亮整齐程度确定每一对引物的退火温度组合(表4)。8对引物组合共扩增出64条带,其中引物组合Me5/Em9和Me8/Em1可扩增出数量最多的10条带,而Me3/Em3仅可扩增出数量最少的5条带,在64条带中有44条带为多态性条带,不同引物组合可扩增出3~7条多态性条带,多态性比率为60.00%~77.78%,平均每个引物组合扩增出5.5个多态性条带,多态性比率达到68.75%,表明玉米大斑病菌存在遗传分化现象,菌株间表现出丰富的遗传多样性。
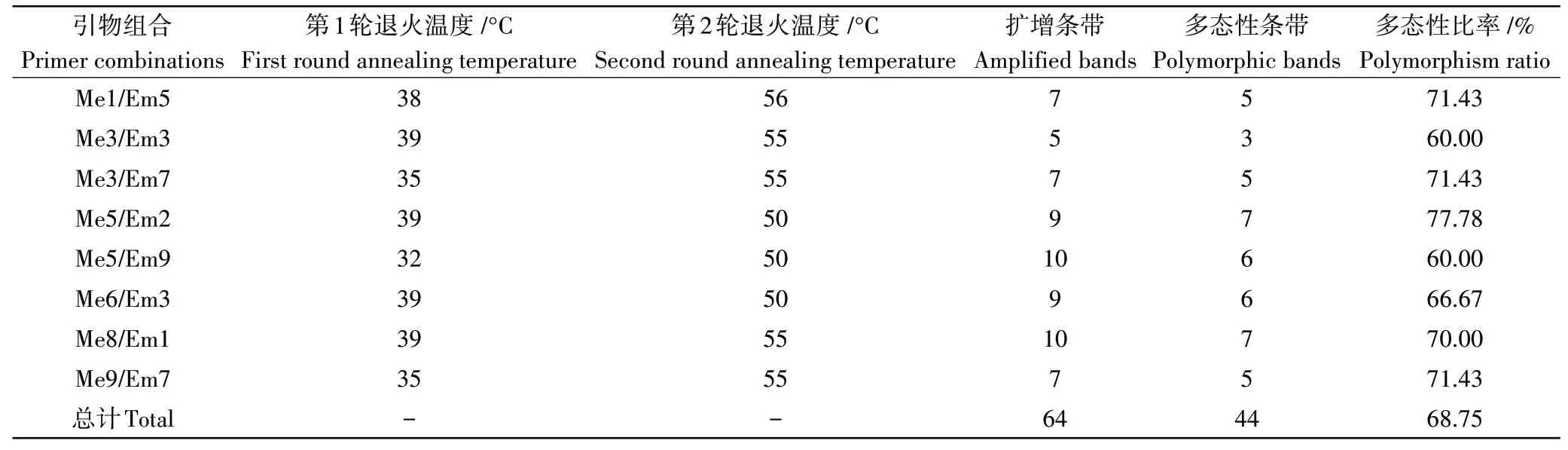
表4 SRAP引物组合筛选及扩增结果Table 4 SRAP primer combination screening and amplification results
2.3.2 玉米大斑病菌聚类分析结果聚类分析系结果表明(图3),从东北地区分离的57株玉米大斑病菌遗传相似系数介于0.76~1.00。当阈值为0.76时,供试菌株被分为2个类群(SRAP groups,SGs),其中SGI仅包含9个菌株,占菌株总数的15.79%;其余的48个菌株均被聚类到SGII,占菌株总数的84.21%;当阈值为0.78时,SGII又可分为2个亚类群(SRAP subgroups,SSGs),其中SSGII包含3个菌株(HLJ01、JL01和JL02),其余的45个菌株均被聚类到SSGI;当阈值为0.82时,供试的所有菌株又可被分为4个SGs。由此说明东北地区玉米大斑病菌存在遗传分化现象。进一步分析后发现,来自同一地区的供试菌株被划分到不同的类群或亚类群中,例如,尽管NM06和NM05都是从内蒙古自治区赤峰市的标样中分离出来的,但它们分别分配到SGI和SGII中。同时,来自不同省市的部分供试菌株被划分为同一类群,例如,SGI中菌株地理来源就包括黑龙江省的黑河市(HLJ03)和绥化市(HLJ04),吉林省的白城市(JL07)和吉林市(JL11),辽宁省的丹东市(LN02)、阜新市(LN15)和大连市(LN20和LN23)以及内蒙古自治区赤峰市(NM06)4省8市县。综上,玉米大斑病菌SRAP类群的划分与菌株的地理来源没有明显的相关性。另外,由聚类分析树状图中各菌株交配型分布可以看出,SGI中所有菌株均为A交配型,a交配型菌株均聚集于SGII,由此可见,玉米大斑病菌菌株遗传类群和交配型在分子水平上存在密切关系。
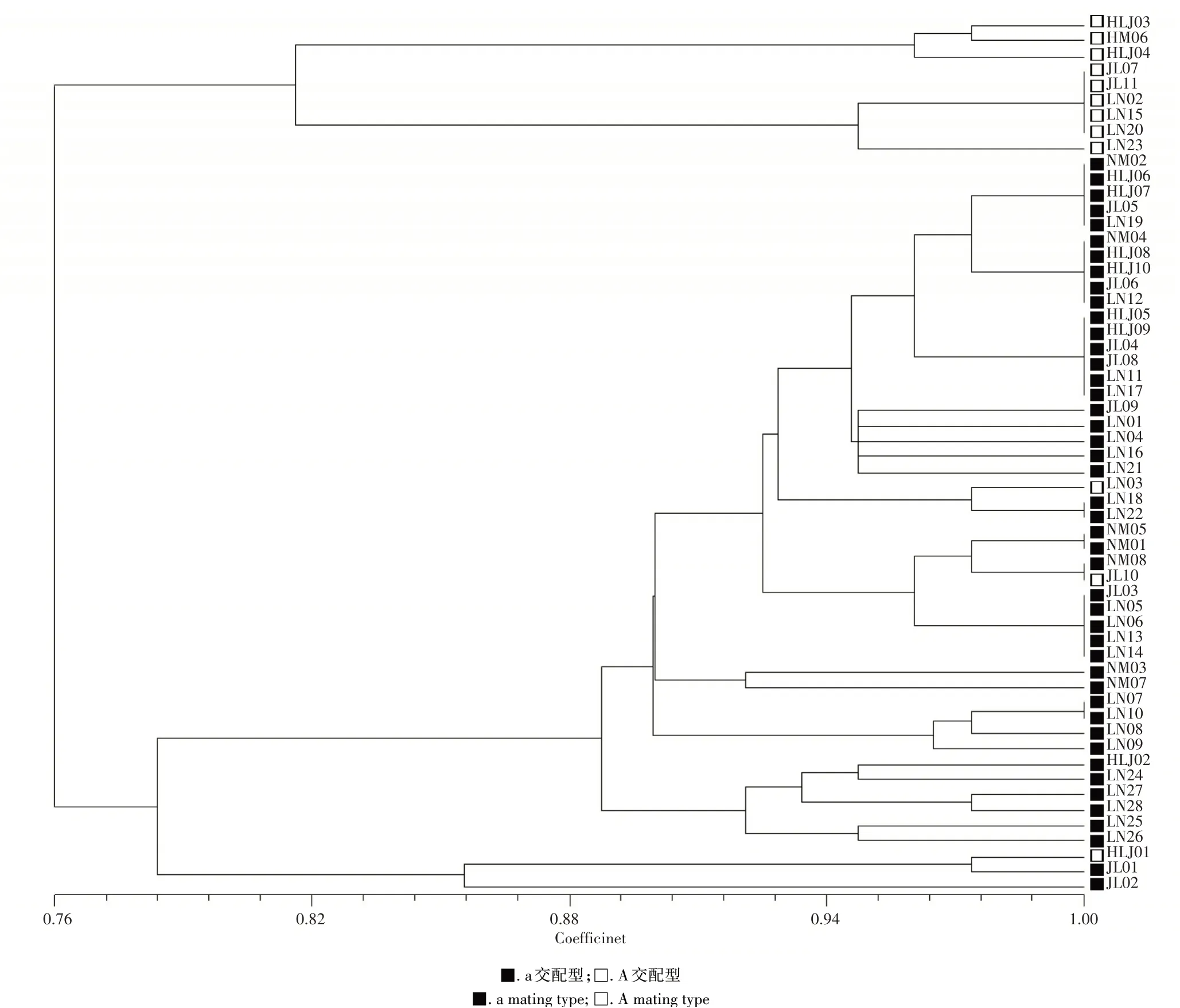
图3 东北地区玉米大斑病菌菌株SRAP聚类分析图谱Figure 3 Cluster analysis of isolates of Setosphearia turcica in Northeast China based on SRAP
3 讨论与结论
玉米大斑病在东北各玉米产区均有发生,其是玉米生产上不可忽视的重要病害。我国玉米大斑病菌存在不同的交配类型(A交配型和a交配型),并具有有性生殖的潜力,这可能导致玉米大斑病菌的遗传变异。对异宗配合的真菌来说,有性生殖受交配基因MAT的控制,交配类型A和a分别由MAT1-1和MAT1-2基因编码[7]。BUNKOED等[24]报道泰国玉米大斑病菌A交配型与a交配型比例接近1∶1,在国内,孙淑琴等[10]报道我国玉米大斑病菌中Aa交配型的两性菌株数量最大,王利智等[11]发现云南省玉米大斑病菌A交配型比例明显大于a交配型。同时,NELSON[25]报道了玉米大斑病菌存在双性菌株和中性菌株,玉米大斑病菌的交配类型不是简单的双极性。而在本研究中,只检测出了a和A两种交配类型,且a交配型比A交配型更为普遍,说明不同地区玉米大斑病菌交配型组成情况存在较大差异,遗传背景趋于多态化和复杂化。
分子标记技术已被广泛用于研究真菌中的遗传多样性,本研究通过计算SRAP程序中引物的2轮退火温度,扩增清晰,稳定和重复性较好的DNA条带,并从不同的分离菌株中获得具有较高多态性的DNA片段。这些结果表明SRAP技术是研究玉米大斑病菌遗传变异和亲缘关系的有效方法。同时,本研究首次利用SRAP技术分析东北地区玉米大斑病菌遗传多样性。结果表明,57个供试菌株之间存在遗传差异,8个引物组合共扩增出64条条带,其中多态性条带为44个,平均每个引物组合扩增出5.5个多态性条带,多态性比例为68.75%,略低于之前的报道[26]。同时,本研究SRAP标记用简单的琼脂糖凝胶分析代替了更敏感的聚丙烯酰胺凝胶银染或荧光标记来检测菌株扩增DNA片段的条带;这也可能是多态性比率较低的原因。FERGUSON等[9,14]分别通过RAPD和AFLP等方法证实玉米大斑病菌存在丰富的遗传多态性。在欧洲,玉米大斑病菌遗传结构被报道与地理分布存在密切关系[27],本研究却发现遗传多样性与地理起源没有显著的相关性,这与MA等[28]和谷守芹等[17]关于不同地区玉米大斑病菌研究结论一致。本研究另发现,玉米大斑病菌遗传多样性与交配型之间存在密切关系,其可能是因为交配型受MAT基因调控,其在分子水平与遗传信息存在某种必然联系。本研究只使用有限数量的引物,而且某些地区的菌株数量还不够,有必要扩大引物组合和菌株数量,以期通过SRAP分析更好地了解玉米大斑病菌遗传多样性与交配型之间的关系。此外,应进一步分析菌株的致病性和生理小种类型,以帮助更好地解释所获得SRAP分子标记的遗传信息。
在生产上,由于东北地区大量感大斑病玉米品种的种植以及适宜的气候条件,玉米大斑病的发生日趋严重,因此应加强对东北地区玉米大斑病菌遗传结构及其与交配型间密切关系的研究,明确其优势种群及遗传动态,为玉米大斑病的科学合理防治提供理论依据。
