microRNA-515-5p调控c-MYC-p53信号轴对神经母细胞瘤细胞增殖、侵袭和迁移的影响
2021-10-12季士亮洪蕾郭东凯江翊国徐飞黄立峰
季士亮,洪蕾,郭东凯,江翊国,徐飞,黄立峰
(南京医科大学附属苏州科技城医院,江苏苏州 215153)
神经母细胞瘤(neuroblastoma,NB)是起源于神经外胚层原始神经嵴细胞的颅外恶性实体肿瘤,年发病率0.3/100 000~5.5/100 000,占儿童恶性肿瘤的8%~10%,已成为儿童主要死亡病因之一[1]。近年来,临床对NB的治疗手段不断完善和改进,但疗效并无显著提升,约15%患者对诱导治疗无反应,约50%患者临床症状缓解后复发,平均5年生存率30%~60%,病死率约为儿童时期肿瘤死亡病例的15%[2]。目前NB发病机制尚不明确,一般被认为是一系列遗传性改变累积导致,包括癌基因、抑癌基因和DNA修复基因的改变[3]。癌基因(MYC)的过度表达被认为是NB发生发展的一个重要原因[4]。MYC是NB大量基因及遗传通路失调的原因,MYC介导的致癌作用是通过调控与肿瘤相关的microRNA(miRNA)实现的。miRNA参与细胞分化、增殖、凋亡及器官发育等生理过程,并在肿瘤发生发展中发挥着重要作用,是肿瘤恶性行为的重要调控因子。近期有研究表明,microRNA(miR)-515-5p在乳腺癌和前列腺癌中的表达异常[5]。miR-515-5p家族在NB细胞中表达异常及作用机制尚不清楚。因此,本研究探讨了NB细胞中miR-515-5p对c-MYC-p53信号轴的调控作用及其对NB细胞系体外增殖和侵袭能力的影响。
1 材料和方法
1.1 材料
SK-N-BE(2)和SK-N-AS购自上海中科院细胞库;胎牛血清购自Gibco公司;miR-515-5p、mimics-NC购自Gene Pharma公司;脂质体Lipo 2000购自Thermo Fisher公司,c-MYC、p53、甘油醛-3-磷酸脱氢酶(GAPDH)抗体及辣根过氧化物酶抗体(HRP)标记二抗购自Santa 公司。
1.2 方法
1.2.1 细胞培养与转染 SK-N-BE(2)和SK-N-AS细胞培养于含有10%胎牛血清(FBS)的DMEM/FBS(Gibco)培养基,并放置于含有5% CO2的37 ℃孵箱中。采用胰蛋白酶将细胞消化后,将其浓度调整为1×105/mL,取1 mL接种至12孔板,37 ℃恒温培养24 h。当细胞密度接近50%时,采用Lipo 2000将接种的细胞分为miR-515-5p过表达组(miR-515-5p mimics组)和阴性对照组(NC mimics组),未进行转染组即空白对照组(Control组),转染步骤按说明书操作。转染48 h后进行相关检测。利用Gene Pharma miRNA提取试剂盒说明书的要求提取细胞中的miRNA。检测RNA浓度,并取500 ng RNA进行逆转录反应,以U6 RNA作为内源性对照。在SYBR Green 5×PCR Master Mix作用下进行实时定量PCR反应。
1.2.2 MTT检测 将转染的细胞以3 000个/孔接种到96孔板中,连续检测5 d。根据说明书,待测孔加入 10 μL CCK-8(Dojindo,Japan)分析细胞活性,37 ℃避光孵育2 h,于450 nm处检测吸光度,根据吸光度值绘制增殖曲线,每个细胞做6个复孔。
1.2.3 Transwell小室和划痕实验 将转染的细胞计数并接种到Transwell小室(孔径8 μm,1×105个细胞),在上室加入无血清培养基,下室采用含15% FBS的培养液覆盖。培养24 h后取出Transwell小室,以4%多聚甲醛固定15 min,PBS洗涤2次,风干。采用0.1%结晶紫(sigma)染色,在显微镜下随机选择4个视野观察发生侵袭的细胞,并计数每个视野下发生侵袭的细胞。同理,转染的细胞密集度达到90%左右时,利用500 mL的枪头垂直均匀划出交叉横线,每孔至少穿过5条线。采用PBS清洗细胞,加入无血清培养基继续培养。在显微镜下观察划痕后0、24、48、72 h划痕愈合情况,反映细胞的迁移能力。
1.2.4 平板克隆形成实验 将转染的细胞接种到6孔板(300个细胞/板),每3 d换液一次,7~10 d出现肉眼可见的克隆球时终止培养,4%多聚甲醛固定30 min,采用吉姆萨染色,以显微镜观察并计数。
1.2.5 细胞凋亡与周期实验 取转染后48 h的细胞,消化离心用预冷PBS洗2次,调整细胞终浓度为1×106/mL,先后加入5 μL Annexin V-FITC染液和10 μL碘化丙啶(PI)染液,室温孵育15 min,流式细胞仪检测细胞凋亡率。同理,收集转染后各组细胞,用预冷PBS洗2次,缓慢滴加3 mL 70%预冷的无水乙醇,4 ℃静置过夜。离心重悬后加入20 μL核糖核酸酶(RNase),37 ℃温箱孵育30 min;加入PI 20 μL至终浓度50 μg/mL,用锡箔纸包住,24 h内上机检测。
1.2.6 Western免疫印迹检测 细胞转染48 h后,利用RIPA裂解液裂解细胞提取细胞蛋白,进行聚丙烯酰胺凝胶(SDS-PAGE)电泳。采用含5%脱脂奶粉的TBS进行封闭。最后利用电化学发光(ECL)显影,并分析条带的强弱。

2 结果
2.1 miR-515-5p对NB细胞形态和细胞活性的影响
采用实时定量PCR检测miR-515-5p在SK-N-BE(2)和SK-N-AS细胞中的转染效率,见图1A。通过荧光显微镜观察到过表达miR-515-5p的细胞形态略有变化,细胞面积有所增加,见图1B。利用CCK8实验对细胞的活性进行检测,结果显示,与阴性对照组比较,转染miR-515-5p mimics的SK-N-BE(2)和SK-N-AS细胞活性均降低(P<0.05),见图1C。因此,miR-515-5p通过改变细胞形态抑制NB细胞的活性。
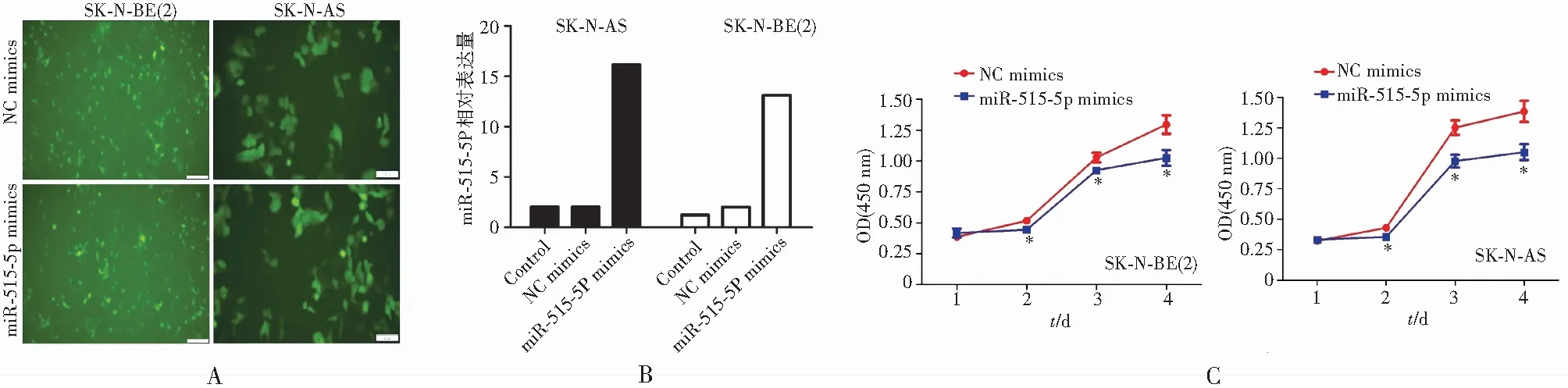
注:A.转染miR-515-5p 48 h后细胞形态变化;B.转染48 h后RT-PCR检测miR-515-5p表达水平;C.转染miR-515-5p 24、48、72和96 h后CCK8法观察细胞活性变化。*与NC mimics组比较,P<0.05
2.2 miR-515-5p对NB细胞增殖、侵袭和迁移能力的影响
与NC mimics组比较,miR-515-5p组细胞增殖、侵袭和迁移能力均降低(P<0.05),其中,过表达miR-515-5p后,miR-515-5p mimics组细胞集落平均形成率明显减少(0.33±0.02),与NC mimics组(0.42±0.05)比较,差异有统计学意义(P<0.05),见图2A。划痕实验显示,过表达miR-515-5p的细胞在72 h后划痕仍未愈合,而NC mimics组基本愈合(P<0.05),见图2B。此外,Transwell小室侵袭实验显示,过表达miR-515-5p降低了细胞侵袭能力(P<0.05),见图2C。
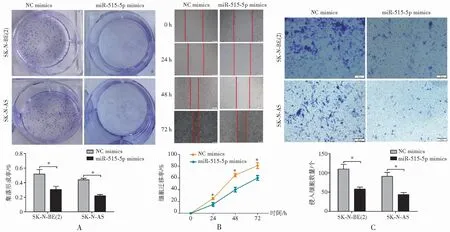
注:A.转染miR-515-5p后SK-N-BE(2)和SK-N-AS细胞克隆形成率;B.转染miR-515-5p后通过划痕实验测定0、24、48和72 h细胞迁移能力;C.转染48 h后通过Transwell小室检测细胞侵袭能力。*与NC mimics组比较,P<0.05
2.3 miR-515-5p对NB细胞凋亡与自细胞周期的影响
采用流式细胞仪检测细胞周期与凋亡率,与NC mimics组比较,转染miR-515-5p后细胞G1期比例明显增加,S期比例明显减少(P<0.05),见图3A。同时,转染miR-515-5p后细胞凋亡率增加(P<0.05),且与转染miR-515-5p的浓度呈正比,见图3B。因此,miR-515-5p可影响NB细胞的凋亡与自我更新能力。
2.4 miR-515-5p对c-MYC-p53信号通路的影响
采用Western Blot法检测miR-515-5p对MYC及抑癌基因p53表达水平的影响。与NC mimics组比较,转染miR-515-5p mimics的细胞中c-MYC水平降低,P-p53水平升高,而p53的表达水平没有明显变化,见图4。因此,miR-515-5p通过调控c-MYC-p53信号轴抑制细胞增殖、侵袭和迁移。
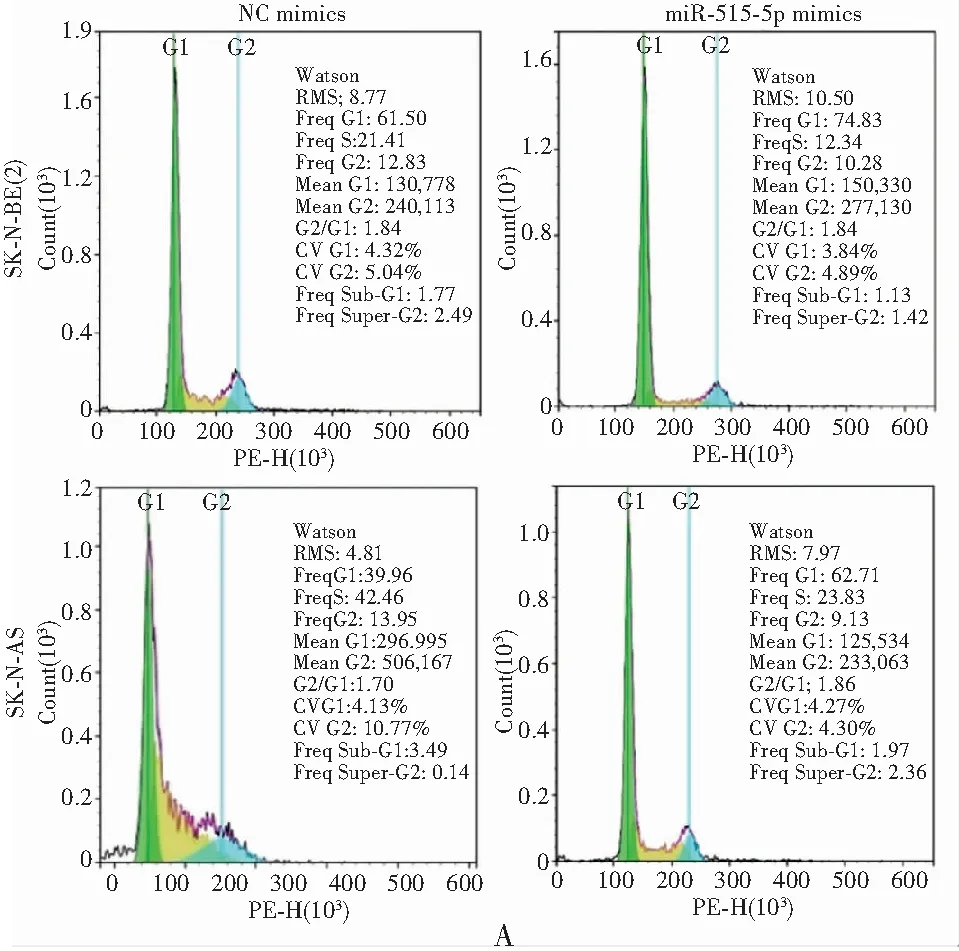

注:A.转染miR-515-5p后SK-N-BE(2)和SK-N-AS细胞G1期比例明显增加,S期比例明显减少;B.转染miR-515-5p后细胞凋亡率增加。*与NC mimics组比较,P<0.05
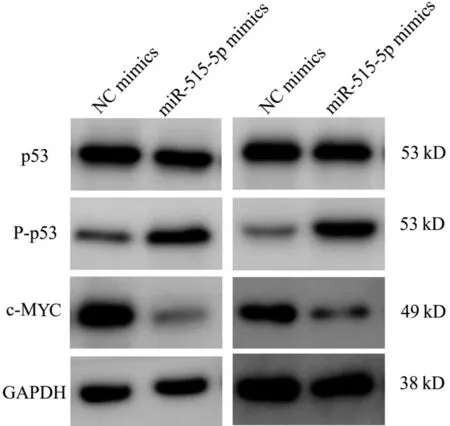
图4 Western Blot法检测miR-515-5p对相关蛋白水平表达的影响
3 讨论
近年来,有研究表明NB的发生发展与miRNA密切相关[6-7]。miRNA是一类内源性非编码单链小RNA分子,通过碱基互补配对的方式,导致靶基因mRNA降解或mRNA的翻译抑制,从而在转录后水平调控靶基因表达[8]。笔者前期通过生物信息学技术和多种软件预测方法,发现miR-515-5p在NB的表达不同于正常组织。本研究结果显示,过表达miR-515-5p后,NB SK-N-BE(2)和SK-N-AS细胞的增殖、侵袭和迁移能力均下降,提示miR-515-5p可能作为NB诊断及预测预后的新分子。
有研究表明,MYC通过作用于一系列细胞周期和细胞凋亡相关的下游靶基因,导致细胞周期和增殖改变,最终引发肿瘤[9-10]。MYC下游靶分子包括p53、S期相关蛋白激酶-2、鸟氨酸脱羧酶-1、双微体-2、miRNA和长链非编码RNA(lncRNA),这些分子在NB细胞的增殖、凋亡及分化等方面具有重要作用[11]。有研究发现,在MYC扩增且预后不良的NB患者中,包括miR-184在内的多种miRNA显著下调[12]。为系统研究MYC调控的miR-515-5p在NB中的作用,本研究在前期工作中利用RNA干扰技术在NB细胞中抑制了内源性MYC高表达,并通过miRNA芯片检测比较其与对照细胞miRNA的表达谱,证实miR-515-5p的表达水平低于正常组织。
p53是细胞中重要的肿瘤抑制因子之一,>50%肿瘤患者有p53基因突变。p53突变体丧失了与DNA结合的能力,因此失去了肿瘤抑制功能。有研究显示,p53突变能够抑制miR-27a的转录和表达,从而促进细胞增殖及肿瘤形成[13]。部分miRNA在高级别NB细胞中的表达发生变化,从而改变p53活性,促进上皮间质转化和转移[14]。本研究在利用生物信息学手段预测miR-515-5p转录调控机制中发现,在其上游保守区域内有MYC结合位点,而转染MYC的表达载体后,miR-515-5p的转录受到显著抑制。进一步表明miR-515-5p可通过 c-MYC-p53信号轴调控NB瘤细胞的生长。部分miRNA在高级别NB细胞中的表达发生变化,从而改变p53的活性,促进上皮间质转化和转移[14]。
综上所述,MYC调控的miR-515-5p在NB恶性行为中的功能及其机制值得深入探讨。本研究验证了miR-515-5p可能通过调控c-MYC-p53信号轴在NB发生和转移中发挥促抑制作用。此外,本研究将进行动物实验进一步探讨miR-515-5p在传递MYC恶性行为信号过程中的功能和意义,并为NB的诊断和预测、预后提供具有应用价值的新分子,为NB的生物治疗提供新的作用靶点。
