黄秋葵多糖提取工艺研究
2021-10-12马井喜赵大芳陈慧真
孙 赫,马井喜,赵大芳,陈慧真
(长春大学 食品科学与工程学院,吉林 长春 130022)
黄秋葵含有丰富的功能活性物质,其中包括对人体有益的黏性多糖、果胶、纤维素等成分。传统多糖提取方法耗时长、效率低,无法满足生产生活需要,因此对多糖提取工艺进行优化十分必要。本研究采用碱提法、水提醇沉法、超声波提取法对黄秋葵多糖提取进行研究,以期为黄秋葵多糖提取工艺的优化提供理论依据。
1 材料与方法
1.1 原料与试剂
原料:黄秋葵,购于吉林省长春市沃尔玛超市。
试剂:苯酚、浓硫酸、无水乙醇、盐酸、氯仿,均为分析纯,西安化学试剂厂;正丁醇、乙醚、丙酮、氨水,均为分析纯,天津天泰精细化学品有限公司。
1.2 实验仪器
全能粉碎机:天津市泰斯特仪器有限公司;分析天平:上海天平仪器有限公司;恒温水浴锅:上海树立;台式离心机:美国贝克曼公司;真空干燥箱:天津市泰斯特仪器有限公司;紫外可见光分光光度计:天津市泰斯特仪器有限公司;酸度计:广州深华生物有限公司;超声波清洗器:上海易净超声波仪器有限公司;循环水式真空泵:天津市泰斯特仪器有限公司;旋转蒸发器:上海树立。
1.3 方法
1.3.1 葡萄糖标准曲线的绘制
称取10 mg葡萄糖(分析纯),加入蒸馏水溶解,而后转移到容量瓶中定容并摇匀,配制成的葡萄糖样液即为标准品。用微量吸取器分别吸取0.2、0.4、0.6、0.8 mL标准品,在每个比色皿中加入蒸馏水,总溶液为1.0 mL,以此配比溶液梯度进行实验。加入5%苯酚1 mL及浓硫酸5.0 mL,轻微震荡以加速反应,放置20 min后进行测定。空白对照组为1.0 mL蒸馏水,按同样操作流程加入苯酚及浓硫酸。记录所测数据,进行线性拟合。
1.3.2 黄秋葵多糖的提取方法
1.3.2.1 主要提取方法
(1)碱提法。准确称取2.0 g黄秋葵粉末置于烧杯中,加入600 mL无水乙醇,充分混合均匀以除去部分色素;而后进行抽滤,在滤渣中加入碱液进行溶解浸提;取上清液离心并冷冻干燥,最后提取得到的即为黄秋葵粗多糖。
(2)水提醇沉法。准确称取2.0 g黄秋葵粉末,加入适量蒸馏水搅拌混匀,防止结块沉淀;100 ℃热水条件下浸提2次,将浸提液蒸发浓缩;在蒸发浓缩后的液体中加入无水乙醇浸提多糖,观察实验现象可知最后会产生部分沉淀物质,将该浸提液加速离心,得到部分固态沉淀物;将沉淀物加入少量蒸馏水进行溶解并且再次加入3倍体积的无水乙醇进行沉淀,实验重复3次,在最后一次沉淀实验中所得到的沉淀物即为黄秋葵粗多糖。
(3)超声波提取法。准确称取2.0 g黄秋葵粉末,加入蒸馏水混合均匀;再用饱和Ca(OH)调节pH值,置于超声波仪器中进行提取;将上清液通过乙醇沉淀后再次进行离心,放置一段时间使乙醇挥发完全,最后提取得到的即为黄秋葵粗多糖。
1.3.2.2 稳定性试验
称取2.0 g黄秋葵粉末,按照上述多糖提取工艺步骤提取粗多糖。将提取到的黄秋葵粗多糖放置于100 mL 烧杯中,加入蒸馏水搅拌溶解,再转移到1000 mL容量瓶中定容并摇匀。用微量吸取器分别吸取1.0 mL样液于试管中,并且同时以1.0 mL水按同样操作流程作为空白对照组,于 485 nm 处测定吸光值。记录所测数据,并且考察3 h内吸光值的稳定性(每30 min测1次)。
1.3.2.3 多糖溶解性实验
取适量三种提取法制得的黄秋葵粗多糖,分别溶于热水、冷水、乙醇、丙醇、正丁醇、氯仿等有机溶剂中,观察其溶解性。
1.3.2.4 精密度试验
将三种提取法制得的黄秋葵粗多糖分别放置于烧杯中,加入蒸馏水混合均匀,分别取6份2 mL样液进行实验(每种提取法2份样液)。利用苯酚-硫酸法测定样液,通过显色反应测定每个时间段的吸光度。通过比较6份样液的RSD值,可以考察三种提取方法的精密度。
1.4 黄秋葵多糖提取工艺优化
1.4.1 超声波法单因素实验
(1)实验温度。称取4.0 g黄秋葵粉末,在料液比为1∶30的情况下,加入蒸馏水混合均匀,再用饱和Ca(OH)碱液将溶液的pH值调节为9。然后将样液平均分成4份,分别在50、60、70、80 ℃条件下提取20 min。为减小实验误差,重复实验3次,记录实验数据。
(2)浸提时间。称取4.0 g黄秋葵粉末,在料液比为1∶30的情况下,加入蒸馏水混合均匀,再用饱和Ca(OH)碱液将溶液的pH值调节为9。然后将样液平均分成4份,在相同实验温度下分别浸提15、20、25、30 min。
(3)料液比。称取4.0 g黄秋葵粉末,平均分成4份,每份1.0 g。分别按照料液比为1∶20、1∶30、1∶40、1∶50加入蒸馏水混合均匀,再用饱和Ca(OH)碱液将溶液的pH值调节为9,然后在60 ℃条件下提取20 min。为减小实验误差,重复实验3次,记录实验数据。
(4)实验pH值。称取4.0 g黄秋葵粉末,在料液比为1∶30的情况下,加入蒸馏水混合均匀,然后将样液平均分成4份,用饱和Ca(OH)碱液将溶液的pH值分别调节为7、8、9、10,并在60 ℃条件下提取20 min。为减小实验误差,重复实验3次,记录实验数据。
1.4.2 超声波法正交试验
选取超声波提取法的实验温度、浸提时间、料液比、实验pH值为影响因素,设计正交试验,以确定超声波法提取黄秋葵多糖的最佳工艺条件。正交试验因素水平见表1。

表1 超声波法正交试验因素水平
2 结果与分析
2.1 葡萄糖标准曲线
如图1所示,葡萄糖标准品的回归方程为y=0.222x-0.2153,相关系数为R2=0.9995,可达到小数点后3个9,说明结果良好。
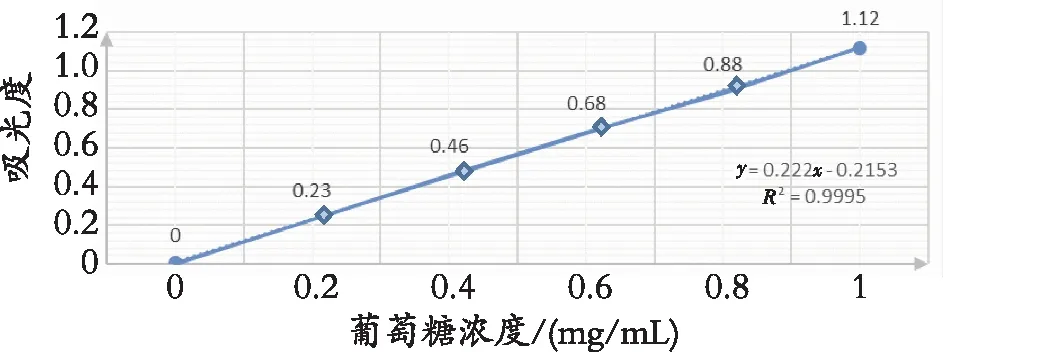
图1 葡萄糖标准曲线
2.2 碱提法结果
2.2.1 稳定性试验结果
碱提法稳定性试验结果见表2。数据显示,吸光度在3 h内变化范围较小,因此本实验利用苯酚-硫酸法进行黄秋葵多糖的定性和定量测定是有理论及实践依据的。

表2 碱提法稳定性试验结果
2.2.2 多糖溶解性实验结果
实验发现,碱提法提取的粗多糖易溶于极性有机溶剂,在热水、冷水中都有较好的溶解效果,但不溶于高浓度的非极性有机溶剂,如丙酮、氯仿、正丁醇、乙醚等。
2.2.3 精密度试验结果
碱提法精密度试验结果见表3。根据相对标准偏差(RSD)的计算公式得出RSD为0.0783%,说明试验结果精密度较好。
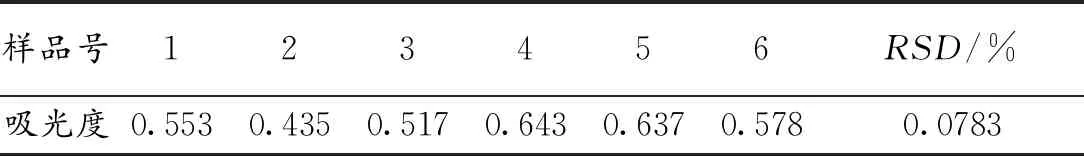
表3 碱提法精密度试验结果
2.3 水提醇沉法结果
2.3.1 稳定性试验结果
水提醇沉法稳定性试验结果见表4。数据显示,吸光度在3 h内变化范围较小,因此本实验利用苯酚-硫酸法进行黄秋葵多糖的定性和定量测定是有理论及实践依据的。

表4 水提醇沉法稳定性试验结果
2.3.2 多糖溶解性实验结果
实验发现,水提醇沉法提取的粗多糖易溶于极性有机溶剂,在热水、冷水中都有较好的溶解效果,但不溶于高浓度的非极性有机溶剂,如丙酮、氯仿、正丁醇、乙醚等。
2.3.3 精密度试验结果
水提醇沉法精密度试验结果见表5。计算6份样品的吸光度的相对标准偏差,得出RSD为0.0194%,说明试验结果精密度较好。
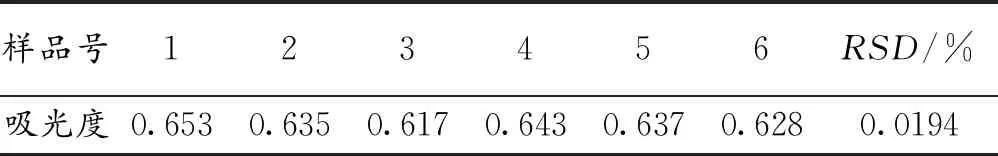
表5 水提醇沉法精密度试验结果
2.4 超声波法结果
2.4.1 稳定性试验结果
超声波法稳定性试验结果见表6。数据显示,吸光度在3 h内变化范围较小,因此本实验利用苯酚-硫酸法进行黄秋葵多糖的定性和定量测定是有理论及实践依据的。
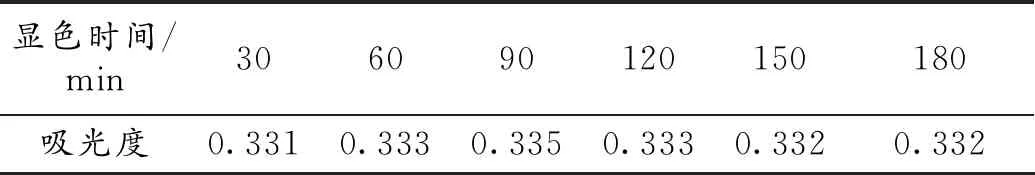
表6 超声波法稳定性试验结果
2.4.2 多糖溶解性实验结果
实验发现,超声波法提取的粗多糖易溶于极性有机溶剂,在热水、冷水中都有较好的溶解效果,但不溶于高浓度的非极性有机溶剂,如丙酮、氯仿、正丁醇、乙醚等。
2.4.3 精密度试验结果
超声波法精密度试验结果见表7。计算6份样品的吸光度的相对标准偏差,得出RSD为0.0074%,说明试验结果精密度好。
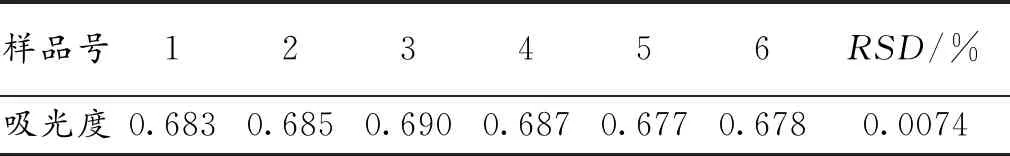
表7 超声波法精密度试验结果
2.5 超声波法单因素实验结果及分析
2.5.1 实验温度对多糖得率的影响
由图2可以看出,多糖得率随着实验温度上升而提高,当实验温度为60 ℃时,多糖得率最高。
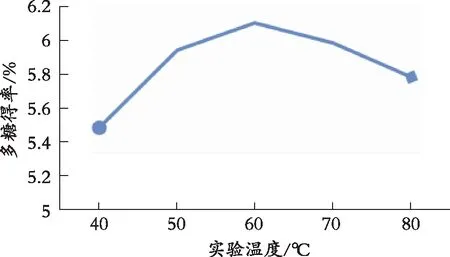
图2 实验温度对多糖提取率的影响
2.5.2 浸提时间对多糖得率的影响
由图3可以看出,多糖得率随着浸提时间的延长而提高。但是时间过长可能造成超声波空化作用太久,长时间的超声波作用可能使多糖链断裂,破坏多糖结构,从而导致提取率降低。
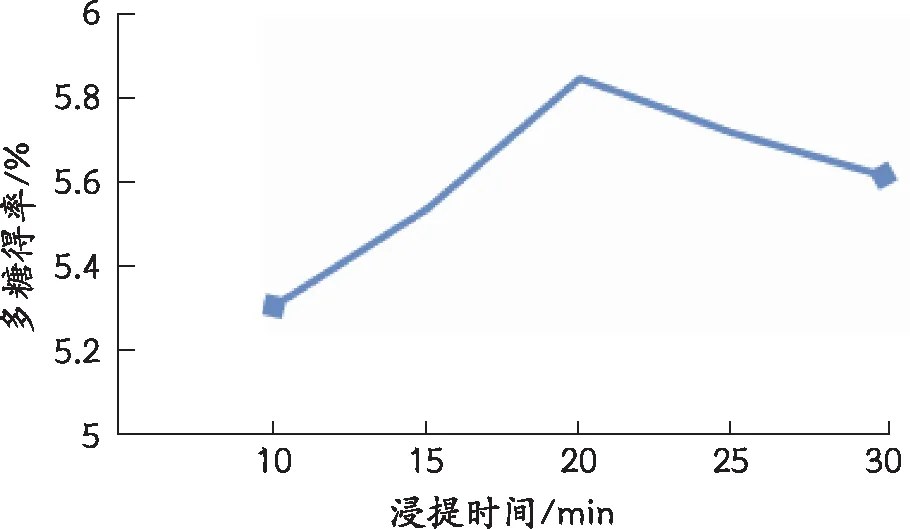
图3 浸提时间对多糖提取率的影响
2.5.3 料液比对多糖得率的影响
由图4可以看出,加大料液比可以在一定程度上提高多糖提取率。当料液比较大时,溶液中的多糖浓度低,使得溶液和黄秋葵之间形成了另一个浓度差,从而加快分子的扩散速率。同时,料液比加大可以使胶质多糖的分解速率加快,促使多糖分子从黄秋葵中加速分离。
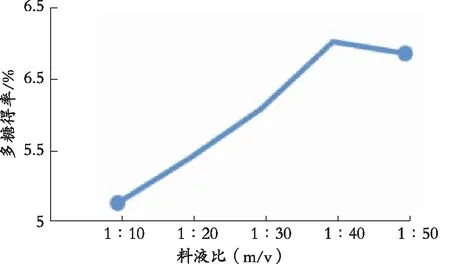
图4 料液比对多糖提取率的影响
2.5.4 实验pH值对多糖得率的影响
由图5可以看出,多糖得率随着pH值增大而提高,当pH值为9时,提取效果最佳。多糖在酸性或者碱性条件下会发生水解反应,最后生成单糖,因此在pH值很低或者很高的情况下多糖均会发生水解反应,并且过酸或过碱的条件也会使得黄秋葵中纤维素等物质发生水解反应。
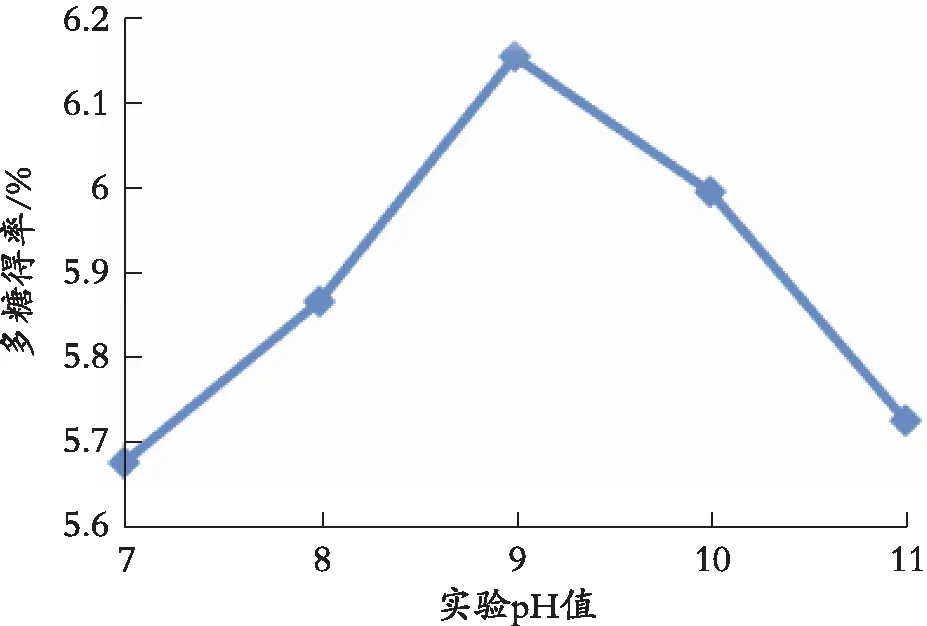
图5 实验pH值对多糖提取率的影响
2.6 超声波法正交试验结果及分析
超声波法正交试验结果见表8。各因素的影响程度为B>A>D>C,即浸提时间>实验温度>实验pH值>料液比。最优组合为A3B2C1D3,即实验温度70 ℃、浸提时间20 min、料液比1∶30、实验pH值10,在此条件下,黄秋葵多糖得率为6.79%。
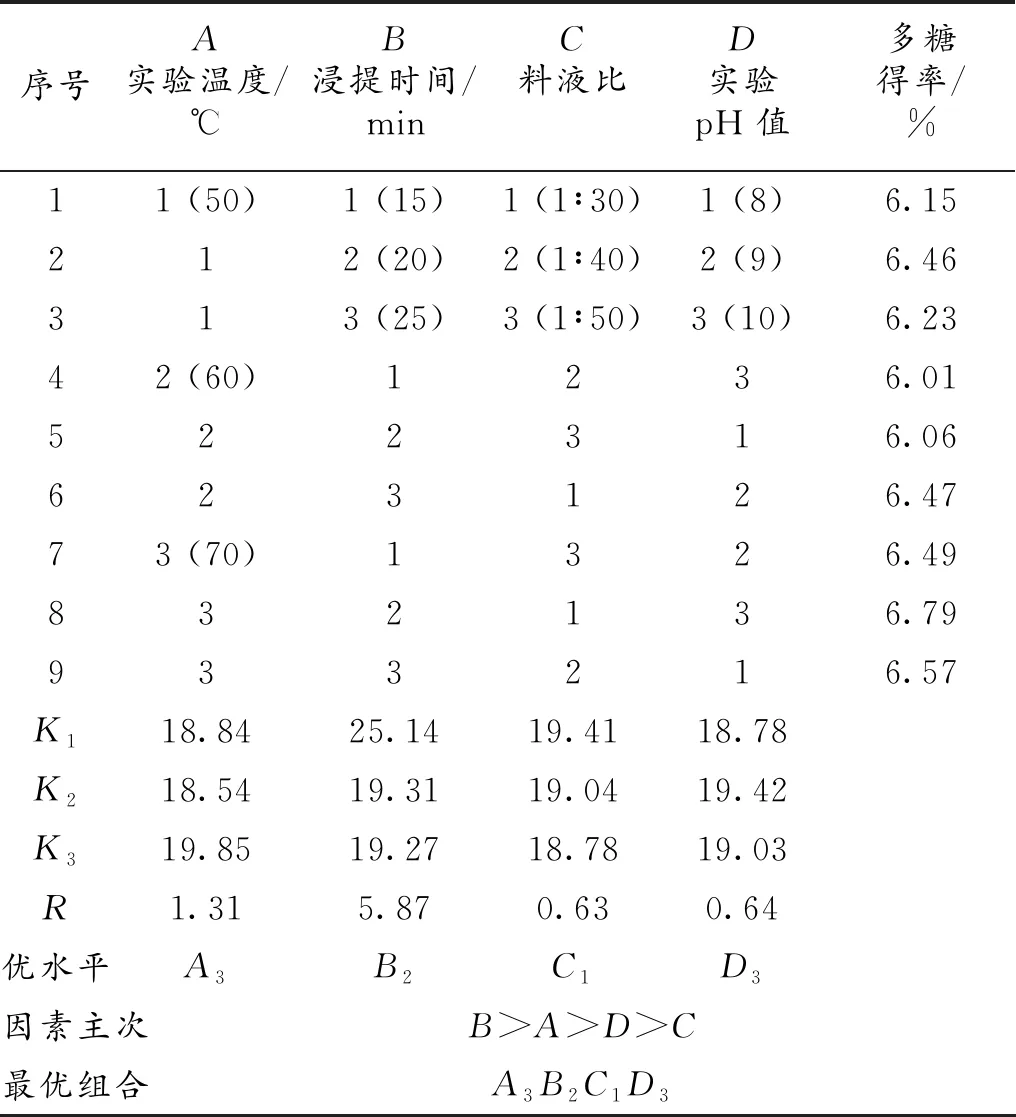
表8 超声波法正交试验结果
3 结论
本文以黄秋葵为原料,比较碱提法、水提醇沉法、超声波提取法三种方法的多糖提取效果,探究黄秋葵多糖的最佳提取工艺。通过单因素实验及正交试验得出,利用超声波提取黄秋葵多糖的最佳提取工艺为实验温度70 ℃、浸提时间20 min、料液比1∶30、实验pH值10。在此条件下,黄秋葵多糖得率达到最大值,为6.79%。
