异氟醚通过醛糖还原酶改善线粒体功能保护脑缺血/再灌注损伤
2021-10-12孙景波邓敏贞蔡粤芳SookjaKimChung
蒋 雯,李 杰,黄 燕,3,4,孙景波,3,4,邓敏贞,蔡粤芳,Sookja Kim Chung,程 骁,3,4
(1.广州中医药大学第二临床医学院,广东广州510405;2.广东省中医院//广州中医药大学第二附属医院,广东广州510006;3.广东省省部共建中医湿证国家重点实验室,广东广州510120;4.广东省中医急症重点实验室,2017B030314176,广东广州510120;5.澳门科技大学医学院,澳门999078)
卒中是全球第二大死亡原因,也是残疾的主要原因,缺血性脑卒中约占80%[1]。目前静脉溶栓是临床治疗缺血性脑卒中的有效方式,但存在治疗时间窗短及出血等问题[2],只有少数患者能够及时接受溶栓治疗。因此研发有效治疗缺血性脑卒中的药物是临床臻待解决的问题。异氟醚(isoflurane,ISO)是一种挥发性和吸入性麻醉药,已在围手术期广泛使用了几十年。大量实验研究表明,1.5%的异氟醚后处理具有明显的脑保护作用[3-4]。之前针对异氟醚脑保护作用的研究普遍集中在氧化应激、炎症反应、离子平衡等方面,较少涉及到线粒体功能。而线粒体功能障碍会激活细胞凋亡级联反应,加重脑缺血/再灌注(cerebral ischemia/reperfusion,IR)损伤[5]。有实验证实异氟醚干预可以降低由缺血/再灌注损伤引起的线粒体膜通透性的增加,从而发挥神经保护作用[6]。但是异氟醚具体通过何种机制调节线粒体功能目前仍不清楚。醛糖还原酶(aldose reductase,AR)是多元醇通路的第一个酶,同时也是关键限速酶,参与糖尿病的血管病变和神经病变的生理病理过程。合作课题组前期研究发现敲除AR基因,脑缺血损伤后神经功能评分及脑梗死面积均明显减少,表明AR基因敲除对脑缺血/再灌注损伤起保护作用[7]。最近关于糖尿病的研究还表明AR激活是血小板线粒体功能障碍的关键因素,抑制AR可以保护血小板线粒体免受缺血/再灌注损伤[8]。因此本研究拟探讨异氟醚能否通过影响AR改善线粒体功能来发挥脑缺血/再灌注损伤的保护作用及机制。
1 材料与方法
1.1 实验动物与分组
30只AR基因敲除小鼠及30只对照健康成年野生型C57BL/6小鼠随机分为6组:假手术组(WTS)、脑缺血/再灌注组(WT-IR)、脑缺血/再灌注+异氟醚后处理组(WT-IR+ISO)、AR基因敲除小鼠+假手术组(AR-/-+S)、AR基因敲除小鼠+脑缺血/再灌注组(AR-/-+IR)和AR基因敲除小鼠+脑缺血/再灌注+异氟醚后处理组(AR-/-+IR+ISO)。实验动物均采用8-12周龄健康雄性小鼠,体质量均为20~30 g,购自广东省医学实验动物中心[SCXK(粤)2019-0035]。动物统一饲养在SPF级的动物房中,标准条件饲养:每标准饲养笼饲养5只小鼠,提供SPF级小鼠颗粒饲料和灭菌后自来水自由饮食,饲养空间保持良好通风,控制温度在25℃~27℃,湿度50%~60%,保持12 h的光照/12 h黑暗周期切换等。动物实验经由广东省中医院实验动物伦理委员会批准(伦理编号:2019050)。
1.2 药物与试剂
异氟醚(批号:20110201,深圳市瑞沃德科技有限公司);MCAO栓线(货号:1620A4,北京西浓科技有限公司);2,3,5-氯化三苯基四氮唑(2,3,5-Tri⁃phenyltetrazolium chloride,TTC)染色液(货号:T8877,美国sigma公司);BCA蛋白试剂盒(货号:P0009,上海碧云天生物技术有限公司);ECL化学发光试剂(货号:WBKLS0500,美国MERCK默克密理博公司);AR单克隆抗体(货号ab153897,美国abcam公司);NeuN多克隆抗体(货号:ab104224,美国abcam公司);山羊抗兔IgGH&L(HRP)(货号:ab6721,美国abcam公司);TUNEL试剂盒(货号:MK1018,武汉博士德生物工程有限公司);线粒体通透性转换孔(Mitochondrial Permeability Transi⁃tion Pore,MPTP)检测试剂盒(货号:C2009S,上海碧云天生物技术有限公司)。
1.3 模型建立与给药方法
按照课题组前期的方法制作小鼠缺血再灌注损伤动物模型[9],具体步骤如下:50 mg/Kg戊巴比妥钠腹腔注射麻醉动物,动物取仰卧位,平躺在手术显微镜下,行颈部正中切口,暴露右侧颈总动脉、颈外动脉、颈内动脉,在距离颈外动脉根部约5 mm处结扎颈外动脉,并在其根部放置结扎线打活结备用。提起颈总动脉,再用动脉夹夹闭颈内动脉,拉直颈外动脉,在颈外动脉远心端剪一小口,边松开动脉夹边将一端加热成圆珠状的线栓(栓线直径0.2 mm)送入颈内动脉,以阻断大脑中动脉的起始处血供。于颈总动脉切口上方用丝线固定线栓,彻底止血,逐层缝合肌肉和皮肤;将动物置于保温箱中,MCAO 1 h将线栓取出,完成再灌注。而WTIR+ISO组和AR-/-+IR+ISO组小鼠在经历了1 h大脑中动脉缺血后,在再灌注开始时放入吸入麻醉箱中,调节压缩空气流量至1 L/min,异氟醚挥发罐连接压缩气出口和吸入麻醉箱入口,调节刻度至1.5%,全程使用麻醉气体监测仪监控异氟醚浓度,60 min后取出放饲养笼复苏。假手术组采用同样的手术操作但不插入线栓。
1.4 神经功能评定
缺血/再灌注24 h后,采用Zea-Longa法进行神经功能评定,评分细则如下。0分:未见神经功能损伤症状(正常);1分:不能完全伸展对侧前爪(即提尾悬空实验阳性;轻度);2分:侧推抵抗力下降(即侧向推力实验阳性),伴向对侧转圈行为(中度);3分:向对侧倾倒(重度);4分:不能自发行走,意识丧失(严重)。评分越高,说明动物神经功能缺损越严重。其中过早死亡的小鼠不纳入统计。
1.5 TTC染色并测量梗死体积
在评估神经缺损后(缺血/再灌注24 h后),麻醉小鼠,采用生理盐水灌注心脏排除不必要的血液干扰后进行大脑取样。把大脑取出在-20℃的冰箱中快速冷冻(约1 h)。大脑被迅速切开5个2 mm厚的冠状切面,然后用2%TTC染色,在37℃培养箱中避光15 min,隔7~8 min翻转一次脑片。40 g/L多聚甲醛用于固定脑组织至少24 h用于拍摄每片的后表面。图像用Image J测量脑梗死体积(红色区域为正常区域脑组织,苍白的区域代表梗死区)。梗死体积计算为梗死侧体积相对于该小鼠大脑总体积的百分比。
1.6 Western blot定量检测醛糖还原酶的表达量
取各组动物脑组织匀浆。采用BCA蛋白浓度测定试剂盒进行蛋白浓度的定量。各组取10µL蛋白上样后,进行SDS-聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转移至PVDF膜上。封闭液封闭1 h,将膜放入稀释的一抗中4℃孵育过夜。然后用TBST漂洗,每次5 min,漂洗三次,室温下与相应二抗孵育1 h后,TBST洗膜。暗室曝光,得到图像结果后应用ImageJ软件测量灰密度值。
1.7 免疫荧光双标染色
麻醉小鼠后取出脑,并在40 g/L多聚甲醛溶液中固定24 h,再进行乙醇梯度脱水、二甲苯透明和石蜡包埋,然后使用切片机连续切4µm厚的石蜡切片,经二甲苯脱蜡和乙醇脱水后,进行热抗原修复。之后各组切片使用5%BSA封闭1 h,滴加1:200的兔抗AR和鼠抗NeuN一抗(抗体浓度1:200)4℃孵育过夜,PBS3 min洗涤3次后,滴加FITC和Red标记的生物素化IgG二抗(抗体浓度1:1 000),湿盒避光37℃孵育1 h,PBS洗涤后暗室下用0.5µg/mL的DAPI溶液染细胞核5 min,抗荧光淬灭剂封片后激光共聚焦显微镜下观察。每张切片在200倍视野下随机选取脑缺血半暗带区的视野进行采图。
1.8 TUNEL荧光染色
将上述经40 g/L多聚甲醛固定后的脑组织,常规进行脱水、石蜡包埋和切片,然后彻底脱蜡结束后,滴加蛋白酶K消化20 min,PBS洗涤3次后,加入预混好号的TUNEL染色液染色15 min,再次PBS洗涤3次后,DAPI孵育3 min,进行PBS洗涤后,使用抗荧光淬灭剂封片。使用荧光倒置显微镜观察脑组织TUNEL阳性细胞个数。DAPI染色细胞核在紫光激发下呈蓝色荧光,TUNEL阳性凋亡细胞在蓝光激发下呈绿色荧光。
1.9 单细胞悬液制备
麻醉小鼠,采用生理盐水充分灌注心脏直至组织没有血色,排除不必要的血液干扰后迅速进行大脑取样。取出脑组织放入PBS中冲洗干净,修剪好后放入1.5 mL EP管中,加入配置好的混合消化液1 mL,使用眼科剪迅速完全剪碎组织,以上全程在冰台操作。随后在37℃恒温箱中振荡消化,用84吸管吹打混匀后转移至新的10 mL的EP管中,加入1 mL含有10 g/L胎牛血清的PBS终止消化,反复消化数次直至组织完全消化。随后使用200目滤网过滤细胞悬液至新的10 mL EP管中,所得即是单细胞悬液。
1.1 0 流式细胞检测线粒体通透性转换孔
使用Calcein AM法检测MPTP的开放程度。向单细胞悬液中加入适当体积的检测缓冲液、Cal⁃cein AM染色液、荧光淬灭工作液或Ionomycin对照重悬,每个样品体积为1 mL,37ºC避光孵育30 min。孵育完成后,1 000×g室温离心5 min收集细胞。每个样品加入1 mL检测缓冲液,轻轻重悬,1 000×g室温离心5 min收集细胞,可去除多余染料及可能引起荧光淬灭的试剂。最后重新加入400µL检测缓冲液重悬细胞。染色后,将样品置于冰上,并且在1 h内进行流式细胞仪检测和分析。Calcein的最大激发光波长为494 nm,最大发射光波长为517 nm。
1.1 1 统计学分析
采用SPSS 25.0统计学软件进行统计分析,所有数据均符合正态分布以均数±标准差表示,所有数据均满足方差齐性,多组间采用单因素方差分析(One-way ANOVA)进行统计,组间两两比较用方差分析后的LSD检验。采用双侧检验,检验结果以P<0.05为差异有统计学意义。
2 结果
2.1 异氟醚对WT及AR-/-小鼠脑缺血/再灌注损伤后神经功能评分及脑梗塞体积的影响
神经功能评分结果显示:六组结果差异有统计学意义(F=31.048,P=0.000)。与假手术相比,WT小鼠及AR-/-小鼠模型组神经功能评分明显增加(P均<0.001),表明脑缺血再灌注损伤引起小鼠神经功能缺损;与WT-IR组相比,AR-/-+IR组神经功能评分明显减少(P<0.01),表明敲除AR能够保护脑缺血再灌注损伤小鼠的神经功能缺损。比较WTIR组,WT-IR+ISO组神经功能评分明显降低(P<0.01),表明ISO能保护脑缺血再灌注损伤小鼠的神经功能缺损。而对比AR-/-+IR组,AR-/-+IR+ISO组神经功能评分并无差异(表1)。
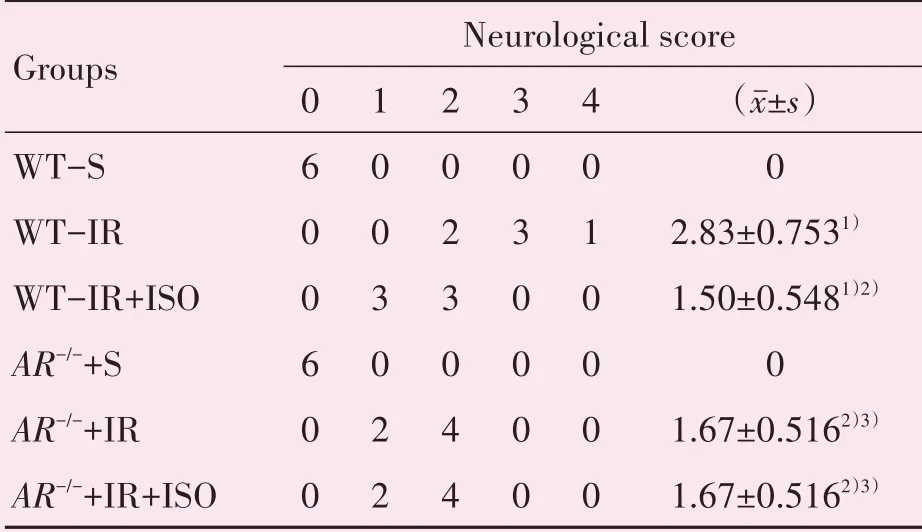
表1 各组的神经功能评分Table 1 The neurological score of each groups
经过TTC染色后,WT-S组及AR-/-+S组未见明显苍白脑梗死灶,而WT与AR-/-小鼠IR组与IR+ISO组缺血侧均可见明显白色的脑梗死灶。梗死体积统计结果显示:6组结果差异有统计学意义(F=105.953,P=0.000)。与WT-IR组相比,WT-IR+ISO组脑梗塞体积百分比明显减小(P<0.001),结果表明异氟醚干预可以保护脑缺血/再灌注损伤。而对比AR-/-+IR组,AR-/-+IR+ISO组脑梗塞体积差异无统计学意义(图1A、B)。
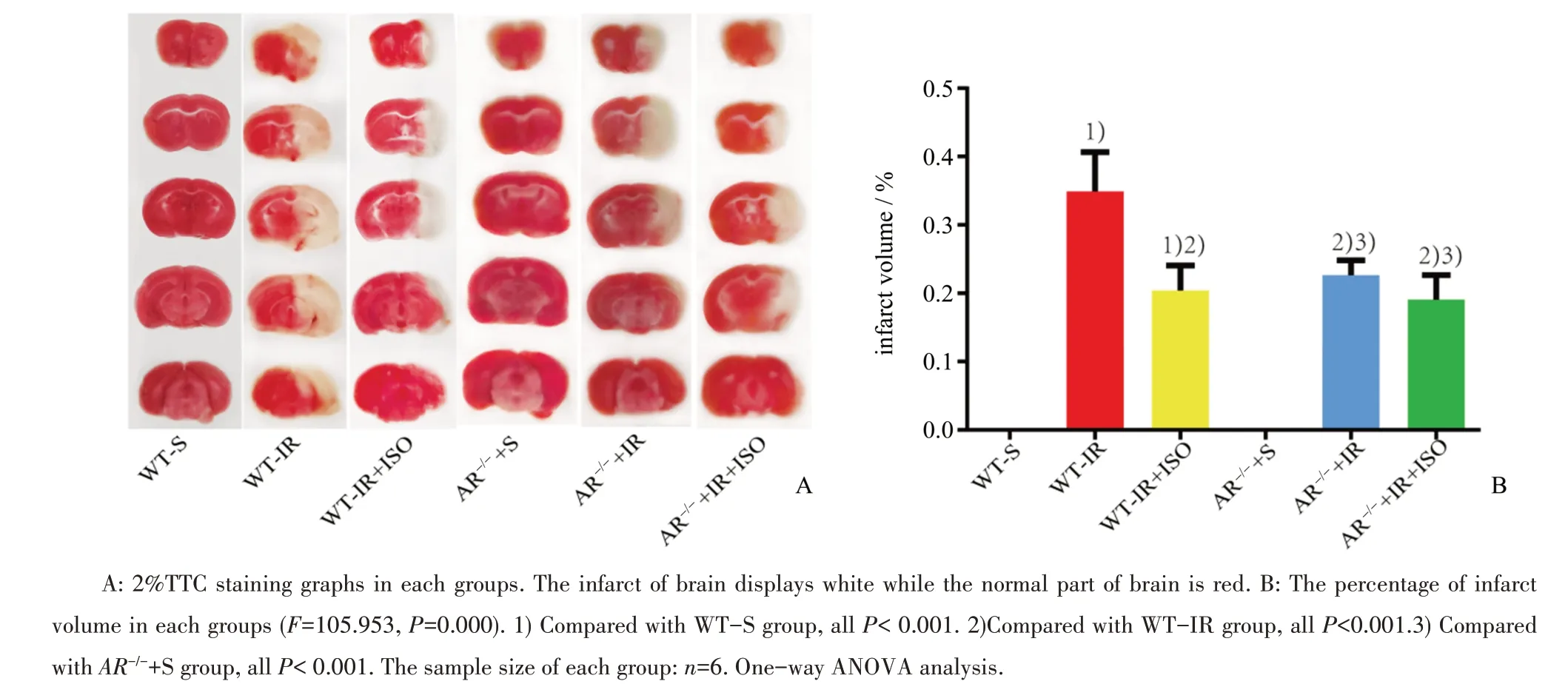
图1 异氟醚对野生型和AR-/-小鼠缺血/再灌注损伤后神经功能评分和脑梗塞体积影响Fig.1 Influences of isoflurane on neurological score infarct volume and in WT and AR-/-mice
2.2 异氟醚对脑缺血小鼠损伤侧醛糖还原酶表达的影响
对正常C57BL/6小鼠进行tMCAO并给予1.5%异氟醚吸入,脑组织AR+NeuN免疫荧光双标结果显示:3组结果差异有统计学意义(F=97.302,P=0.000)。AR及NeuN蛋白在细胞浆表达;与WT-S组比较,WT-IR组AR蛋白的表达增加(P<0.01);WT-IR+ISO组缺血半暗带神经元内AR表达相比于WT-IR组的明显减少(P<0.001;图2A、B)。蛋白印记结果显示:3组结果差异有统计学意义(F=24.178,P=0.001)。与WT-IR组比较,WT-IR+ISO组AR蛋白表达水平明显降低(P<0.01;图2C)。结果表明异氟醚能够下调脑缺血引起的损伤侧脑组织神经元内AR表达的增加。

图2 醛糖还原酶在脑缺血/再灌注损伤小鼠中的表达Fig.2 Expression of aldose reductase in ischemic brain of mice
2.3 异氟醚对WT及AR-/-小鼠缺血半暗带神经细胞凋亡的影响
TUNEL染色结果显示:6组结果差异有统计学意义(F=792.677,P=0.000)。在WT-S和AR-/-+S组中,仅有极少量TUNEL阳性细胞;与WT-IR组相比,WT-IR+ISO组缺血半暗带中的凋亡细胞明显减少(P<0.001);与WT-IR组相比,AR-/-+IR组TU⁃NEL阳性细胞减少(P<0.001),说明敲除AR基因后可以减少神经细胞凋亡;而AR-/-+IR+ISO组与AR-/-+IR组相比,TUNEL阳性细胞没有明显变化,说明敲除AR基因以后,异氟醚的保护作用消失了(图3)。
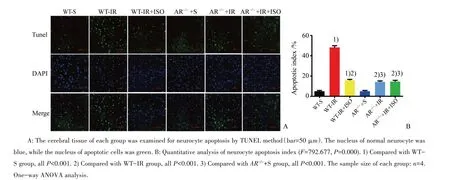
图3 异氟醚后处理对各组小鼠神经细胞凋亡的影响Fig.3 Effects of isoflurane post-conditioning on cerebral cell apoptosis in mice
2.4 异氟醚对WT及AR-/-小鼠脑缺血侧的线粒体通透性转换孔开放程度的影响
流式细胞检测MPTP结果显示:6组结果差异有统计学意义(F=409.891,P=0.000)。与WT-S组相比,WT-IR组MPTP开放程度明显增加(P<0.001)。与WT-IR组相比,WT-IR+ISO组MPTP开放程度明显减少(P<0.001),提示异氟醚后处理的脑保护作用可能与线粒体通透性转换孔开放减少有关。与WT-IR组相比,AR-/-+IR组MPTP开放程度明显下降(P<0.001);但是与AR-/-+IR组相比,AR-/-+IR+ISO组MPTP开放程度差异没有统计学意义(图4)。
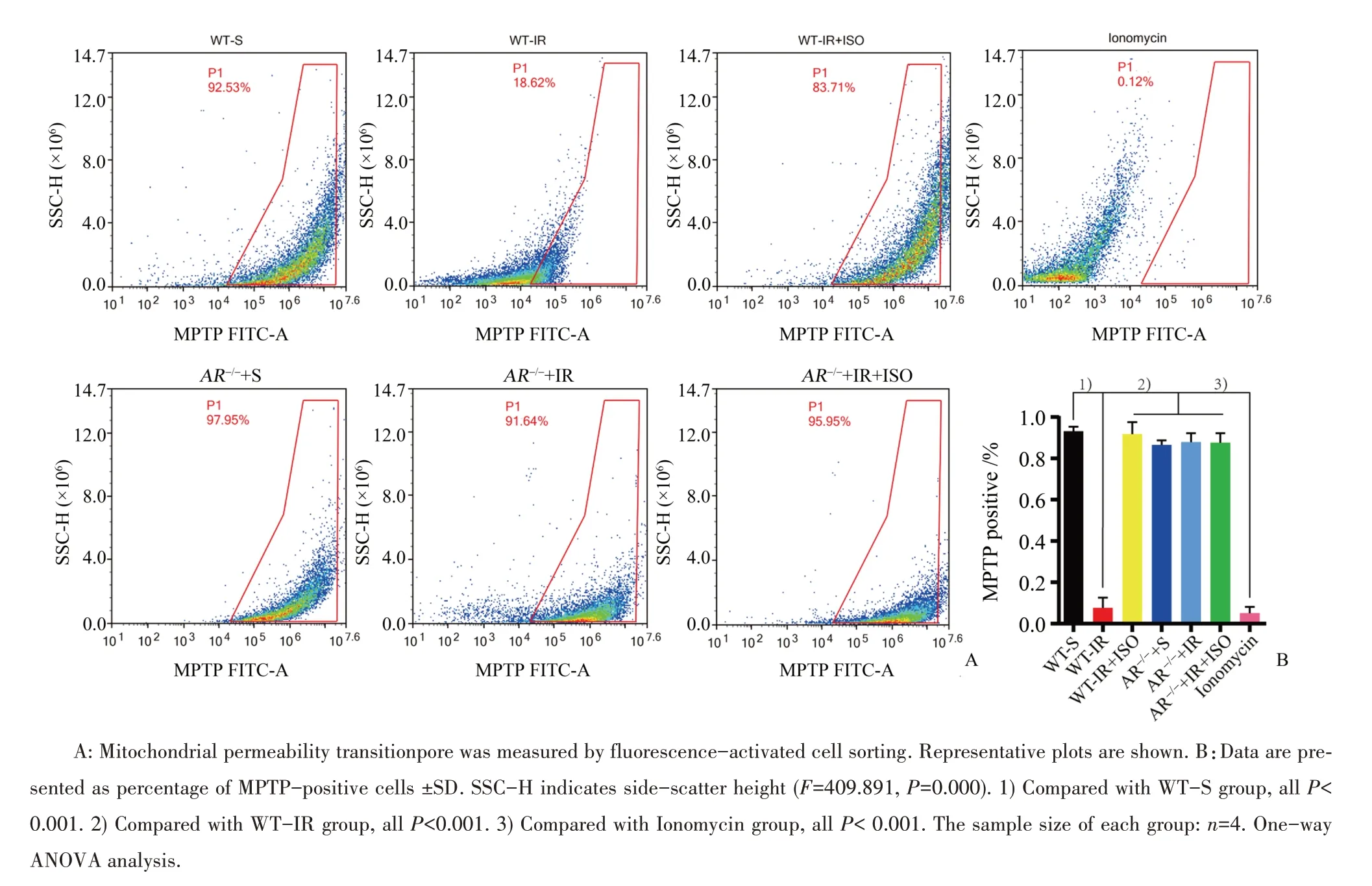
图4 异氟醚后处理对各组小鼠神经细胞线粒体通透性转换孔的影响Fig.4 Effects of isoflurane post-conditioning on cerebral cell MPTPin mice
3 讨论
本研究发现异氟醚后处理减少脑缺血后的梗塞体积,改善神经功能,说明异氟醚对脑缺血/再灌注损伤具有保护作用。同时异氟醚后处理能够下调脑缺血后引起的AR表达的增多,并减弱神经细胞凋亡,同时还减少了MPTP开放,改善了线粒体功能障碍。然而对脑缺血/再灌注小鼠进行异氟醚后处理的效果,与敲除AR基因的效果一致,并且对AR-/-小鼠再给予异氟醚干预发现,异氟醚对神经细胞凋亡和线粒体功能的保护作用并没有进一步体现,提示AR是异氟醚减轻线粒体功能障碍的关键信号分子。所以我们提出异氟醚通过调控AR,保护线粒体功能,减少细胞凋亡,从而在脑缺血/再灌注损伤中发挥神经保护作用。
线粒体通常被称为细胞动力源,在基础研究中经常被忽视,但线粒体还与一系列凋亡相关蛋白有着关联[10-12]。而触发细胞凋亡级联反应的关键在于线粒体内膜中的线粒体通透性转换孔(MPTP)的开放[13]。MPTP的瞬时开放触发了细胞色素C(cytochrome C,Cyt-C)以及其他促凋亡分子的释放。Cyt-C与细胞质凋亡蛋白酶激活因子1相互作用,以促进凋亡小体的形成并启动凋亡过程[14]。这些证据提示线粒体在脑缺血引发的神经细胞凋亡过程中发挥了不可忽视的作用。为了阐明异氟醚后处理对线粒体损伤的保护作用,本研究检测了缺血侧脑组织的MPTP开放情况以及缺血半暗带处细胞凋亡情况,发现异氟醚干预后MPTP孔开放减少,并且缺血半暗带处细胞凋亡明显减少,提示异氟醚后处理可能是通过减少线粒体通透性转换孔开放,从而释放出较少的Cyt-C,使得神经细胞凋亡减少。
醛糖还原酶在血糖浓度维持正常生理水平时并不激活;而在高血糖状况下,AR过度激活[15-16]。而AR过度激活后最显著的变化是活性氧(reactive oxygen species,ROS)大量生成,造成严重的氧化应激加剧细胞凋亡。内源性抗氧化剂系统可以抵消ROS的微小变化。然而严重的氧化应激则会直接通过凋亡或坏死途径导致细胞死亡[17]。ROS在多种刺激下的活细胞中产生,其中包括缺氧,脑缺血,细胞因子刺激和血清剥夺等多种来源,而线粒体,5-脂氧合酶和NADPH氧化酶是主要来源[18-19]。其中线粒体是细胞内ROS的主要来源[20-21]。早前的研究证实AR在介导心肌缺血/再灌注损伤中起着核心作用,抑制AR途径可以通过减少MPTP开放而挽救缺血性心肌[22]。最近有研究表明AR过度激活诱发强烈的氧化应激,通过促进p53磷酸化及其与Bcl-xl的结合,从而导致线粒体通透性转换孔开放,Cyt-C大量释放入细胞质中,介导细胞凋亡[23]。本研究发现异氟醚后处理可以减少因缺血/再灌注损伤导致的脑组织AR蛋白表达增多,从而减少MPTP开放,减少神经细胞凋亡。然而敲除掉AR基因后,异氟醚的这种神经保护作用消失了,提示AR参与了异氟醚减少MPTP开放改善脑缺血/再灌注损伤的过程。然而对于AR发挥生物学效应的详细机制,特别是线粒体内信号传导通路方面的具体机制目前仍不明了,有待进一步深入的研究。
