棉花幼苗内源保护酶对高温与渍水胁迫的响应
2021-10-11郭佳黄丽杨盼王海苗陆泉泉卢秋美冉莉琴
郭佳 黄丽 杨盼 王海苗 陆泉泉 卢秋美 冉莉琴

摘 要 为量化“中棉所45”棉花幼苗内源保护酶对高温和渍水双重胁迫的响应,采用盆栽试验,以正常生长情况为对照(CK),设置3种胁迫:高温(HT)、渍水(WL)、高温+渍水(HT+WL)互作处理;处理前后测定棉花幼苗的形态指标、SPAD值、内源保护酶活性和丙二醛(MDA)含量,分析各处理间差异。结果表明:1)HT、WL和HT+WL胁迫7 d后,棉花株高和真叶相对含水量较对照显著降低。2)与处理前相比,各处理棉花叶片SPAD值显著下降;棉花根和子叶中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性和MDA含量增加,其中子叶SOD活性分别增长了15.00%、9.84%和40.93%,子叶CAT活性分别增长了22.6%、76.3%和100.2%,子叶POD活性分别增长了36.23%、56.59%和88.16%。3)高温与渍水双重胁迫对棉花幼苗中内源保护酶活性具有显著叠加效应及互作效应,且根响应胁迫较子叶敏感。
关键词 棉花幼苗;高温胁迫;渍水胁迫;内源保护酶;丙二醛
中图分类号:S562 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2021.25.003
棉花,在我国农作物经济发展上具有重要地位。据相关报道,在全球棉花产量中,我国棉花产量占1/4[1]。我国棉区划分为三大区域,包括黄河流域棉区、西北内陆棉区、长江流域棉区,其中,长江流域棉花种植区气候属于亚热带季风气候,常会出现洪涝、梅雨渍害等灾害天气。棉花生长发育需要经历幼苗期、现蕾期、花铃期、吐絮期四个阶段,每一阶段对棉花产量质量都有重要的影响,其中幼苗期是棉花生长发育最基础的阶段。1)棉花喜光热[2],耐涝渍性差,整个生育期需水量少[3],因此,即使是短期的涝渍也会对棉花的生长产生极大的持久影响[4]。2)过高的温度会严重影响棉花的长势、叶片含水量、光合能力和内源保护酶活性等正常的生理活动,最终影响棉花产量品质。3)棉花还在较大程度上受到其他非生物因素如光照、涝害等不可控的自然条件的影响。有研究表明,氧化胁迫是植物遭受环境胁迫的主要危害因素,ROS(活性氧)代谢在植物交叉适应各种非生物胁迫中起着重要作用,植物的交叉耐受性与抗氧能力之间存在正相关[5-7]。前人对于植物受到不适温度或者水分等非生物因素胁迫后,植株生理响应机制的研究颇丰,对于棉花植株在不同时期受到旱涝[2-4,8-9]、高温[10]、低温[11-12]、盐分[13-15]或者金属离子[16-17]等非生物因子胁迫后的生理机制研究也很多。但针对中国农业科学院棉花研究所育成的早熟高产优质棉花新品种“中棉所45”苗期受到短期的涝渍和高温双重胁迫与单一胁迫后,对植株的根和子叶内源保护酶不同影响的量化对比鲜有报道。
本试验以中棉所45为材料进行模拟雨热同期的环境胁迫,以期量化苗期棉花对HT与WL单一胁迫,以及双重胁迫对植株不同部位的响应变化特征,为大田生产苗期棉花的育苗、保苗、筛选苗株等措施提供有用的参考信息,为棉花高抗性品种选育提供理论基础。
1 材料与方法
1.1 供試材料
2019年在广西桂林(110°29′E,25°10′N)广西师范大学伯康楼恒温光照培养箱进行盆栽试验,盆高7.5 cm、直径9 cm,盆底有排水孔。供试材料为中棉所45 (生育期135 d)。栽培土壤取自有机营养土,含有泥炭土、珍珠岩、蛭石等,有机质含量约占65%。
1.2 试验处理
本试验共设置4个处理:HT(高温)、WL(渍水)、HT+WL(HT+WL)、CK(正常条件下生长)。试验采用随机区组设计,每个处理设置3个重复,每个重复15盆,每盆3株棉花苗株。
5月7日将中棉所45(生育期128~135 d)种子播种于小盆中,3粒/盆,距离均相等。将营养土和自来水混匀后往花盆里装土,装后压实,直到与小盆口径平行,各小盆所装土壤体积相同。将小盆以3×5(每个中转箱可装15个盆)整齐排列盛放于事先准备的中转箱中,放入温光培养箱中进行培养。后期选用Hoaglands营养液进行浇灌。
棉花出苗后,生长至高约5 cm,用蒸馏水将营养液稀释100倍,每隔3天浇灌1次,每次10 mL。在棉花生长到三叶一心期时,开始进行处理。对照为自然温度25/20 ℃。HT胁迫处理将幼苗置于恒温温光培养箱中35/30 ℃条件下处理,光照时间6:00—18:00,相对湿度控制在65%左右。处理时间为7月20—27日,共持续7 d。HT处理结束后,将棉花植株移出恒温温光培养箱,将其置于与对照组同一自然环境下并及时通风。WL处理、HT处理、HT+WL互作处理同期进行。WL期将塑料盆放入含水的中转箱内,以小花盆内土壤相对含水量(75±5)%为对照(CK),设置土壤WL 7 d(7月20 日),WL期间保持中转箱内有6 cm水层。WL处理结束后排除中转箱中的水,然后将塑料盆原位放置回试验区,使土壤相对含水量降低至(75±5)%,并维持在此水平。HT+WL互作处理将盆栽放入含水层为6 cm的中转箱中,并置于恒温温光培养箱中35/30 ℃条件,持续7 d。在HT、WL胁迫条件处理前后进行取样,测定棉花各生长指标、SPAD值、MDA含量、内源保护酶(SOD、CAT、POD)活性。
1.3 测定项目及方法
1.3.1 形态学指标测定
株高(cm):用直尺测量棉花在各处理后的株高,每个重复区域呈对角线定点取3盆作为待测样品,共9株棉花,每个处理3个重复。
真叶相对含水量(%):于各处理结束后第二天早上10:00,每个重复区域定点取9株棉花,称棉花真叶鲜重(FW)。然后将叶片浸入装满水的培养皿中浸泡10 h至叶片吸水饱和,轻轻擦干棉花叶片表面水分,称叶片饱和重(TW)。随后将样品放入牛皮纸袋中,贴好标签,105 ℃杀青30 min,80 ℃烘干至恒重后称干重(DW),按照公式(1)计算真叶的相对含水量(RWC,%):
RWC=[(FW-DW)/(TW-DW)]×100% (1)
1.3.2 SPAD值、丙二醛含量与内源保护酶活性测定
HT、WL 、HT+WL和CK处理前一天与处理结束后第2天早上9:00,从各处理的每个重复中选取3盆长势一致的棉花,分别取其根、叶(真叶和子叶),测试分析上述指标。
真叶叶绿素含量,采用SPAD仪测定;不同部位的丙二醛(MDA)含量,硫代巴比妥酸比色法;不同部位的超氧化物歧化酶(SOD)活性,氮蓝四唑法;过氧化氢酶(CAT)活性,分光光度计法;过氧化物酶(POD)活性,愈创木酚法[18]。
1.4 数据统计及分析
利用 Microsoft Excel 2007软件进行试验数据的整理和图表制作,应用 SPSS 20.0对各处理间和处理前后数据进行方差分析。
2 结果与分析
2.1 苗期棉花特征
处理前植株生长状态一致。表1列出了对照(CK)、高温(HT)、渍水(WL)及高温和渍水(HT+WL)互作处理7 d后,棉花的株高和真叶相对含水量。从表1可知,HT处理、WL处理、HT+WL互作处理对棉花的地上部生长产生抑制效应导致植株生长缓慢且真叶相对含水量下降。具体表现为与CK相比,三种处理后株高分别降低0.91%、9.36%、11.36%,棉花真叶含水量分别降低20.46%、19.81%、24.95%。其中,HT+WL胁迫处理下株高降幅较HT处理高8.45%、较WL处理高2.0%。由此可知HT和WL对株高有显著交互作用,而影响棉花株高的首要因子是WL。
同列不同小写字母表示在0.05水平上差异显著
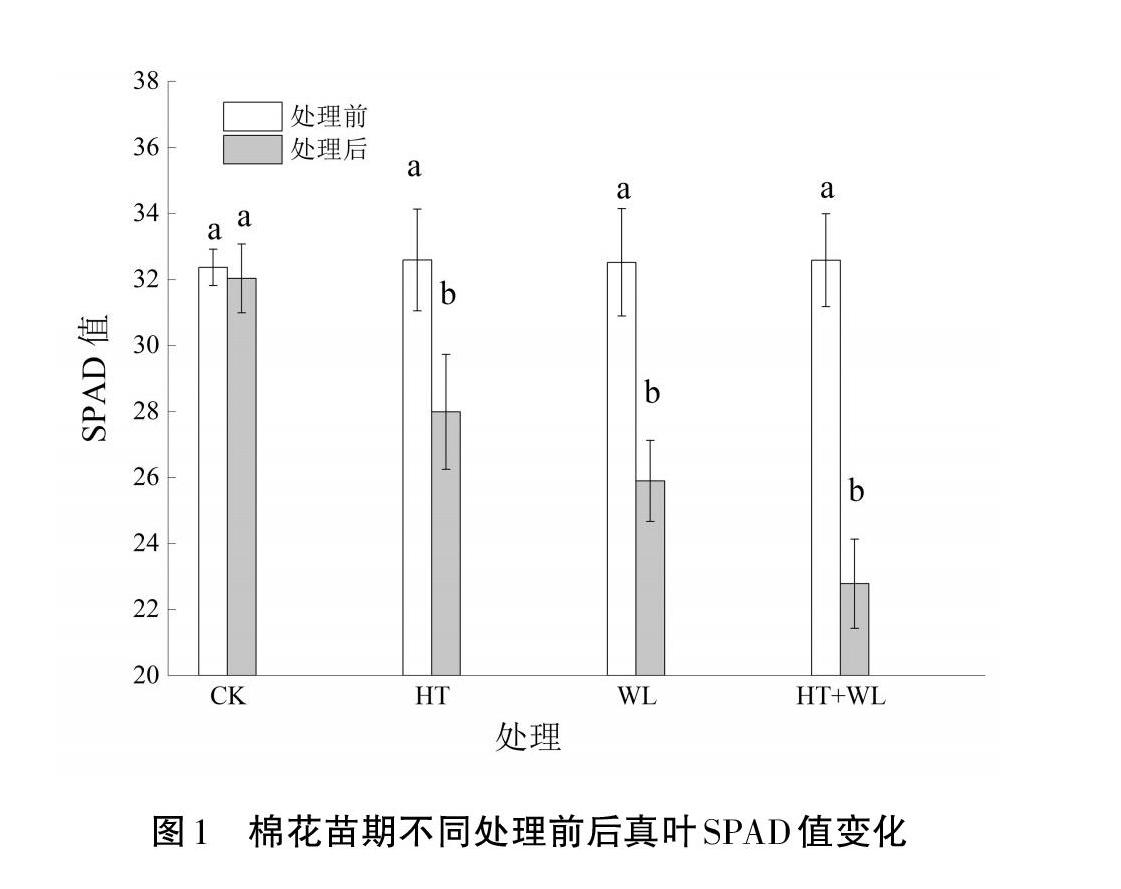
2.2 SPAD值(叶绿素含量)
从图1可以看出,与处理前相比,HT、WL和HT+WL胁迫处理7 d棉花幼苗后,SPAD值分别下降了14.38%、20.69%、30.63%,HT条件处理后的降幅最小,WL居中,HT+WL条件处理后的降幅最大。其中HT+WL互作处理降幅较HT处理高6.35%、较WL处理高9.94%,WL处理较HT处理降幅高6.31%。说明三种胁迫处理均会造成SPAD值下降,引起棉花真叶光合速率下降。而HT+WL双重胁迫加剧了SPAD值下降,单一HT或WL胁迫时,WL胁迫对SPAD值影响更大。
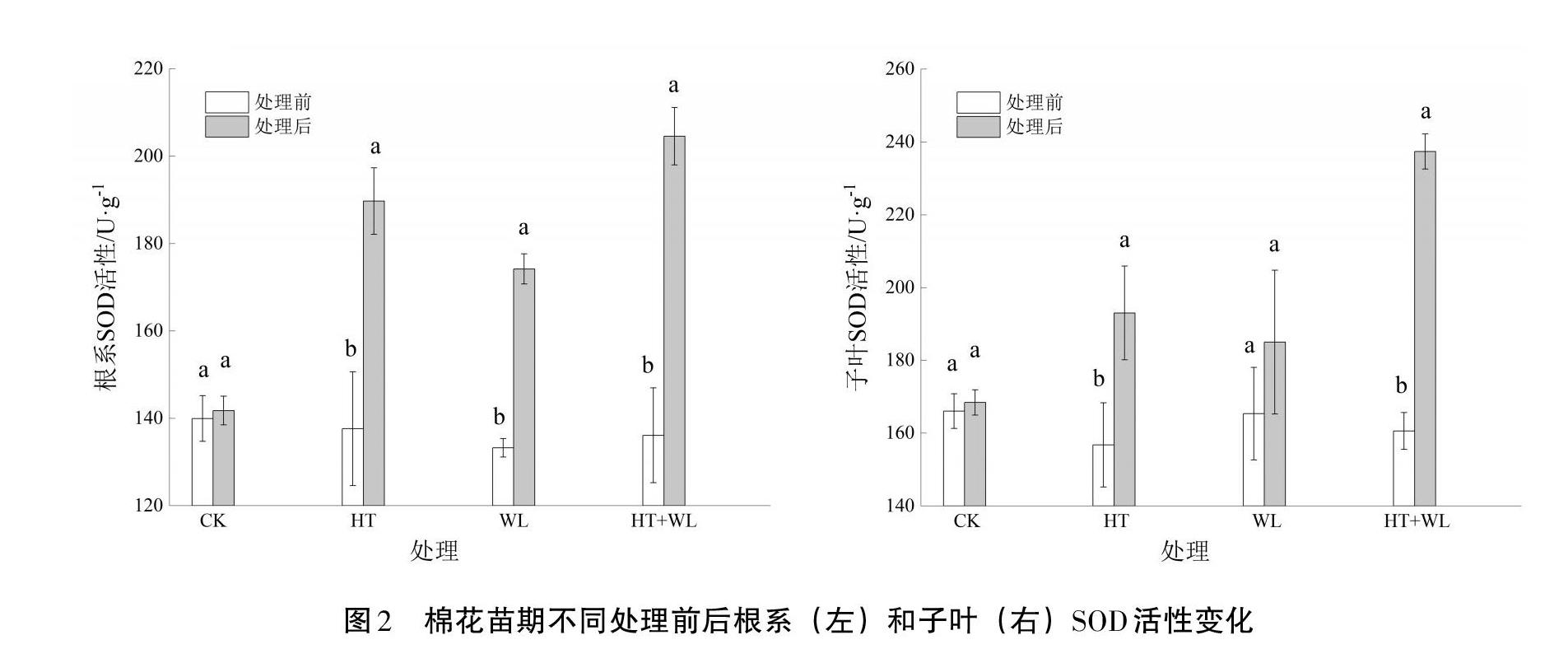
2.3 超氧化物歧化酶(SOD)活性
从图2可以看出,CK处理前后根和子叶SOD活性无明显波动,而在HT、WL及HT+WL的胁迫下,棉花各个部位的SOD活性呈显著增加,但在不同部位其活性增加的幅度有所不同。根SOD活性在HT、WL和HT+WL胁迫处理后较处理前分别增加了36.78%、28.89%和48.32%,HT+WL胁迫处理下根SOD活性增幅最大,HT胁迫处理居中,WL胁迫处理下根SOD增幅最小。单一胁迫7 d,HT处理比WL处理增幅高7.89%,可见HT胁迫比WL胁迫对根SOD活性的影响更大。棉花在遭受三种胁迫处理后与处理前相比,子叶SOD活性增加,但子叶SOD活性在HT、WL处理下变化较小;而HT+WL处理下子叶SOD活性大幅度增加,增幅高达45.71%。表明HT+WL互作对根SOD及子叶SOD活性的影响大于单一HT或WL处理。
2.4 过氧化氢酶(CAT)活性
从图3可以看出,四种处理的根CAT和子叶CAT活性在处理前基本一致,而经过处理后,CK较处理前的根CAT和子叶CAT活性增长不显著,而HT、WL和HT+WL处理的根和子叶CAT活性较处理前出现了明显增长。从图3左图看,HT、WL和HT+WL处理后的根CAT活性较处理前分别增长了14.8%、39.1%和63.3%;其中,HT+WL胁迫处理后的CAT活性增幅最高,较单一HT处理高48.5%,较单一WL处理高24.2%,其次是WL处理。从图3右图看,HT、WL、HT+WL处理后的子叶CAT活性分别较处理前增长了22.6%、76.3%、100.2%;其中,HT+WL条件下CAT活性增长了一倍,其次增长较快的是WL处理。在HT、WL和HT+WL胁迫下,CAT酶活性在不同部位增加幅度不同,子叶CAT活性增幅大于根CAT活性增幅,且单一WL处理影响高于单一HT处理,HT+WL双重胁迫对CAT活性提升具有叠加效应。
2.5 过氧化物酶(POD)活性
从图4左图可知,四种处理处置前的根POD活性基本一致,经过处理后,CK条件下处理后的棉花,根POD活性稍下降,而HT、WL、HT+WL处理的POD活性较处理前出现了一定程度的增长,增幅分别为13.47%、31.69%、56.67%;HT+WL处理后POD活性增长最高,增幅较HT处理高43.20%,较WL处理高14.98%。由图4右图可知,在CK、HT、WL和HT+WL条件下处理后的子叶POD活性较处理前分别增长了40.98%、36.23%、56.59%、88.16%,说明HT、WL和HT+WL这三种处理均会影响苗期棉花子叶的POD活性,而HT+WL胁迫的影响最明显。由此说明在HT、WL和HT+WL的胁迫下,棉花各个部位的POD酶活性都呈显著上升,在不同部位的POD酶活性增加幅度存在差异。而单一WL处理对POD活性的影响高于单一HT处理,HT+WL双重胁迫对POD活性增长具有叠加效应。
2.6 丙二醛(MDA)含量
從图5左图可知,根MDA含量在HT、WL和HT+WL处理后分别增加了56.83%、47.52%和85.75%,其中,根MDA的含量在HT+WL胁迫处理下增加幅度最大,HT胁迫处理居中,而WL胁迫处理下根MDA含量增加幅度最小,由此可知HT+WL胁迫处理对根MDA含量影响大于单一的HT或WL处理。由图5右图可知,四种处理前的子叶MDA含量基本一致,而经过处理后,MDA含量均较处理前呈现一定程度的增长,CK处理后变化不明显,HT、WL、HT+WL处理后MDA含量分别较处理前增长了153.74%、150.41%、165.71%。在HT、WL和HT+WL的胁迫条件下,棉花幼苗各个部位的MDA含量都呈显著增加,但在不同部位的MDA含量增加幅度不同,MDA的增幅在子叶中大于根。
3 讨论
3.1 高温与渍水对苗期棉花形态及光合特性的影响
当遭遇外界环境变化,从形态指标看,苗期棉花表现出较差的抗逆性。本研究发现对棉花的株高、根系和子叶中MDA含量及相对含水量,在HT、WL及HT+WL互作处理下均产生不同程度的抑制作用。WL抑制根的呼吸,以至于根部吸收运输养分的效率下降,植株生长受到抑制,而HT胁迫使叶片的气孔关闭,从而对光合作用的暗反应造成影响,有机物含量减少。此外,HT胁迫使植株水分吸收能力下降并因此受到一定程度的水分胁迫,此条件下叶片膜结构严重受损导致光合能力下降[19],同时植株含水量下降。当HT与WL同时发生时,株高和含水量的变化量不是单一HT或WL变化量之和,说明HT与WL处理存在互作效应。
叶片SPAD 值与叶绿素含量存在正比关系,是植物应对逆境胁迫的重要生理特征指标之一[20]。研究发现,HT、WL、HT+WL胁迫棉花幼苗7 d,SPAD值下降,且HT+WL双重胁迫加剧了SPAD值减少,单一HT或WL胁迫时,WL胁迫对SPAD值影响要大一些,说明三种胁迫下棉花幼苗叶片叶绿素含量减少。表明HT条件下,增温抑制了植株叶片的光合能力[21],叶绿素被氧化,抑制棉花叶片中的叶绿素合成,加速叶绿素分解[22-24],在WL胁迫下植物叶片气孔导度降低,CO2通路扩散受到阻碍[25],从而光合色素的量降低,导致叶绿素的含量直线下降。这与吴启侠等[26]的研究结果一致。因此,发生涝害影响后,可及时根据植株参数变化,做好相应补救措施,比如喷洒适量调节剂,施钾肥促进光合作用[27]。
3.2 高温与渍水对棉株抗氧化保护的影响
棉花在HT等逆境条件生长过程中,植株体内会堆积形成大量的活性氧(ROS),特别是超氧化物自由基(O2?)和过氧化氢(H2O2),使膜脂过氧化增加[28],并积累有害物质膜脂过氧化物丙二醛(MDA)[29],伤害膜体系,引起细胞功能失常[30]。植株的内源保护酶(SOD、CAT、POD)活性为应对积累的ROS而有所提高,从而减轻其对体内的毒害[31-32]。本研究结果表明,无论是HT、WL还是HT+WL互作处理,都会使棉花子叶和根部的MDA含量升高,这与前人的研究结果一致[33-34]。在此基础上,研究发现HT+WL互作处理对根部MDA具有明显的叠加效应,同时,子叶MDA含量增幅大于根,但双重胁迫与单一胁迫对MDA含量的影响程度相差无几。这些胁迫因子均会导致棉花幼苗细胞发生膜脂氧化损伤,且子叶细胞膜伤害程度比根严重,双重胁迫对根的影响更为直接。在本研究中,HT或WL处理棉花幼苗7 d后,棉花各部位SOD、CAT、POD活性较处理前升高,这是对棉花幼苗中H2O2和O2?积累的响应[11]。说明中棉所45苗期植株为适应逆境胁迫,能够进行生理适应性渗透调节——细胞主动积累调节物质[35],提高SOD、CAT、POD活性,以削减植物体内因HT或WL胁迫产生的自由基和活性氧,保护植物免受氧化损伤,同时利于棉花幼苗适应渍水、高温等非生物胁迫。
迄今为止,无论是传统育种还是分子育种方法,对棉花耐涝耐高温品种的选育仍在不断探索。有研究针对涝害胁迫对棉花植株带来的伤害常采用生长调节剂对作物进行营养调控和化学调控,使之对棉花产量的影响降至最低[27]。本试验可以进一步改善的是,应该在量化了HT、WL单一胁迫及双重胁迫对内源保护酶的影响后,进一步培养植株,对部分胁迫处理后的植株进行不同生长调节剂处理,观察后续产量是否与正常生长植株相去甚远,添加多少剂量提高最多。今后的研究应倾向于利用已知生理机制解决一些不可避免的多重胁迫带来的伤害,以及深入研究分子调控水平问题,以期为实际农业生产发展提供有益指导。
4 结论
本试验结果表明:1)HT、WL或HT+WL处理下苗期棉花株高较CK增速慢,真叶含水量较CK含量减少,叶片SPAD值较处理前显著降低。与CK相比,HT、WL和HT+WL处理下棉花株高分别低0.91%、9.36%、11.36%;棉花真叶含水量降低20.46%、19.81%、24.95%;叶片SPAD值较处理前分别下降14.38%、20.69%、30.63%。2)根和子叶的SOD、POD、CAT活性和MDA含量有所增加。在HT、WL和HT+WL胁迫处理后,根SOD活性较处理前分别增加了36.78%、28.89%和48.32%,而子葉SOD则分别增长了15.00%、9.84%和40.93%;根CAT活性较处理前分别增长了14.8%、39.1%和63.3%,子叶CAT活性分别增长了22.6%、76.3%、100.2%;根POD 较处理前分别增长了 13.47%、31.69%、56.67%,子叶POD活性分别增长了36.23%、56.59%、88.16%;根MDA含量较处理前分别增加了56.83%、47.52%、85.75%,子叶MDA含量较处理前分别增长了153.74%、150.41%、165.71%。3)综上,HT和WL双重胁迫对中棉所45棉花幼苗的内源保护酶活性变化有叠加效应。该结果可为棉花抗逆品种选育和大田雨热同期灾后幼苗栽培管理提供理论指导。
参考文献:
[1] 张杰,王力,赵新民.我国棉花产业的困境与出路[J].农业经济问题,2014,35(9):28-34,110.
[2] 郭进宇,臧学斌,周仙梅.雨涝灾害对棉花生长发育的影响及减灾措施[J].江西棉花,2011,33(5):48-49.
[3] 钱龙,王修贵,罗文兵,等.涝渍胁迫对棉花形态与产量的影响[J].农业机械学报,2015,46(10):136-143,166.
[4] Kuai Jie,Zhou Zhiguo,Wang Youhua. The effects of short-term waterlogging on the lint yield and yield componentsof cotton with respect to boll position[J]. European Journal of Agronomy,2015,67(3):29-36.
[5] Li T,Suk-Yoon K,Sun-Hyung K,et al. Enhanced tolerance of transgenic potato plants expressing both superoxide dismutase and ascorbate peroxidase in chloroplasts against oxidative stress and high temperature[J]. Plant Cell Reports,2007,19(3):227-239.
[6] Suzuki N,Koussevitzky S,Mittle R,et al. ROS and redox signalling in the response of plants to abiotic stress[J]. Plant,Cell and Environment,2012,35(2) :259-270.
[7] Wang Haimiao,Chen Yinglong,Hu Wei,et al. Short-term soil-waterlogging contributes to cotton cross tolerance to chronic elevated temperature by regulating ROS metabolism in the subtending leaf[J]. Plant Physiology and Biochemistry,2019,139:333-341.
[8] 刘凯文,苏荣瑞,朱建强,等.棉花苗期叶片关键生理指标对涝渍胁迫的响应[J].中国农业气象,2012,33(3):442-447.
[9] 张寄阳,刘祖贵,段爱旺,等.棉花对水分胁迫及复水的生理生态响应[J].棉花报,2006(6):398-399.
[10] 王晓曼,王琼珊,夏松波,等.高温胁迫下棉花苗期的生理响应和转录组分析[J].湖北农业科学,2019,58(S2):423-428.
[11] 武辉,张巨松,石俊毅,等.棉花幼苗对不同程度低温逆境的生理响应[J].西北植物学报,2013,33(1):74-82.
[12] 武辉.低温胁迫下棉花幼苗生理生化响应机制的研究[D].乌鲁木齐:新疆农业大学,2012.
[13] 冯棣,张俊鹏,孙池涛,等.不同生育阶段盐分胁迫对棉花生长和水分生理指标的影响[J].生态学杂志,2014,33(5):1195-1199.
[14] 张雷,张国伟,孟亚利,等.盐分条件下棉花相关生理特性的变化及水分胁迫指数模型的构建[J].中国农业科学,2013,46(18):3768-3775.
[15] 吴晓东,王巍,金路路,等.盐胁迫对棉花光合作用和生理指标的影响[J].中国棉花,2013,40(6):24-26.
[16] 苏仙绒,马沛勤,陈莉.铜、镉胁迫对棉花幼苗抗氧化生理指标的影响[J].运城学院学报,2014,32(2):66-69.
[17] 张晓红,胡根海,任晓亚,等.汞胁迫对棉花幼苗生理特性的影响[J].扬州大学学报(农业与生命科学版),2020,41(5):24-28.
[18] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[19] 孙啸震,张黎妮,戴艳娇,等.花铃期增温对棉花干物重累积的影响及其生理机制[J].作物学报,2012,38(4):683-690.
[20] 杨威,朱建强,吴启侠,等.花铃期短期渍水和高温对棉花叶片光合特性、膜脂过氧化代谢及产量的影响[J].棉花学报,2016,28(5):504-512.
[21] 贺新颖,周治国,戴艳娇,等.铃期增温对棉花产量、品质的影响及其生理机制[J].应用生态学报,2013,24(12):3501-3507.
[22] 云建英,杨甲定,赵哈林.干旱和高温对植物光合作用的影响机制研究进展[J].西北植物学报,2006(3):641-648.
[23] 田礼欣.涝渍胁迫对玉米农艺性状、生理特性及产量的影响[D].哈尔滨:东北农业大学,2019.
[24] 陈少裕.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯,1991(2):84-90.
[25] 艾天成,李方敏,周治安,等.作物叶片叶绿素含量与SPAD值相关性研究[J].湖北農学院学报,2000,20(1):6-8.
[26] 吴启侠,朱建强,杨威,等.花铃期高温受涝对棉花的交互效应及排水指标确定[J].农业工程学报,2015,31(13):98-104.
[27] 王曾桢.植物生长调节剂与营养调控减缓棉花涝后危害研究[D].荆州:长江大学,2014.
[28] Toai V,T. T.,Bolles,C. S. Postanoxic injury in soybean (Glycine max) seedlings[J]. Plant Physiology,1991,7:588-592.
[29] 李建英,周长军,杨柳,等.水分胁迫对大豆苗期叶片内源激素含量与保护酶活性的影响[J].大豆科学,2010,29(6):959-963..
[30] 王小菁.植物生理学(第8版)[M].北京:高等教育出版社,2019.
[31] 何学利.植物体内的保护酶系统[J].现代农业科技,2010(10):37-38.
[32] 莫红,翟兴礼.干旱胁迫对大豆苗期生理生化特性的影响[J].湖北农业科学,2007,46(1):45-48.
[33] 邓茳明,熊格生,袁小玲,等.棉花不同耐高温品系的SOD、POD、CAT活性和MDA含量差异及其对盛花期高温胁迫的响应[J].棉花学报,2010,22(3):242-247.
[34] 陈娟,梁明霞,潘开文.涝渍胁迫下生姜幼苗生长及体内保护酶活性变化[J].江苏农业科学,2015,43(5):152-155.
[35] 徐道青,郑曙峰,王维,等.棉花涝害胁迫研究综述[J].中国农学通报,2014,30(27):1-4.
(责任编辑:丁志祥)
