目标设置在不同肌肉强度的短期运动训练中对大脑运动皮层突触可塑性影响研究
2021-10-11彼末一之
戴 雯,金 晖,彼末一之
初级运动皮层(primary motor cortex,M1)在控制自主运动时起重要作用。成年哺乳动物的运动皮层表现出高度的运动相关可塑性(motor-practice-dependent plasticity,MPDP):随着运动技能的获得,M1神经元连接得到加强,体现出显著的结构重组特性(Sanes et al.,2000)。运动相关可塑性的神经机制以长时程增强(long-term potentia-tion,LTP)和长时程抑制(long-term depression,LTD)得到普遍共识。二者依赖于皮质内突触修饰的过程,受N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)介导,分别体现出突触传递的持续增强(LTP)或减弱(LTD),故称之为“突触可塑性”(Cooke et al.,2006)。LTP/D已被认为是形成记忆和学习的主要机制之一(Lynch,2004)。
最常见的运动相关突触可塑性出现在运动训练之后。运动训练可以易化运动皮质兴奋性,加强运动皮层区的神经元突触连接(Dai et al.,2016)。由于无法直接观察运动后人类皮层LTP/D的变化,因此,较普遍的方法是利用经颅磁刺激(transcranial magnetic stimulation,TMS)间接评估可塑性(Hallett,2000)。使用TMS刺激对侧M1并记录运动诱发电位(motor-evoked potential,MEP)反映皮质脊髓神经束兴奋性的变化,并通过对比运动训练前后MEP振幅变化来评价可塑性效果(Ziemann et al.,2008)。运动训练后MEP振幅的显著增长无论是在短期的简单运动干预,如几十分钟到几天的重复快速拇指内收 或 外 展 运 动(Belvisi et al.,2014;Rosenkranz et al.,2006),还是长期的复杂技能训练,如练习超过10年的音乐家或运动员中均有发现(Kumpulainen et al.,2015;Rosenkranz et al.,2007)。
运动训练后MEP振幅增加的原因不仅是由于突触可塑性,还可能涉及其他因素,如皮质神经元内部结构(轴突、树突和胞体)的功能性改变(Daoudal et al.,2003)、脊髓所募集的运动神经元个数以及运动神经元的放电率增长(Jones,2000)等。因此,研究者们通过非侵入性电生理技术诱导出更纯粹、不受上述其他因素所影响的突触兴奋样LTP/D效应(Nathan et al.,2011),由此更直观地观察LTP/D可塑性对运动皮质的影响。其中较为常见的非侵入性诱导手段为配对关联刺激[又称“成对关联刺激”(paired associative stimulation,PAS)]。PAS是指同侧外周神经刺激与对侧对应M1表征区TMS刺激的配对,主要用于诱发大脑感觉-运动皮质连接的突触可塑性(Elahi et al.,2012)。研究表明,PAS可以只改变M1中特定区域的突触效率(Stefan et al.,2000),而不改变神经元内部结构的功能(如神经元膜静息电位)或外周神经传导速率(Meunier et al.,2007),再加上与LTP/D有相似的特征,如受 NMDA 受体介导(Wolters et al.,2003)等,故称之为LTP/D样可塑性(LTP/D-like Plasticity)。PAS所诱发的具体效果取决于配对刺激到达对侧M1的时间次序(Stefan et al.,2000;Wolters et al.,2003)。当外周神经刺激先于TMS刺激25 ms施加时(PAS25),二者几乎同时到达对侧M1,此时MEP增加,皮质兴奋性易化,诱发LTP样效应;当外周神经刺激先于TMS刺激10 ms施加(PAS10),TMS刺激先于外周神经刺激到达对侧M1,此时MEP下降,皮质兴奋性抑制,诱发LTD样效应(胡艳等,2018)。
与运动训练相比,PAS在M1中诱发更纯粹的LTP/D样可塑性,因此,有研究将其与运动训练相比较,以探讨MPDP的突触机制(Muellbacher et al.,2002;Vallence et al.,2013)。研究表明,短时运动训练和PAS25具有类似的特征,如30 min的快速拇指外展运动和PAS25的可塑性可以被相同的神经递质拮抗剂阻隔(Elahi et al.,2013;Ste-fan et al.,2005;Ziemann et al.,2004)。然而,有研究对短时运动训练和PAS25的关系提出异议,短时运动训练后的MEP振幅变化趋势和PAS25之后的MEP振幅变化趋势无显著线性相关(Ilic et al.,2011),该结果说明二者的神经机制并非完全相同。
由此可见,运动训练与PAS干预后的突触可塑性之间所存在的关联还有待证明。一方面,影响PAS效果的因素比较单一。如PAS效果主要受配对刺激的间隔时间影响(Ilic et al.,2011;Stefan et al.,2002;Wolters et al.,2003),而性别、年龄(Tecchio et al.,2008)、上下肢(Stinear et al.,2005)、左右半脑(Ridding et al.,2006)、刺激时长(Wisch-newski et al.,2016)、刺激强度、频率(Wischnewski et al.,2016)等其他因素的影响不显著。另一方面,运动训练的效果受众多因素影响,如训练时长(Rosenkranz et al.,2007)、目标肌肉[手臂/指(Taylor et al.,1997)、上/下肢(Beck et al.,2007)、利手/非利手侧(Duque et al.,2007)]、强度(Samii et al.,1996)和年龄(Goodwill et al.,2015)等的差异都会对MPDP产生不一样的影响。鉴于运动训练的影响因素更为复杂,本研究在固定PAS干预方案的基础上,着重研究不同训练要求对MPDP的影响。研究拟选取肌肉激活量和对肌肉激活量的控制程度(设置具体的控制目标)作为主要任务要求。原因如下:1)这两个因素与目标肌肉直接相关,受个体自主控制,便于实验设计;2)这两个因素仅改变运动通路的突触效率或突触连接数量(Samii et al.,1996),而不改变通路特性,最大限度排除了运动脊髓通路传输过程中其他大脑功能区的参与(Smyth et al.,2010)。
本研究提出以下核心问题:1)对肌肉激活量的具体要求是否影响运动训练后突触可塑性的变化?2)何种要求的运动任务对MPDP的诱发效果更明显?研究假设:1)在训练时设置明确的目标并加大肌肉激活量能使运动皮质兴奋性最大化;2)目标设置和高肌肉激活量的协同效应对诱发LTP样MPDP起主要作用,所诱发的可塑性与PAS诱导的LTP样突触可塑性最相似。
1 研究对象与方法
1.1 被试
选取16名健康成人被试,其中女性6名,平均年龄为(25.5±1.72)岁。被试均为普通高校本科生和研究生,没有进行过专业、系统的体育项目训练。所有被试均为右利手[通过改编版爱丁堡利手问卷评定(Oldfield,1971)],矫正视力和BMI指数均在正常范围。被试在实验前或实验中未服用过任何神经性药物,无任何不适用于本研究仪器的精神或神经方面病史,如癫痫(Rossi et al.,2009)等。研究通过伦理委员会审核,被试在实验前签署知情同意书,并有权随时中止实验。
1.2 实验仪器
TMS刺激选用两侧直径为9 cm的8字形线圈连接Magstim 200刺激器。将线圈放置在左侧初级运动皮层,设置电流为后-前方向并垂直于中央沟。线圈与中矢线呈30°~45°角,用于激发右侧目标肌肉[拇短展肌(abduc-tor pollicis brevis,APB)]的MEP(Kaneko et al.,1996)。线圈摆放在同一强度所产生最大运动电位的区域,在该区域用专用笔进行标记并作为运动热点。
外周神经刺激选用恒定直流电刺激器(日本光电,型号SS-104J)。通过Ag-AgCl表面电极(负极设置在身体近端)刺激右手手腕的正中神经。电刺激波设定为方波,脉冲宽度200 μs(Stefan et al.,2000;Wolters et al.,2003)。
运动诱发电位使用直径7 mm的Ag-AgCl表面电极采集。实验时将探测电极放置在APB肌腹处,参考电极放置在APB远心端处,接地电极放置在右手腕关节处。数据通过神经放电信号采集器(英国CED,型号Micor1401)采集,采集到的信号使用电生理信号采集调节放大器(日本光电,型号MEB-2216)进行过滤(带通滤波5~3 000 Hz)并放大1 000倍;过滤放大后的信号以6 000 Hz的频率数字化记录,使用Spike 8.0软件进行线下分析。
1.3 实验流程
实验于09:00—18:00在屏蔽信号的实验室中进行。被试坐在有舒服靠背的皮质座椅上,右前臂自然垂放,右手以舒适的姿势置于座椅扶手上。
实验前先确定每位被试APB肌肉当次的基线TMS强度、基线MEP振幅、最大自主等长收缩(maximal voluntary contraction,MVC)、静息阈值(rest motor threshold,RMT)和运动阈值(active motor threshold,AMT)。基线TMS强度和基线MEP振幅分别指在目标肌肉静息状态下,连续10次刺激使运动诱发电位在0.5~1.0 mV的最小磁刺激强度和具体振幅值(Sale et al.,2017)。MVC测定要求被试以最大力进行APB肌肉的等长收缩3次,每次持续至少3 s,并在3次中取最大力的1次(Kouchtir-Devanne et al.,2011)。RMT指目标肌肉在静息状态下,连续10次刺激中有至少5次诱发出>50 μV MEP的最小磁刺激强度;AMT指目标肌肉进行10%最大肌力收缩的前提下,连续10次刺激中有至少5次诱发出100~200 μV MEP的最小磁刺激强度(戴雯等,2017)。
实验采用6(干预手段)×10(测量时间点)前-后测被试内设计。共采用6种干预手段,其中PAS 2种,运动任务4种。在干预前以及干预后的0、5、10、15、20、25、30、45和60 min(T0,T5,…60)时分别以基线TMS强度测试MEP(图1)。研究发现,非侵入式电生理刺激对大脑运动皮层的影响可持续60~120 min,其中前30 min的效果最为明显(Rosenkranz et al.,2006;Wischnewski et al.,2016)。因此,考虑到根据每次测量所需时间(约2.5 min)以及被试的休息时长,在效果最明显的干预后30 min内每5 min测量1次,旨在探讨短期运动训练后大脑皮质脊髓兴奋性的动态时间变化。此外,在干预后第45和第60 min再次进行测量,以探讨运动训练对大脑皮质脊髓兴奋性影响的持续时间。
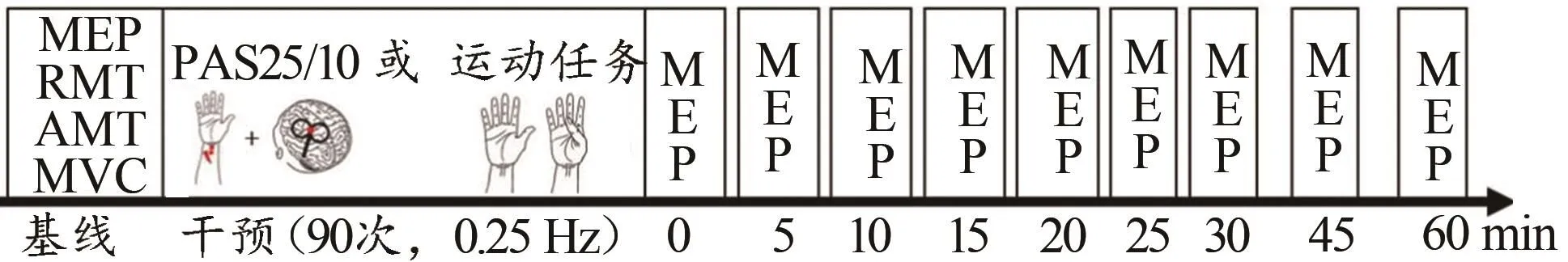
图1 实验设计示意图Figure 1. Diagrammatic Sketch of Experimental Protocol
1.3.1 PAS干预
PAS干预共2种,分别在进行外周神经刺激的10 ms(PAS10)和25 ms(PAS25)后对左侧M1中的APB区域施加TMS刺激。电刺激(外周神经刺激)强度为300%感觉阈限,即每位被试能主观感受到的最低刺激强度的300%;磁刺激强度为基线TMS强度(Stefan et al.,2000)。PAS10和PAS25均以0.25 Hz的频率干预90个配对(即每次干预7.5 min)。
1.3.2 运动任务
运动任务参考前人研究(Muellbacher et al.,2002;Rosenkranz et al.,2007;Vallence et al.,2013;Ziemann et al.,2008),并结合PAS干预的相关参数,要求被试以0.25 Hz的频率进行快速拇指内收90次。被试需要在听到节拍器提示音后以最快的速度做拇指内收运动,并回复自然状态,等待下一个提示音。
1.3.2.1 无目标的舒适力度任务(comfortable task,TC)
该任务仅要求被试在听到提示音后以最快的速度和最舒适的力度完成每次拇指内收。在该任务中,研究者对被试所选用的力度不做具体要求,最舒适的力度大小由被试自己设定。
1.3.2.2 无目标的高力度任务(strong task,TS)
该任务要求被试在听到提示音后以最快的速度和较强的力度完成每次拇指内收。为了保障高力度任务的质量,即避免被试力度过高产生疲劳效应或力度过低无法与TC的力度相区分,正式实验前会进行小于15 s不限频率的练习。如果被试在练习中的EMG峰值小于70%MVC,主试将进行口头鼓励以加大力度直到被试使用大于70%MVC的力度完成拇指内收。练习后会进行不小于5 min的休息以消除练习和疲劳效应。正式实验要求被试使用之前练习时所用力度进行拇指内收,但无论力度如何,主试都不会进行口头干预。
1.3.2.3 设置目标的舒适力度任务(comfortable and control task,TCC)
TCC要求被试在听到提示音后以最快的速度完成每次拇指内收,并要求被试每次使用的力度要尽可能准确到达目标力度之内。目标力度根据每一位被试TC的行为设定,即每位被试90次TC的EMG峰值平均值±标准差(MTC±SDTC)。目标力度设置为被试自己设置的最舒适力度,以此保证被试在该任务中能有意识地控制肌肉力度在舒适范围内。
1.3.2.4 设置目标的高力度任务(strong and control task,TSC)
TSC与TCC大致相同。TSC的目标力度根据每一位被试TS的行为设定,即每位被试90次TS的EMG峰值的平均值±标准差(MTS±SDTS)。该目标范围为被试自己设置的高力度范围。
6种干预分6天完成,每天只进行一种干预。干预手段顺序局部随机,在消除干预间的顺序效应的同时,TC和TS总是会先于TCC和TSC进行,以获取每位被试的目标力度。每两次干预间隔至少2周,以消除干预的交互效应。为了保持注意力和视觉输入状态的统一,研究要求被试在每一次干预中均专注于拇指,并在干预期间持续关注实时显示肌电活动(electromyograms,EMG)的计算机屏幕(Stefan et al.,2004)。在TCC和TSC中,还额外要求被试根据计算机屏幕上所显示的目标力度范围和当次EMG表现,在随后的试次中调整肌肉力度以更好地完成运动,以此来保证目标设置的质量。
1.4 数据分析与统计检验
数据以平均值±标准误(M±SE)表示。
1.4.1 行为数据
主要记录4种运动干预期间的肌肉激活量、单次内收运动的持续时间以及TCC和TSC的准确率。
1.4.1.1 肌肉激活量
肌肉活动量通过每个干预下90个运动试次的平均EMG峰值评价,并根据每位被试当次MVC值进行标准化处理[肌肉激活量=(每次EMG峰值/当次MVC)×100%]。
1.4.1.2 持续时间
通过计算每个干预下90个运动试次的持续时间的平均值,评价被试每次运动的速度变化。持续时间是指被试单个运动试次从收缩到放松的持续时间。以每次任务的第1个提示音开始前1 s作为背景肌电值,计算该秒EMG活动量的标准差。持续时间的开始和结束时间点定义为EMG值逐渐增大和减小至刚好到达1个标准差的时间点。
1.4.1.3 准确率
准确率主要用于评估被试在实际完成控制任务时的表现情况。准确率=(EMG峰值进入目标范围的次数/90)×100%,其中90为被试进行肌肉活动的总次数。准确率越高,表示被试完成任务的实际情况越好,即处于目标强度以内的次数越多。
使用单因素重复测量方差分析(one-way repeatedmeasures ANOVA,rm-ANOVA)检验4种运动干预的肌肉活动量和持续时间的差异,使用Greenhouse-Geisser校正不满足球形检验的情况,并在差异显著时进行Bonferroni校正的事后检验。配对样本t检验用于检验TCC和TSC的准确率差异。每次运动的最初20试次和最后20试次的肌肉激活量、持续时间和准确率差异同样使用配对样本t检验,以评估被试的疲劳效应和学习效应。
1.4.2 电生理数据(MEP和MT)
干预后每个测量时间点(0、5、10…60 min)的MEP振幅根据干预前的基线MEP振幅进行标准化处理[MEP振幅=(每次MEP振幅/当次基线MEP振幅)×100%],以评估干预手段对运动皮层兴奋性的总体影响。
使用单因素rm-ANOVA分别检验基线MVC、TMS强度、MEP振幅、RMT和AMT在不同干预手段之间的差异。单因素rm-ANOVA同样用于检验RMT和AMT在干预前后的差异。使用Greenhouse-Geisser校正不满足球形检验的情况,并在差异显著时进行Bonferroni校正的事后检验。
6(干预手段:PAS25、PAS10、TC、TS、TCC和TSC)×10(测量时间点:基线、0、5…60 min)双因素 rm-ANOVA用于检验MEP在时间进程上的动态变化。与单因素rm-ANOVA相同,使用Greenhouse-Geisser校正不满足球形检验的情况。在交互作用显著的情况下,使用单因素rm-ANOVA检验测量时间点的单独效应,并对显著因素进行Bonferroni校正的事后检验。
使用线性回归分别检验2种PAS干预与4种运动任务在干预后每个时间点的拟合度评估大脑运动皮层兴奋性在干预后的相似程度。所有线性回归均以PAS后的MEP振幅为自变量,以运动训练后的MEP振幅为因变量。
使用线性回归分别检验TCC和TSC中16名被试的准确率与最大MEP振幅变化之间的关系,以此探讨行为绩效是否会影响MEP振幅的变化。线性回归以每位被试的准确率为自变量,以每位被试的最大MEP振幅(即MEP振幅到达峰值的时间点的振幅值)为因变量。最大MEP振幅代表了该被试在特定干预下的最大运动脊髓兴奋性易化能力(López-Alonso et al.,2015)。选取最大 MEP振幅作为因变量的理由如下:1)本研究假设设置目标的运动任务会易化运动皮质兴奋性,产生LTP样效应,因此选取最大MEP振幅值;2)McDonnell等(2006)研究表明,运动干预后并非所有时间点的MEP振幅都会出现易化,可能会在个别时间点出现运动皮层兴奋性的抑制。因此,直接计算被试9个时间点的MEP振幅平均值可能会将抑制和易化效应相互抵消,掩盖结果;3)Wischnewski等(2016)的研究指出,每位被试的最大MEP振幅出现的时间点并不相同,不建议在所有被试中选取同一时间点进行计算,容易掩盖个体差异。因此,本研究没有在所有被试中选取同一时间点的MEP振幅,而是根据被试的在运动干预后运动皮层的实际易化情况选取最大MEP振幅。
数据的检验统计通过SPSS 17.0(IBM,Armonk,NY)完成,置信空间设为P<0.05。
2 研究结果
不同方案的所有基线数值均无显著差异[MVC:F(1.94,29.23)=0.65,P=0.587,η2=0.042;基线 TMS 强度:F(5,75)=1.07,P=0.376,η2=0.071;基线 MEP 振幅 :F(5,75)=1.68,P=0.151,η2=0.100;RMT:F(5,75)=0.38,P=0.864,η2=0.024;AMT:F(5,75)=2.29,P=0.054,η2=0.132;表1]。说明了不同方案的行为和可塑性变化情况不受基线值高低影响。

表1 6种干预手段的基线值Table 1 The Baseline of Six Interventions
2.1 行为数据
4种运动干预的肌肉激活量和持续时间差异显著[肌肉激活量:F(1.55,23.30)=19.67,P<0.001,η2=0.567,图 2A;持续时间:F(1.63,24.44)=16.14,P<0.001,η2=0.518,图 2B]。经检验发现,TC和TCC的肌肉激活量和持续时间均显著低于TS和TSC(肌肉激活量:TC-TS,P=0.004;TC-TSC,P=0.003;TCC-TS,P=0.001;TCC-TSC,P=0.001。持续时间:TC-TS,P<0.001;TC-TSC,P=0.003;TCC-TS,P=0.004;TCC-TSC,P=0.036),但TC和TCC,以及TS和TSC之间的肌肉激活量和持续时间无显著差异(P>0.05)。该结果排除了TC和TCC,以及TS和TSC之间可塑性的变化受行为影响的同时,保证了TC和TCC,以及TS和TSC之间的区别主要在于设定目标范围后对肌肉活动量的控制。此外,TCC的准确率显著高于TSC(t=3.94,df=15,P=0.001,图2C),表明TSC的难度要显著大于TCC。

图2 运动干预的肌肉激活量、单次运动持续时间和准确率Figure 2. The Level of Muscle Activity,Duration and Accuracy for Motor Tasks
研究还对比了4种运动干预的最初20和最后20个试次的行为数据,以评价干预期间的变化。4种运动干预的肌肉激活量均不随运动次数而改变(TC:t=1.50,df=15,P=0.155;TS:t=0.96,df=15,P=0.352;TCC:t=0.50,df=15,P=0.627;TSC:t=0.13,df=15,P=0.898;图3A),表明被试全程以稳定的肌肉活动量完成任务。除TS外,其他3种运动干预的持续时间同样不随运动次数而改变(TC:t=0.21,df=15,P=0.804;TS:t=-3.75,df=15,P=0.002;TCC:t=-0.92,df=15,P=0.37;TSC:t=-1.90,df=15,P=0.077;图3B),表明被试全程以稳定的速度完成除TS外的所有任务。激活量和速度的稳定还表明,除TS外,其他3种运动均没有出现疲劳效应。此外,TCC和TSC的准确率也没有随练习而改善(TCC:t=-3.70,df=15,P=0.771;TSC:t=-1.57,df=15,P=0.138;图3C),表明被试没有体现出行为上的学习效应。

图3 运动干预前后20试次的肌肉激活量、单次运动持续时间和准确率Figure 3. The Level of Muscle Activity,Duration and Accuracy of the First 20 and the Last 20 Trials for Motor Tasks
2.2 MEP数据
突触可塑性的变化根据干预手段以及时间进程呈现不一样的变化。由于干预手段和测量时间点之间的交互作用显著[F(5,675)=3.22,P<0.001,η2=0.177],进一步分析了不同干预下的时间变化(图4)。除TS外,其他干预手段均发现显著的时间效应[PAS25:F(3.71,55.67)=3.97,P=0.008,η2=0.209;PAS10:F(9,135)=2.11,P=0.033,η2=0.123;TC:F(9,135)=2.98,P=0.003,η2=0.166;TS:F(7,105)=1.21,P=0.306,η2=0.177;TCC:F(2.61,39.15)=4.00,P=0.018,η2=0.211;TSC:F(4.42,66.24)=2.82,P=0.027,η2=0.158]。表明除 TS 外,其他干预手段均反映出了干预后突触可塑性的变化。这可能与被试在进行TS时为了保持稳定的肌肉激活量而出现的速度显著下降(持续时间上升)有关。
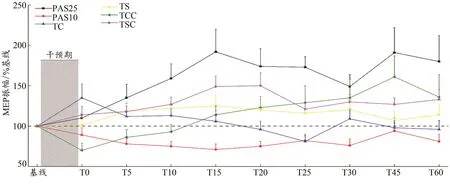
图4 MEP振幅总体变化Figure 4. Effects of Interventions on MEP Amplitude
本研究分析了9个干预后时间点中PAS和运动干预的MEP振幅变化的关系。PAS25与TC呈显著负相关[F(1,7)=8.05,r=-0.77,P=0.015,图 5],与 TCC 和 TSC 呈显著正相关[TCC:F(1,7)=10.75,r=0.78,P=0.014;TSC:F(1,7)=8.05,r=0.73,P=0.025,图 5];PAS10与所有运动干预均没有显著相关。该结果表明,运动干预后所引起的MPDP变化仅与LTP样效应相关,与LTD样效应关系不显著。该结果表明,设置明确目标的任务所诱发的MPDP变化与PAS25诱导的LTP样效应更相似,说明了对肌肉有意识地控制在诱发运动皮层LTP样可塑性中所起的重要作用。
研究分析了两个设置目标任务的实际操作绩效与最大MEP振幅之间的关系。无论是在TCC还是TSC中,16名被试的准确率与最大MEP振幅之间均没有显著相关[TCC:F(1,14)=0.28,r=0.14,P=0.605;TSC:F(1,14)=2.98,r=0.42,P=0.106]。该结果表明,被试完成任务的实际情况对运动干预后MEP振幅的变化影响不显著。
3 讨论
研究将“肌肉激活程度”和“控制肌肉激活的具体目标”这两个与肌肉激活相关的要素相结合,旨在短期运动任务中探究“不同运动要求是否影响MPDP变化”这一核心科学问题。
研究发现,设置了明确目标的运动干预后所产生的运动皮层兴奋性变化与PAS诱发的LTP样可塑性在时间进程上呈现显著正相关;在有目标范围的前提下加大肌肉激活量,运动皮层兴奋性可以长时间处于易化状态,并在干预15~20 min后达到顶峰。研究证明了高肌肉激活量和目标设置在MPDP中具有协同作用。
3.1 PAS与运动干预后的突触可塑性
MEP反映了皮质脊髓通路的兴奋性(张剑等,2009)。MEP振幅的变化不仅涉及对侧M1的激活,也涉及中枢神经系统通过外周神经系统向肌肉传导的过程(张剑等,2009)。为了探究运动训练后M1的激活情况,本研究对比了PAS和运动干预后MEP振幅在60 min内的变化情况。前人研究(Cooke et al.,2006;Meunier et al.,2007;Ste-fan et al.,2000)发现,PAS后MEP振幅的变化属于LTP/D样可塑性,主要与M1的皮质-皮质突触变化有关,不受外周神经系统影响。因此,如果运动训练和PAS干预后的MEP变化进程相似,则有理由认为运动干预后所诱发的MEP振幅变化与M1皮质神经元突触的连接相关,属于或近似于LTP样可塑性。由于本研究所设计的4种运动干预后60 min内的MEP振幅变化均呈现不同程度的增长趋势,且时间进程与LTD无显著相关,故本研究认为,训练后的突触可塑性主要产生LTP样效应。因此,下文主要讨论运动干预和LTP样可塑性(即PAS25)之间的关系。
3.1.1 无目标任务难以诱发LTP样突触可塑性
研究发现,无论肌肉激活量高低,无目标运动任务均难以诱发LTP样突触可塑性。一方面,TC的MEP振幅变化在时间进程上与PAS25诱发的LTP样可塑性变化呈显著负相关,说明舒适力度的无目标运动任务所诱发的M1兴奋性和LTP样可塑性存在差异。另一方面,在4个运动任务中,仅TS干预后的MEP振幅无显著时间变化(图4)。这表明在本研究中,TS干预无法易化M1兴奋性。M1在TS干预后无显著激活可能是TS的MEP振幅变化在时间进程上与PAS25无相关(图5)的主要原因之一。研究认为,该结果和TS在运动后期(最后20个运动试次)每次运动所花费的时间显著增加有关(图3B)。被试在运动后期需要花费更长的时间以保持与前期相同的肌肉激活量,表明在高肌肉强度的运动中不设置具体目标对行为绩效的稳定有较大影响,同时不利于M1的激活。

图5 PAS和运动干预后MEP振幅变化关系Figure 5. Correlation between PAS and Motor Tasks
3.1.2 设置具体目标可有效诱发LTP样可塑性
本研究发现,设置目标的运动干预(TCC和TSC)的MEP振幅变化在时间进程上与PAS25诱导的类LTP效应相似。鉴于该任务为短期任务(仅7.5 min),所以可以认为TCC和TSC的MEP振幅变化与M1中突触连接数量的增加无关(Rosenkranz et al.,2007),而主要与M1中突触效率的增加有关(Kelly et al.,2004)。M1是运动图式中最重要的成分之一,其参与运动参数的整合,并在运动准备和执行阶段连接大脑其他区域从而形成运动-感知网络(李捷 等,1993;May,2011)。换言之,M1突触效率的增加可以在短时间内帮助人们更好地输出运动技能,对运动员赛前热身时有效调动大脑活性有重要意义。
3.2 运动干预后可塑性的动态时间变化
本研究发现,TC和TCC在干预后出现了不同程度地抑制趋势,且抑制趋势出现时间不一。其中,TCC的MEP振幅变化在干预后0~10 min内呈下降趋势,并在10 min后逐渐上升(图4),该结果与McDonnell等(2006)的研究结果相似,短时间(15 min)低强度的精准手部运动(钉板测验)训练使手部MEP振幅在短时间内出现显著抑制,并在10 min后恢复。McDonnell等(2006)认为,这种抑制是与注意力的增加以及动作的精细程度有关,但本研究在难度更大的TSC中却没有发现这种现象。因此,研究猜测这种变化可能只适用于轻度或中度肌肉激活量。相反,TC的MEP振幅却在运动干预后即刻出现大幅增加(TC的T0处MEP振幅,图4),之后逐渐下降,并在25 min时出现抑制,随后基本与基线持平。这种反常的变化体现出TC与其他任务对运动皮质兴奋性的影响不同,可能存在机制上的差异。鉴于当前实验技术和该实验设计的局限,该现象需要进一步研究。
本研究还发现,与低肌肉激活量的TC和TCC不同,高肌肉激活量的TS和TSC的MEP振幅始终处于增长状态,并在15~25 min时到达峰值。该结果与前人以及本研究体现出的PAS25特性相似(Sale et al.,2013)。这说明了高肌肉激活量对运动脊髓兴奋性的作用:大脑在接收到较强外部刺激后的15~25 min内处于皮质兴奋性的“黄金阶段”,该阶段的大脑运动皮质兴奋性最优。但由于TS的MEP振幅无显著时间效应,研究者认为,只有当高肌肉激活量与目标设置同时存在时,其“黄金阶段”的效果最突出。
尽管本研究无法进一步解释不同任务要求对MEP振幅变化的时间进程影响不一,但建议未来的研究和运用应把握M1诱发运动皮质兴奋性的“黄金阶段”,根据不同肌肉激活程度选择不同的时间点以实现干预后MEP振幅的最大化。
4 结论与建议
本研究表明:1)不同的任务要求对皮质脊髓兴奋性的影响呈现不同时间趋势;2)目标设置对诱发LTP样可塑性起积极作用。由于低肌肉激活量的运动后出现一定时间段的皮层抑制趋势,因此,建议在设置目标时选取高肌肉激活量的运动以促进皮质脊髓兴奋性,进而诱发MPDP,但同时也要注意避免出现疲劳效应(Kumpulainen et al.,2015)。高肌肉激活量的运动在干预后的15~25 min呈现M1诱发运动皮质兴奋性的“黄金阶段”,与大脑非侵入性刺激(PAS25)的特性相似。运动任务要求的细化以及M1“黄金阶段”的选取对短时间运动诱发大脑运动皮层兴奋性有一定指导作用。
