槲皮素联合顺铂调控PI3K/Akt信号通路对肺癌A549/DDP细胞增殖与凋亡的影响
2021-10-10赵纯管养洪刘艳张杰
赵纯 管养洪 刘艳 张杰
肺癌是原发于气管、支气管和肺的恶性肿瘤,发病率、死亡率高,被称为“癌症头号杀手”[1],患者中大约85%为非小细胞肺癌[2]。肺癌治疗方法有肺移植、化疗、放疗等,化疗是主要手段,但化疗药物容易产生耐药性且毒副作用大,严重影响治疗效果和患者的生存率[3]。槲皮素是一种多酚羟基化合物,具有较好的祛痰、止咳作用,并且还有一定的平喘作用。相关研究表明槲皮素具有抗癌、抗氧化、抗病毒、保护心血管、免疫调节等多种药理学活性[4,5]。顺铂是临床上非小细胞肺癌治疗的标准化疗药物,其抗癌的主要作用是造成DNA 损伤诱导癌细胞凋亡[6]。本次实验观察槲皮素联合顺铂作用对肺癌A549/DDP 细胞增殖、凋亡及磷脂酰肌醇-3-激酶(phasphatidy inositol-3 kinase,PI3K)/丝氨酸-苏氨酸蛋白激酶(serine-threonine protein kinase,Akt)信号通路的影响,研究槲皮素与顺铂的协同作用,探讨其作用机制,为临床治疗非小细胞肺癌提供新的实验基础。
1 材料与方法
1.1 一般材料 本次实验时间为2020 年3 月至2020 年10 月,采用人肺腺癌耐顺铂细胞株A549/DDP(由湖南丰晖生物科技有限公司生产)进行实验研究,并选用槲皮素(由上海源叶生物科技有限公司生产)、顺铂(由上海脉铂医药科技有限公司生产)、CCK-8 检测试剂盒、JC-1 检测试剂盒(由上海碧云天生物公司生产)、凋亡检测试剂盒(由上海翊圣生物公司生产)、PI3K、Akt(由武汉三鹰生物技术有限公司生产)等材料。
1.2 方法
1.2.1 细胞分组处理 实验分为槲皮素+顺铂组(槲皮素浓度160 μmol/L,顺铂浓度25 μmol/L)、顺铂组(浓度为25 μmol/L)、槲皮素组(浓度为160 μmol/L)和对照组(药物浓度为0);其中各组二甲基亚矾(dimethyl sulfoxide,DMSO)浓度均控制在0.1%。
1.2.2 CCK-8 法检测细胞增殖抑制率 将不同浓度的槲皮素、顺铂单独及联合加入各孔,每个浓度梯度设4 个平行孔及药物空白孔(去除药物溶液自身颜色对测定的影响),并设添加0.1% DMSO完全培养基的对照组,等待48 h 后每孔加入20 μl CCK-8,细胞培养箱(由山东博科生物有限公司生产)内孵育2 h 后,于酶标仪(由上海聚慕医疗器械有限公司生产)450 nm 处测定吸光度值。计算各组细胞增殖抑制率。
1.2.3 Annexin V/PI 双染色流式细胞仪检测细胞凋亡率 实验分为槲皮素+顺铂组(0.1% DMSO、IC50槲皮素及IC50顺铂)、顺铂组(0.1% DMSO 及IC50顺铂)、槲皮素组(0.1% DMSO 及IC50槲皮素)、对照组(0.1% DMSO,药物浓度为0)。药物作用于细胞48 h 后,采集各组细胞,按照Annexin V-FITC 试剂盒(由上海翊圣生物公司生产)说明书进行操作步骤。计算各组细胞调亡率。
1.2.4 Western blot 检测蛋白的表达 细胞种板及药物分组与流式细胞仪检测凋亡率相同,药物作用48 h 后,按总蛋白提取试剂盒说明书提取各组总蛋白,用Bradford 法蛋白定量,经分离后,转膜,封闭,添加对应一抗,随后二抗孵育,TBST 洗涤,ECL 发光液加于PVDF 膜上,X 线胶片曝光,经显影、定影、扫描后观察结果。对扫描图像的目的条带进行灰度分析,目的条带与β-actin 的灰度比值即为目的蛋白的相对表达量。
1.3 统计学方法 采用SPSS 23.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。计量资料比较采用F检验和t检验;计数资料比较采用χ2检验。设P<0.05 为差异有统计学意义。
2 结果
2.1 各组的细胞增殖抑制率和细胞凋亡率比较见表1
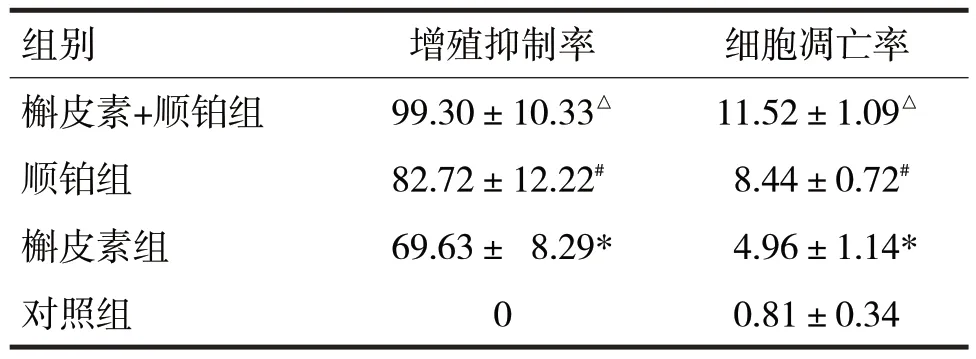
表1 各组的细胞增殖抑制率和细胞凋亡率比较/%
由表1可见,各组A549/DDP 细胞的细胞增殖抑制率和细胞凋亡率比较,差异均有统计学意义(F分别=12.26、163.10,P均<0.05)。槲皮素组的细胞增殖抑制率和细胞凋亡率高于对照组(t分别=20.58、8.54,P均<0.05);顺铂组的细胞增殖抑制率和细胞凋亡率高于槲皮素组(t分别=2.17、6.32,P均<0.05);槲皮素+顺铂组的细胞增殖抑制率和细胞凋亡率高于顺铂组(t分别=2.54、5.78,P均<0.05)。
2.2 p-PI3K、p-Akt蛋白的表达见表2
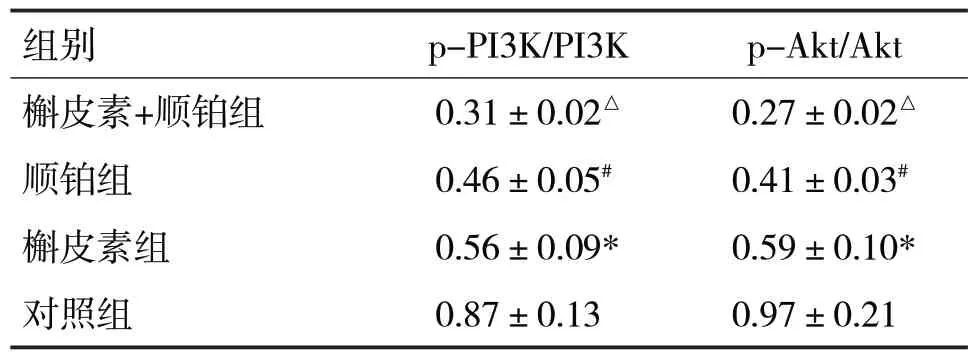
表2 各组的p-PI3K、p-Akt蛋白的表达比较
由表2可见,各组A549/DDP细胞p-PI3K/PI3K、p-Akt/Akt 蛋白表达水平比较,差异均有统计学意义(F分别=47.88、41.30,P均<0.05)。槲皮素组的p-PI3K/PI3K、p-Akt/Akt 蛋白表达水平低于对照组,差异均有统计学意义(t分别=4.77、4.09,P均<0.05);顺铂组的p-PI3K/PI3K、p-Akt/Akt 蛋白表达水平低于槲皮素组,差异均有统计学意义(t分别=2.38、4.34,P均<0.05);槲皮素联合顺铂组的p-PI3K/PI3K、p-Akt/Akt 蛋白表达水平低于顺铂组,差异均有统计学意义(t分别=7.05、10.28,P均<0.05)。
2.3 p-PI3K、p-Akt蛋白的表达结果见图1
由图1 可见,与对照组比较,槲皮素组p-PI3K、p-Akt 蛋白表达下降;与槲皮素组比较,顺铂组的p-PI3K、p-Akt 蛋白表达下降;与顺铂组比较,槲皮素+顺铂组p-PI3K、p-Akt蛋白表达下降。

图2 p-PI3K、p-Akt蛋白表达示意图
3 讨论
肺癌目前全球死亡率和发病率最高的恶性肿瘤,严重威胁人们的健康[7]。肺癌一般多发于中年以后的男性,近些年随着现代生活的发展,肺癌的发病率出现了年轻化趋势,而这种情况与不良生活习惯和环境污染有着较大的关系[8]。目前,世界上使用比较广泛的化疗药物是顺铂,它在肺癌的治疗过程中表现出较好的治疗效果,但长期应用会引起肿瘤细胞对其产生耐药性,导致治疗效果不佳,并且其毒副作用较大。因此,为了提高肺癌患者的临床治疗效果,寻找抵抗耐药性的新药非常重要[9]。相关研究表明,槲皮素是一种天然的黄酮类化合物,包括芸香苷和槲皮苷2 种糖基化形式,广泛分布于水果、蔬菜及多种中草药中,有抗氧化、抗菌、抗病毒、抗炎以及保护心血管等功能。槲皮素还在多种恶性肿瘤中发挥抗癌活性,如乳腺癌、肝癌、肺癌、白血病等[10]。另外槲皮素还具有成本低和不良反应少的优点。相关研究表明,槲皮素可以减少顺铂引起的毒性反应[11],增加顺铂化疗敏感性[12]。本次实验研究槲皮素联合顺铂对肺癌治疗的协同作用,并初步探讨其与PI3K/Akt信号通路之间的关系。
本次研究显示,槲皮素和顺铂单独使用时对肺癌A549/DDP细胞有增殖抑制作用,但槲皮素和顺铂联合应用后,对肺癌细胞的增殖抑制作用更加明显。本次实验结果显示,槲皮素联合顺铂使A549/DDP 细胞凋亡率明显上升。单用槲皮素或者顺铂也可使肺癌A549/DDP细胞凋亡率上升,但是槲皮素和顺铂联用后可明显诱导肺癌A549/DDP 细胞核破碎,且细胞早期凋亡率较槲皮素、顺铂单用组明显上升。刘强等[13]研究也证实,细胞凋亡在细胞生物体发育生长过程关键的作用,参与了多种生理病理过程,尤其是在癌症化疗治疗中为潜在的治疗策略。Western blot检测结果显示槲皮素与顺铂两药联用明显降低了p-PI3K/PI3K、p-Akt/Akt蛋白表达水平。
肺癌细胞的增殖、凋亡与PI3K/Akt 信号通路有关[14]。本次实验通过Western blot 实验发现,与对照组比较,单用槲皮素、顺铂组的p-PI3K/p-Akt 蛋白相对表达水平均较低,但随着槲皮素、顺铂联用,p-PI3K、p-Akt 蛋白相对表达水平均降低,这说明槲皮素联合顺铂可以调控p-PI3K、p-Akt 信号通路。这可能与Akt 是重要的PI3K 下游调节激酶之一有关。槲皮素联合顺铂通过抑制PI3K 的表达,使得PI3K 无法与Akt 的PH 区域含有苏氨酸和丝氨酸残基的底物磷酸化结合,抑制了Akt 的PH 区域含有苏氨酸和丝氨酸残基的底物磷酸化活化,Akt 发挥抗凋亡、促细胞生长的生物学效应主要通过对Akt 的PH 区域而实现。此过程活化被抑制使Akt 信号通路抑制细胞凋亡和促进细胞增殖均受到抑制,导致细胞趋向于凋亡。这与施银等[15]对PI3K/Akt 信号通路与细胞的增殖、凋亡及其与肿瘤的发生、发展的研究结果相类似。
综上所述,槲皮素联合顺铂抑制癌细胞的增殖并诱导其凋亡,其作用机制与PI3K/Akt 信号通路有密切关系,这为肺癌临床治疗提供了新的思路。同时也存在一些不足之处,细胞的体外实验与体内的情况不完全一致,还需通过动物模型甚至患者进行进一步深入研究,为将槲皮素联合顺铂应用于肺癌的临床治疗提供确切的理论依据。
