乳腺癌组织中CXCL8、CXCR1、CXCR2表达在新辅助化疗前后的变化及意义
2021-10-09王文涛孔滨
王文涛,孔滨
1青岛大学附属医院乳腺外科,山东青岛266000;2枣庄市妇幼保健院乳腺外科
新辅助化疗(NAC)目前已广泛应用于乳腺癌的治疗,对于局部晚期乳腺癌患者,通过NAC能够在早期观察瘤体对化疗方案的敏感性进而评估疗效。研究显示,CXCL8对乳腺癌的发生发展具有促进作用,CXCL8通过细胞外结合两种G蛋白偶联受体CXCR1和CXCR2来传导信号,三者共同在乳腺癌微环境中表达,促进肿瘤生长和转移[1-2]。有学者认为,CXCL8表达升高可能导致乳腺癌细胞的多重耐药[3]。本研究观察了NAC前后乳腺癌组织中CXCL8、CXCR1、CXCR2的表达变化,探讨CXCL8-CXCR1/2轴在评估乳腺癌化疗疗效及预后中的作用。
1 资料与方法
1.1 临床资料选择2016年1月—2018年12月在青岛大学附属医院接受NAC的62例女性乳腺癌患者,发病年龄34~66岁、中位发病年龄50岁,已绝经31例、未绝经31例。行乳腺肿块空心针穿刺活检确诊为浸润性乳腺癌,TNM分期Ⅰ期5例、Ⅱ期30例、Ⅲ期27例。Luminal型46例,HER-2阳性型8例,三阴型8例。
1.2 治疗方法NAC方案选择以下两种之一:①TAC×6方 案:多 西 他 赛75 mg/m2,多 柔 比 星50 mg/m2,环磷酰胺500 mg/m2,21 d为1周期,共6周期。②AC×4-T×4方案:多柔比星60 mg/m2,环磷酰胺600 mg/m2,应用4周期;序贯多西他赛80~100 mg/m2,应用4周期,21 d为1周期。化疗结束后2~3周行乳腺癌改良根治术或乳腺癌保乳术。
1.3 乳腺癌组织CXCL8、CXCR1、CXCR2表达检测方法采用免疫组化法。收集NAC前的穿刺活检肿瘤组织和NAC后的手术切除肿瘤组织,石蜡包埋、切片,常规脱蜡至水,EDTA抗原修复,BSA封闭30 min。滴加一抗(CXCL8稀释比例1∶100,CXCR1、CXCR2稀释比例1∶50),4℃孵育过夜。滴加相应的二抗,37℃孵育30 min。DAB显色,苏木素复染,脱水封固,显微镜下观察。每张切片随机取5个视野,由2名资深病理医师采用双盲法对染色结果进行半定量评分。CXCL8表达判定:细胞质呈黄色或褐色且染色细胞≥10%为阳性,染色细胞<10%或无染色为阴性。CXCR1和CXCR2表达判定:先进行染色强度评分,无染色为0分,浅黄色为1分,黄褐色为2分,棕褐色为3分;然后对阳性细胞百分比进行评分,<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。两项积分相加,2~4分为低表达,5~7分为高表达。
1.4 NAC疗效评估方法取NAC后的手术切除肿瘤组织,应用Miller-Payne系统进行疗效评估。G1:浸润性癌细胞无变化或个别癌细胞有所改变,但癌细胞数量总体无减少;G2:浸润性癌细胞数量轻度减少,减少比例<30%;G3:浸润性癌细胞数量减少比例为30%~90%;G4:浸润性癌细胞减少比例>90%,残留量极少;G5:原瘤床无浸润性癌细胞,但导管原位癌可残存。
1.5 预后随访方法通过查询电子病历系统、电话沟通等方式进行随访,记录患者的无病生存期(DFS),即从手术之日起至肿瘤出现复发、转移或其他原因导致死亡的时间。截止日期为2021年3月。
2 结果
2.1 NAC前后乳腺组织中CXCL8、CXCR1、CXCR2表达比较NAC前后CXCL8阳性率分别为27.4%(17/62)、41.9%(26/62),NAC后CXCL8阳性率升高(P<0.05)。NAC前后CXCR1表达积分分别为(5.6±1.1)、(4.8±1.4)分,CXCR2表达积分分别为(5.6±1.1)、(4.6±1.4)分,NAC后CXCR1、CXCR2表达积分均降低(P均<0.01)。
2.2 NAC前后乳腺癌组织中不同CXCL8、CXCR1、CXCR2表达水平患者的NAC疗效比较NAC前CXCL8、CXCR1、CXCR2表达与Miller-Payne分级均无明显相关(P均>0.05)。NAC后CXCL8阴性患者Miller-Payne分级G4~G5级比例高于G1~G3级患者,CXCR1、CXCR2低表达患者Miller-Payne分级G4~G5级的比例高于高表达患者(P<0.05或<0.01)。见表1。
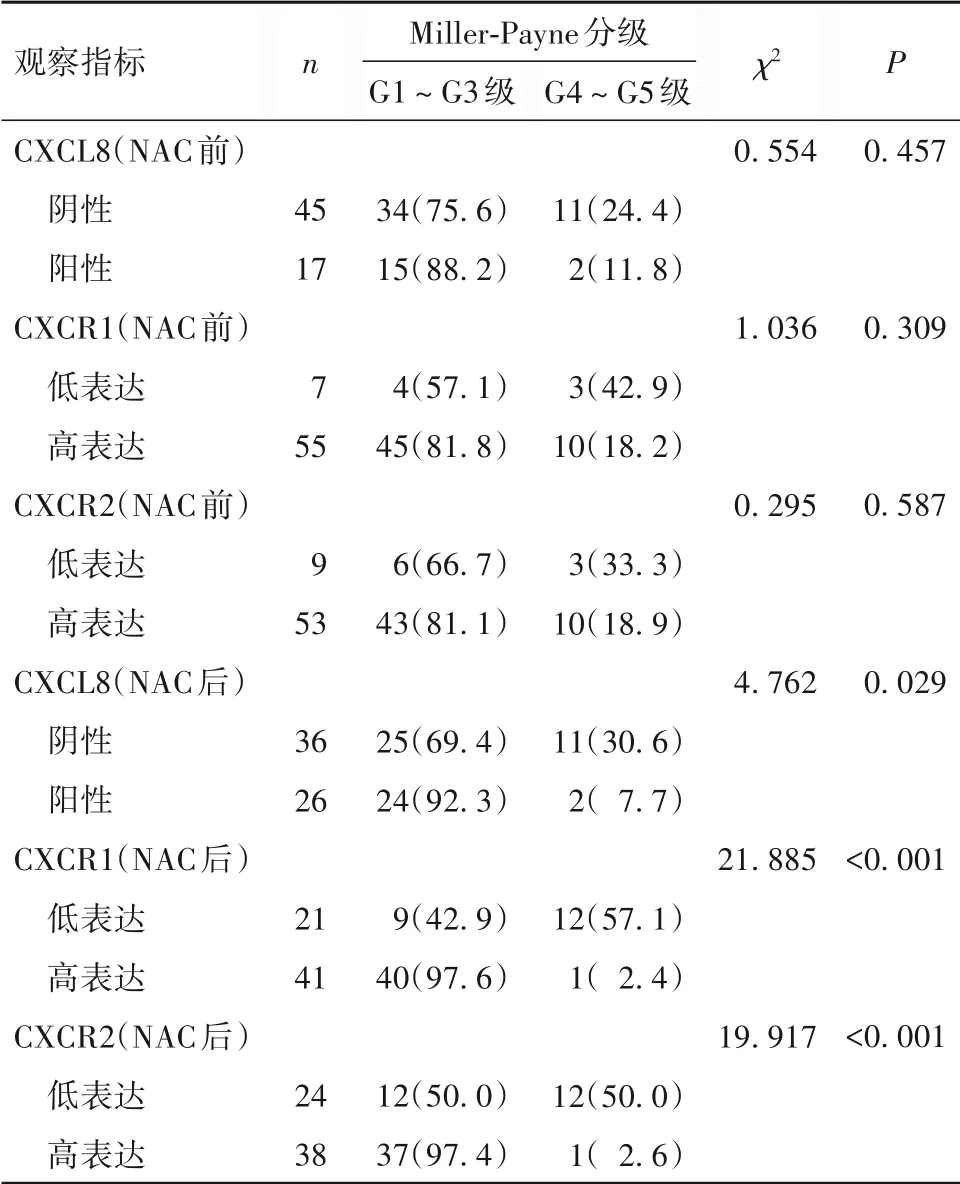
表1 NAC前后乳腺癌组织中不同CXCL8、CXCR1、CXCR2表达水平患者NAC疗效比较[例(%)]
2.3 影响乳腺癌患者NAC疗效的Logistic回归分析结果单因素分析显示,肿瘤T分期、CXCL8(NAC后)、CXCR1(NAC后)与Miller-Payne分级相关(P均<0.05)。多因素分析显示,肿瘤T分期、CXCR1(NAC后)是Miller-Payne分级的影响因素(OR=0.128,95%CI为0.018~0.920,P=0.041;OR=0.069,95%CI为0.008~0.590,P=0.015)。见表2。
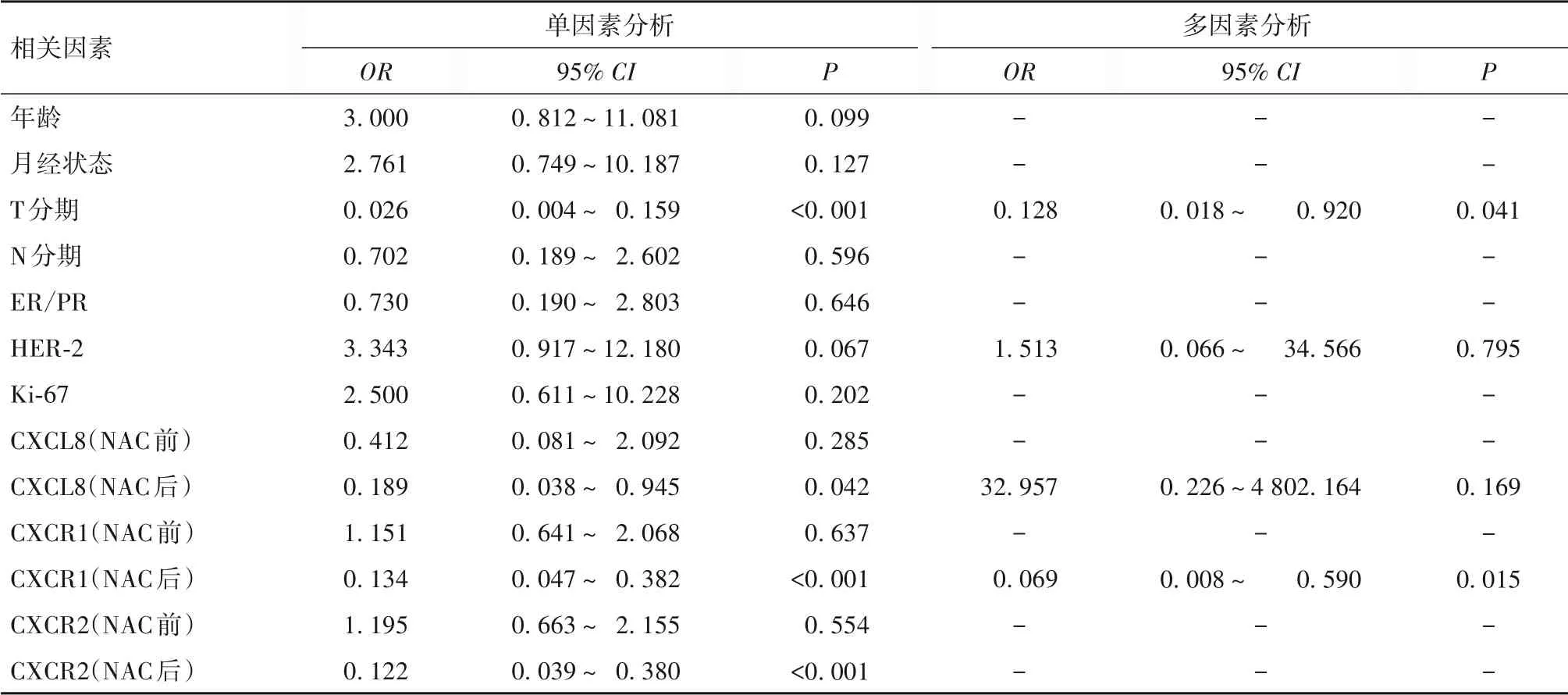
表2 影响乳腺癌患者NAC后Miller-Payne分级的Logistic回归分析结果
2.4 乳腺癌组织中CXCL8、CXCR1、CXCR2不同表达水平患者的DFS比较CXCL8(NAC前)阳性、阴性患者的DFS分别为24.2、44.9个月,CXCL8(NAC后)阳性、阴性患者的DFS分别为26.4、48.3个月;NAC前后CXCL8阳性患者的DFS均较CXCL8阴性患者缩短(P均<0.01)。随访期间NAC前CXCR1、CXCR2低表达组均未出现肿瘤复发转移,未能计算DFS。CXCR1(NAC后)高表达、低表达患者的DFS分别为32.9、47.3个月。CXCR2(NAC后)高表达、低表达患者的DFS分别为31.2、47.5个月;NAC前CXCR1、CXCR2高表达与低表达患者的DFS比较差异无统计学意义(P均>0.05),NAC后CXCR1、CXCR2低表达患者的DFS较高表达患者增加(P均<0.01)。
2.5 影响乳腺癌患者DFS相关因素的COX回归分析结果单因素分析显示,肿瘤T分期、N分期、HER-2、CXCL8(NAC前)、CXCL8(NAC后)、CXCR1(NAC后)、CXCR2(NAC后)与DFS相关。多因素分析显示,肿瘤T分期、CXCL8(NAC后)是DFS的独立影 响 因 素(P=0.048,HR=2.620;P=0.004,HR=26.990)。见表3。
3 讨论
研究表明,趋化因子和趋化因子受体与乳腺癌的耐药性和免疫力密切相关。乳腺癌细胞既能够产生趋化因子,也可以表达趋化因子受体,这些配体和受体在乳腺癌的进展中发挥重要作用。基于网络的基因表达谱分析提示,CXCL8在乳腺癌中的作用显著[4]。SINGH等[5]研究认为,CXCL8-CXCR1/2轴可能通过调节癌症干细胞增殖和自我更新在肿瘤进展和转移中发挥重要作用。CXCL8对接细胞膜上的G蛋白偶联受体CXCR1和CXCR2传导信号,CXCR1和CXCR2在所有乳腺癌细胞中均有表达,二者具有76%的序列同源性,并以相似的亲和力与CXCL8结合。CXCL8及其受体CXCR1、CXCR2促进肿瘤进展的作用已有诸多文献报道,肿瘤较大且转移风险较高的患者,其血清CXCL8水平显著升高[6]。乳腺癌的晚期肿瘤负荷可能会引起血清CXCL8水平升高,并导致乳腺癌的不良结局,同时CXCL8升高也与早期癌灶远处转移有关[7]。CXCL8表达水平增加可能有助于乳腺癌细胞的多药耐药,在胰腺癌裸鼠模型中移植Miapaca-2细胞后,给予吉西他滨治疗,结果显示吉西他滨可诱导CXCL8升高,进而促进新血管形成产生耐药[8]。本研究结果显示,NAC后CXCL8阳 性 率 升 高,CXCR1、CXCR2表 达 降 低。CXCL8阳性表达升高符合化疗引起的炎症刺激作用,CXCL8-CXCR1/2轴的激活和调节主要基于炎症反应和免疫细胞募集[9],导致肿瘤细胞周围的免疫细胞产生CXCL8增多。CXCR1、CXCR2表达于乳腺组织中,随着化疗导致的肿瘤细胞凋亡、肿瘤细胞数减少,CXCR1、CXCR2表达亦降低。提示NAC可能诱导细胞因子CXCL8增多,改变乳腺癌肿瘤微环境,有利于化疗耐药的产生。
研究显示,乳腺癌组织中CXCR1在NAC后的下降幅度与化疗疗效相关[5],提示CXCR1与乳腺癌化疗效果有密切联系。CXCR2及其配体有维持化疗耐药性的作用,在化疗环境中靶向CXCR2信号传导将有助于规避化疗耐药[10]。本研究中,NAC前CXCL8、CXCR1、CXCR2的表达差异与Miller-Payne分级未显示出相关性,不排除由于患者数量偏少、临床分期和分子分型不同等因素影响可能。然而NAC后CXCL8阳性和CXCR1、CXCR2高表达患者的Miller-Payne分级较低,化疗疗效较差,而CXCL8阴性和CXCR1、CXCR2低表达患者的化疗疗效更好;CXCR1在NAC后 的 表 达 是Miller-Payne分 级的独立影响因素。提示NAC后CXCL8、CXCR1、CXCR2的表达与化疗疗效相关,NAC后CXCL8、CXCR1、CXCR2可用于评估NAC疗效。
既往研究显示,血清CXCL8与激素依赖型乳腺癌[6]、HER2阳性乳腺癌[11]患者的预后不良有关。雌激素受体阴性的乳腺癌组织中CXCL8 mRNA水平升高[12],提示预后不良。胡紫叶等[13]报道,乳腺癌组织中CXCL8表达阳性患者的预后较差。加权基因联合表达网络分析发现,CXCL8可能与肿瘤相关成纤维细胞的化学耐药性相关,并与乳腺癌的预后不良相关[14]。宿主和癌细胞衍生的CXCR2信号通路在乳腺癌骨转移中表现出非常重要的作用,CXCR2有助于乳腺癌诱导的骨溶解和骨转移,是预后不良的重要因素之一[15]。本研究显示,NAC后CXCL8、CXCR1、CXCR2的表达与DFS相关,CXCL8阴性及CXCR1、CXCR2低表达的DFS更佳;CXCL8在NAC后的表达状态是DFS的独立影响因素,CXCL8阳性患者预后不良,提示CXCL8可作为预测乳腺癌患者预后的参考指标。CXCL8、CXCR1、CXCR2在NAC后的高表达提示预后不良,推测经NAC后局部病灶及全身血液中CXCL8的增多可能有利于身体远处微转移灶的形成和进展,进而影响患者的预后;抑制或阻断CXCL8-CXCR1/2信号传导可能有助于抑制肿瘤的生长和转移,提高NAC疗效,改善患者预后。
此外,本研究中NAC前的CXCL8表达与化疗疗效无关,而与DFS相关;分析患者资料发现,NAC前CXCL8阴性患者占73%,其中CXCR1/2高表达者占80%,这可能由于CXCR1/2高表达通过其他信号通路(非CXCL8-CXCR1/2通路)导致肿瘤耐药,进而影响NAC疗效,表现为CXCL8阴性却耐药的现象;而化疗后这些NAC前CXCL8阴性且CXCR1/2高表达的患者转变为CXCL8阴性且CXCR1/2低表达的患者增多,从而影响了DFS,表现为CXCL8阴性患者的DFS更佳。
综上所述,NAC后乳腺癌组织中的CXCL8、CXCR1、CXCR2的表达在评估化疗疗效和预后中有重要作用,可作为标志物筛选出化疗疗效不佳和预后不良的患者,利于指导治疗决策的变更。综合生物信息学分析提示,CXCL8是乳腺癌患者精准治疗的潜在靶点[16],靶向CXCL8-CXCR1/2轴的免疫治疗可能为乳腺癌的治疗提供广阔的前景。由于本研究样本量较小,有个别指标虽然在单因素分析时显示有统计学意义,但在多因素分析时通过对变量因素的筛选,未能显示统计学意义,遂未能纳入多因素分析,我们将在后续研究中扩大样本量进一步深入分析。
