胶质瘤患者血清中TNF-α与MG-Ags的水平变化及其临床意义
2021-10-09仝照磊岳亚敏许树兰徐伟莉
仝照磊 岳亚敏 许树兰 徐伟莉
胶质瘤包括多种发生于神经外胚层细胞的肿瘤,是人类中枢神经系统最常见的恶性肿瘤[1-2]。目前胶质瘤的诊断仍靠影像学与病理检查,都存在一定的不足[3]。随着对胶质瘤生物分子学的深入研究,逐渐认识其发生与发展,在其癌变过程中涉及到许多基因的表达异常[4]。不过CEA,CA125等常见的肿瘤标志物对胶质瘤的诊断缺乏特异性和灵敏性[5]。肿瘤坏死因子-α(TNF-α)为常见的促炎因子,在恶性肿瘤中的高表达与肿瘤组织的生物学特性密切相关[6]。MG-Ags是1种中性糖脂类肿瘤相关抗原,在恶性肿瘤组织中高度表达,而在正常组织中几乎不表达[7]。本文具体探讨了胶质瘤患者血清中TNF-α与MG-Ags的水平变化及其临床意义,现报告如下。
1 资料与方法
1.1 研究对象
2018年4月至2020年4月选择在本院诊治的胶质瘤患者64例作为胶质瘤组(所有胶质瘤样本均经病理证实),同期选择健康查体人员64例作为对照组。纳入标准:年龄20~75岁;入选者签署了知情同意书;医院伦理委员会批准了此次研究;临床与检测资料完整。排除标准:合并其他肿瘤者;妊娠与哺乳期妇女;伴有严重肝、肾、心、肺组织器官疾病者;内分泌及免疫系统疾病者;精神疾病或认知功能障碍者。两组的性别、年龄、心率、收缩压、舒张压等对比差异有统计学意义(P>0.05),见表1。

表1 两组一般资料对比
1.2 血清TNF-α与MG-Ags检测
取所有入选者的空腹静脉血样本2~3 ml,4 ℃ 1000 rpm/min离心10 min,取上层血清保存于-80 ℃冰箱,采用酶联免疫法检测血清TNF-α与MG-Ags含量,试剂盒由厦门慧嘉生物科技有限公司提供。
1.3 调查资料
通过查阅电子和纸质版病例档案,收集胶质瘤患者的病理特征,包括肿瘤大小、病理类型、临床分期、淋巴结转移等。
1.4 统计学方法
应用SPSS 22.00统计软件完成数据分析,计量资料用均数±标准差表示(对比为t检验),计数数据以率表示(对比为卡方χ2检验),相关性分析采用Spearman相关分析,检验水准为ɑ=0.05。
2 结果
2.1 血清TNF-α与MG-Ags含量对比
胶质瘤组的血清TNF-α与MG-Ags含量高于对照组(P<0.05)。见表2。
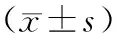
表2 两组血清TNF-α与MG-Ags含量对比
2.2 病理特征
在64例胶质瘤患者中,肿瘤最大直径≥5 cm 30例,<5 cm 34例;病理类型:星形细胞瘤42例,胶质母细胞瘤22例;临床分期:Ⅰ期34例,Ⅱ期20例,Ⅲ期10例;淋巴结转移22例。
2.3 TNF-α与MG-Ags表达与胶质瘤病理特征的相关性
在64例胶质瘤患者中,不同肿瘤最大直径、临床分期、淋巴结转移患者的血清TNF-α与MG-Ags含量对比差异有统计学意义(P<0.05),见表3。
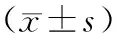
表3 不同病理特征胶质瘤患者的血清TNF-α与MG-Ags含量对比
2.4 相关性分析
Spearman相关分析显示:血清TNF-α、MG-Ags含量与肿瘤最大直径、临床分期、淋巴结转移都存在相关性(P<0.05),血清TNF-α含量与MG-Ags含量也存在相关性(γ=0.768,P=0.000),见表4。

表4 胶质瘤患者的血清TNF-α、MG-Ags含量与病理特征的相关性
3 讨论
胶质瘤是临床上的1种原发性颅脑肿瘤疾病,其显著特征是肿瘤细胞的恶性增殖及侵袭性生长,使得患者的5年生存率不超过10.0%[8]。临床对于胶质瘤的术前诊断主要依靠影像学手段,具有主观性强等不足。病理诊断对于患者有一定的创伤,很难在术前评估患者的病情。细胞恶性增殖和肿瘤血管形成是胶质瘤发生与发展的基础,特别其为血供丰富的肿瘤,为此了解胶质瘤的发生机制具有重要的价值[9]。
本研究显示胶质瘤组的血清TNF-α与MG-Ags含量高于对照组(P<0.05)。TNF-α主要由激活的单核巨噬细胞分泌,对正常细胞无明显毒性,但是能够直接杀伤肿瘤细胞。TNF-α可参与机体多种生理及病理过程,可介导组织损伤的急性时相反应、调节细胞增殖与分化,从而与炎症、休克、肿瘤的发生密切相关[10]。人体在正常生理状态下的MG-Ags 含量非常低,但是机体在出现肿瘤的情况下,血清IL-6水平会显著升高[11]。基础研究显示MG-Ags可调节肿瘤组织内血管的形成,在恶性肿瘤中的高表达能刺激炎性反应细胞向病变部位聚集,并促进肿瘤细胞的增殖、侵袭和迁移[12]。
由于胶质瘤存在肿瘤相关基因异质性及肿瘤易感性,目前尚无十分有效的治疗措施。目前不少学者开始从分子水平上研究胶质瘤的发病原因,因而相关细胞因子、肿瘤标志物与胶质瘤的关系受到广泛关注[13]。本研究显示不同肿瘤最大直径、临床分期、淋巴结转移患者的血清TNF-α与MG-Ags含量对比差异有统计学意义(P<0.05)。从机制上分析,TNF-α当前被确认为引起多种自身炎症性疾病的关键原因,TNF-α可激活JAK2/STAT3信号系统,减弱肌质网功能,可刺激促纤维化因子表达,使组织纤维化[14]。MG-Ags对胃癌的诊断特异性、灵敏度均高于其他肿瘤标志物,过量的MG-Ags破坏机体免疫力,破坏机体对肿瘤免疫应答,促进肿瘤的生长[15]。
本研究Spearman相关分析显示胶质瘤患者的血清TNF-α、MG-Ags含量与肿瘤最大直径、临床分期、淋巴结转移都存在相关性(P<0.05),血清TNF-α含量与MG-Ags含量也存在相关性(γ=0.768,P=0.000)。从机制上分析,TNF-α可通过损伤血管内皮细胞,通过调节胶质瘤细胞内的凋亡基因与抑癌基因的比例,从而导致血管损伤,引起患者病情恶化[16]。过量的MG-Ags表达可以降低人机体的免疫力,促进肿瘤细胞增殖,减少免疫应答,也会导致患者预后不良[17-18]。本研究也存在一定的不足,没有从细胞水平分析TNF-α与MG-Ags相互作用,也没有进行体内模型分析,将在后续研究中进行分析。
总之,TNF-α与MG-Ags在胶质瘤患者血清中呈现高表达状况,与患者的病理特征存在相关性,两者也可直接发挥协同作用,共同促进了胶质瘤的发生与发展过程。
