S/R构型烟碱与胃膜素的作用机制
2021-10-09朱瑞芝向能军司晓喜刘春波唐石云张凤梅刘志华蔡炳彪
杨 继,朱瑞芝,向能军,司晓喜,何 沛,刘春波,唐石云,张凤梅,王 强,刘志华,蔡炳彪*
1.云南中烟工业有限责任公司技术中心,昆明市北市区红锦路367号 650231
2.红塔烟草(集团)有限责任公司工艺质量部,云南省玉溪市红塔区红塔大道118号 653100
胃膜素(Gastrin I Human,GIh)又称胃黏膜素,是从猪胃黏膜中提取的一种以黏蛋白为主要成分的生化药物[1]。胃膜素有重要的生理和药理功能[2-5]。烟碱约占烟草中总生物碱的90%,是烟草制品的主要化学成分。烟碱具有两种不同的旋光异构体,即S-(-)-烟碱和R-(+)-烟碱[6-7]。烟草中的烟碱主要为S-(-)-烟碱,R-(+)-烟碱仅占烟草原料中烟碱总量的1%(质量分数,下同)左右,但随着燃烧过程中的热解和外消旋作用,R-(+)-烟碱的量可达到2%~3%。许多动物实验和体外模型实验表明,两者在生物体内的代谢过程有所不同,S-(-)-烟碱比R-(+)-烟碱具有更强的生理活性和毒性[7]。因此,两种构型烟碱的分离及作用机理在药学和吸烟与健康研究方面具有重要意义[8]。口含烟作为新型的烟草制品,已成为烟草消费的重要补充形式,日益受到关注。不同于传统卷烟,口含烟没有经过燃烧过程,而是经口腔咀嚼或口含来吸食,通过味觉消费。其烟碱摄入由传统卷烟烟丝燃烧-上呼吸道摄入模式转向口腔-胃肠消化道摄入模式。一部分烟碱透过口腔黏膜被吸收后进入血液使人产生生理满足感;另一部分转入胃肠道吸收,并与胃肠道内生物大分子发生相互作用。摄入模式的改变导致烟碱在体内外的溶出和吸收规律发生变化,因此必须重新认识烟碱在口腔及胃肠道中的释放、吸收、渗透、扩散行为及影响因素。同时,研究S-(-)-烟碱和R-(+)-烟碱与消化道胃肠部位关键生物大分子相互结合方式及影响因素,以了解不同构型烟碱的生物活性,对深入了解烟碱的作用机理具有重要意义。因此,本研究中从实验角度对S/R型烟碱与GIh 的结合行为进行对比考察,总结出配体分子的构型对结合过程的影响,旨在探究不同构型烟碱在人体内与生物蛋白的相互作用,为新型烟草的产品开发、质量控制及安全性评价提供理论依据。
1 材料与方法
1.1 材料、试剂和仪器
胃膜素(96%~99%,美国Sigma-Aldrich 生物技术公司):S型烟碱(陕西港华生物科技有限公司);R型烟碱(>99%,加拿大TRC 化学品公司);PBS 缓干粉(AR,杭州昊鑫生物科技股份有限公司);超纯水[自制,电阻率18.2 MΩ·cm(25 ℃)]。
Cary Eclipse 分子荧光光谱仪(美国Varian 公司);FluoroLog-3 时间分辨荧光光谱仪(法国Horiba 公司);Aviv Model 400 圆二色谱仪(美国Aviv 公司);BS224S 型电子天平(北京赛多利斯仪器系统有限公司);YASARA v16.7.22 软件(美国Scripps 研究所Olson 实验室);Milli-Q 超纯水制备仪(法国默克化工技术公司)。
1.2 方法
1.2.1 溶液制备
(1)PBS 缓冲液:将一包PBS 缓干粉固体全部倒入烧杯中,用超纯水溶解并定容至2 L 容量瓶中,得pH=7.4、浓度为0.01 mol/L 的PBS 缓冲液。
(2)GIh 储备液:准确称取5 mg GIh,用pH=7.4的PBS 缓冲液定容至100 mL,即得2.0×10-5mol/L的GIh 储备液。
(3)S/R型烟碱(S/R-Nic)储备液:准确吸取16 μL 烟碱,用PBS 缓冲液溶解并定容于10 mL 容量瓶中,得0.01 mol/L 的烟碱储备液。用锡纸包裹容量瓶避光放置。
1.2.2 分子荧光光谱法
取6 只2 mL 的离心管,分别加入250 μL 2.0×10-5mol/L 的GIh 储备液,然后再分别加入0、20、80、160、320 和480 μL 的烟碱储备液,最后依次加入pH=7.4 的PBS 缓冲液750、730、670、590、430和270 μL。忽略溶液混合带来的体积误差,配制成1 mL 的混合溶液,使得GIh 最终浓度为5.0×10-6mol/L,烟碱最终浓度分别为0、0.2×10-3、0.8×10-3、1.6×10-3、3.2×10-3和4.8×10-3mol/L,置于旋涡混合器上使其混合均匀,避光置于恒温水浴锅中,30 min 后进行荧光发射光谱测定。设定测试样品温度为298 和310 K,激发波长为280 nm,激发与发射的夹缝宽度分别为20 和10 nm,测定范围为300~500 nm,记录荧光发射光谱的峰值强度。
1.2.3 时间分辨荧光光谱法
配制两份试样溶液:按比例混合GIh 储备液和烟碱储备液,并以PBS 缓冲液定容,使得GIh 最终浓度为5.0×10-6mol/L,烟碱浓度分别为0 和8.0×10-4mol/L,置于旋涡混合器上使其混合均匀,静置30 min 后进行荧光测定。激发波长和发射波长分别设定为280 和338 nm,测定温度为298 K。
1.2.4 同步荧光光谱法
测定发射波长与激发波长差值分别为15 和60 nm(Δλ=15、60 nm)条件下的荧光强度。在Δλ=15 nm 的同步荧光实验中,扫描范围为200~600 nm,激发夹缝宽度为5 nm,发射狭缝宽度为20 nm,GIh 和S型/R型烟碱的混合溶液浓度为分子荧光光谱法实验中溶液的1/10。在Δλ=60 nm 的同步荧光实验中,设定扫描范围为200~400 nm,激发夹缝宽度为20 nm,发射狭缝宽度为10 nm,GIh和S型/R型烟碱的混合溶液样品配制方法与荧光发射光谱一致。
1.2.5 三维荧光光谱法
按1.2.3 节的方法配制两份试样溶液,静置30 min 后进行三维荧光光谱测定。设定激发波长范围为200~500 nm(间隔为10 nm),发射波长范围为200~500 nm,激发与发射的夹缝宽度分别为20和10 nm,温度为室温。
1.2.6 圆二色光谱法
按1.2.3 节的方法配制两份试样溶液,静置30 min 后进行圆二色光谱测定。设置步长为1 nm,扫描范围为190~280 nm,每个样品重复扫描3 次,取平均值。
2 结果与讨论
2.1 荧光淬灭及淬灭机理的研究
荧光是物质吸收光照或其他电磁辐射后发出的光。光照射某些原子时,光的能量使原子核周围的一些电子从基态跃迁到激发态。激发态具有较高能量而不稳定,可通过多种途径释放能量再回到基态,其中,以光量子发射形式的能量释放,可产生荧光。用荧光光谱技术分析的样品,首先要有含吸光结构的荧光物质[9]。蛋白质分子中的内源性荧光主要来自Trp(色氨酸,348 nm)、Tyr(酪氨酸,303 nm)和Phe(苯丙氨酸,282 nm)3 种氨基酸残基。Trp、Tyr 和Phe 之间的荧光强度比为FTrp∶FTyr∶FPhe=100∶9∶0.5,且Phe 氨基酸残基在水溶液中多以离子形式存在,其荧光量子产率较低,对蛋白质水溶液的荧光贡献难以观测得到,且同一蛋白分子中的Phe 和Tyr 吸收的能量通常会传递给Trp,因此,蛋白质分子水溶液多表现为Trp 的荧光特性[9-10]。通常认为,当有机小分子与蛋白受体结合后,会影响该蛋白发色团周围的微环境,在光谱上直观地表现出蛋白的内源性荧光发生淬灭,通过利用蛋白荧光强度与有机小分子浓度之间的关系进行相关定性和定量研究,从而得到激发光谱、发射光谱以及荧光强度等物理参数,和结合机理、结合模式、结合常数、结合位点数以及分子间的距离等分子间相互作用信息[11-12]。因此荧光光谱法成为研究小分子药物与蛋白之间相互作用的重要手段之一。
在本实验中,首先考察激发波长的选择。常选择280 和295 nm 作为蛋白质溶液的激发波长(λex)。当λex为280 nm 时,Trp、Tyr 和Phe 均被激发,主要考虑蛋白质分子整体受外加物质或试剂的影响;当λex为295 nm 时,得到的荧光谱图显示为Trp 荧光特征。因此本研究中考察两种激发波长。S型和R型烟碱分别与GIh 结合的荧光强度淬灭的归一化情况见图1。可以看出,随S型/R型烟碱的不断加入,GIh 的荧光强度逐渐降低,即发生了荧光淬灭现象,表明S型和R型烟碱分子均与GIh 之间存在相互作用。对比280 和295 nm 两种激发下的荧光淬灭效果发现,无论是S型还是R型烟碱,均在280 nm 的激发波长下有比较大的荧光淬灭,因此选择此激发波长更有利。同时,对于S型烟碱来说,280 nm 激发波长下荧光淬灭比295 nm 强很多;而对于R型烟碱来说,280 nm 激发波长下荧光淬灭比295 nm 激发下仅有微弱优势。因此也可以判断出,S型烟碱与GIh 的结合对蛋白内部的3 种含有荧光发色团的氨基酸均有影响,而R型烟碱主要对色氨酸残基有影响。
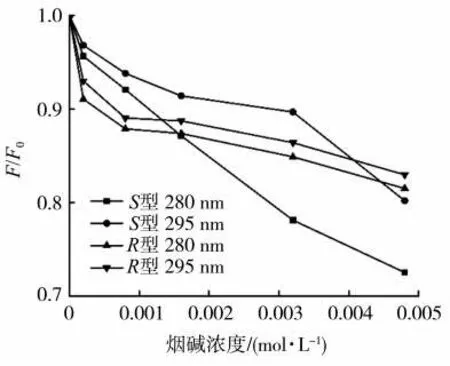
图1 280 和295 nm 激发波长下S 型/R 型烟碱对GIh 在338 nm 处荧光强度淬灭的归一化图Fig.1 Normalized diagram of fluorescence intensity quenching of GIh at 338 nm induced by S/R-nicotine at excitation wavelengths of 280 and 295 nm
不同浓度的烟碱溶液对GIh 的荧光淬灭情况如图2 所示。GIh 的最大荧光发射峰约出现在358 nm 位置,随着S型/R型烟碱的不断加入,GIh的荧光强度逐渐降低,即发色团的荧光发生了淬灭,并由此可断定烟碱与GIh 间发生了相互作用,且烟碱均与GIh 存在一定程度的结合。同时,可以看出加入相同浓度的S型和R型烟碱,S型对GIh的荧光淬灭强度均比R型烟碱强很多,因此也可以初步判断S型烟碱与GIh 的作用强度大于R型。

图2 298 K 下S 型/R 型烟碱与GIh 作用的荧光发射谱Fig.2 Fluorescence emission spectra of S/R-nicotine acting on GIh at 298 K
荧光淬灭主要指动态淬灭和静态淬灭两种。判断一个淬灭过程是动态还是静态,可以依据其对温度的依赖性。当温度升高时分子之间的碰撞会加剧,导致动态淬灭常数增加;而在静态淬灭机理下形成的复合物会发生解离,从而导致淬灭常数下降。考虑到内滤效应的影响,为确保实验结果的准确性,本研究中用于分析计算的荧光数据均采用文献中使用较多的公式(1)进行数据校正。

式中:Fcor和Fobs分别为校正后和实验实测的荧光强度;A1和A2分别为GIh 和不同浓度的烟碱混合溶液在激发和发射波长下的紫外吸光度,Abs。后续数据处理均使用校正后的数据。本研究中采用Stern-Volmer 方程(2)在不同温度(298 和310 K)下的线性拟合分析荧光淬灭类型[12]。

式中:F和F0分别为烟碱存在和不存在时GIh的荧光强度;Kq为荧光淬灭速率常数,L/(ns·mol);τ0为GIh 的平均荧光寿命(298 K 下,τ0值为2.13 ns,由时间分辨荧光实验测定,见表1);[Q]为烟碱的浓度,mol/L;Ksv为Stern-Volmer 淬灭常数,L/mol。
在不同温度下,F0/F对[Q]的线性回归分析拟合曲线见图3。可知,不同温度下的Stern-Volmer曲线线性关系良好。根据公式(2)计算得到的淬灭常数Ksv以及淬灭速率常数Kq见表1。可以看出,随温度升高,S型和R型烟碱对GIh 的淬灭常数Ksv逐渐减小,这表明两种构型烟碱和GIh 相互作用的过程为静态淬灭,有复合物形成[13]。此外,S型和R型烟碱在不同温度下的淬灭速率常数Kq值均大于最大散射碰撞淬灭速率常数值[2.0×1010L/(s·mol)],这进一步表明,无论是S型还是R型烟碱与GIh 之间相互作用的淬灭机理均为静态淬灭。

图3 S 型和R 型烟碱与GIh 作用体系在不同温度下的Stern-Volmer 拟合结果Fig.3 The Stern-Volmer plots of F0/F for GIh against S/R-nicotine at two different temperatures

表1 S 型和R 型烟碱与GIh 作用体系在不同温度下的Stern-Volmer 荧光淬灭常数Tab.1 Fluorescence quenching constants of S/R-nicotine and GIh systems in Stern-Volmer equation at different temperatures
动态、静态淬灭的区分也可通过对比加入烟碱前后GIh 的荧光寿命实现。若S型/R型烟碱与GIh 之间的淬灭类型为动态淬灭,随着烟碱浓度增加,碰撞增加,GIh 荧光寿命衰减更快,表现为GIh荧光寿命减小;若S型/R型烟碱与GIh 之间的淬灭类型为静态淬灭,烟碱和GIh 形成无荧光或弱荧光复合物,不会改变GIh 激发态的荧光寿命。图4为加入S型/R型烟碱后GIh 的荧光衰减曲线,可知,S型和R型烟碱加入后,均未使GIh 的荧光寿命发生较为明显的变化。此外为了对结果进行定量分析,通过双指数迭代拟合(Bi-exponential iterative fitting)处理该体系的时间分辨荧光衰减数据,见公式(3)[14-15],结果见表2。

使用卡方检验(χ2)评估拟合结果的性能,若χ2<1.3,则拟合结果在可接受的容忍区间内。通过荧光衰减时间(τ1、τ2、τ3)和正交化指前因子(α1、α2、α3)可计算其平均荧光寿命(τ)。由表2 可知,χ2<1.15,表明拟合结果可信。PBS(pH=7.4)缓冲溶液中荧光衰减曲线拟合荧光寿命参数见表2。空白GIh 的加权平均荧光寿命为2.13 ns,分别加入蛋白与配体的物质的量比为1∶160 的S型、R型烟碱后,GIh 的加权平均荧光寿命为2.01 和1.94 ns。S型/R型烟碱-GIh 作用体系未发生动态淬灭,结合图4 可以确定S型/R型烟碱与GIh 作用形成有非荧光或弱荧光复合物。若将仪器误差考虑在内,并除去高浓度S型/R型烟碱与蛋白形成复合物的荧光寿命的影响,空白GIh 的荧光寿命未变。因此,进一步明确S型/R型烟碱与GIh 之间的淬灭机理均为静态淬灭。

图4 S 型/R 型烟碱与GIh 相互作用的时间分辨荧光Fig.4 Time-resolved fluorescence of S/R-nicotine and GIh

表2 S 型/R 型烟碱与GIh 体系的荧光衰减曲线拟合参数Tab.2 Fitting parameters of fluorescence lifetime curve of S/R-nicotine and GIh system
2.2 结合常数及结合位点数
当S型/R型烟碱与GIh 之间的淬灭机理均为静态淬灭时,假定小分子配体S型/R型烟碱在GIh上有n个相同且独立的结合位点,那么荧光强度、淬灭剂的浓度与结合常数及结合位点数之间的关系符合双对数方程,即修正过的Stern-Volmer 方程,也称为双对数曲线[16-17]。

式中:Ka为小分子配体与蛋白的结合常数,L/mol;n(斜率)表示结合位点数。lg[(F0-F)/F0]对lg[Q]的拟合曲线见图5,计算结果见表3。从Ka值分析,S型和R型烟碱与GIh 形成基态复合物的能力均较弱,说明烟碱不易与GIh 发生结合,或生成烟碱-GIh 复合物的稳定性差。结合常数均表现出随温度升高而增加的趋势,表示升高温度均有利于复合物的生成。同时可以发现在两个温度下,S型烟碱与GIh 的结合常数均比R型烟碱强,说明在模拟人体环境下,S型烟碱更易与GIh 发生结合并形成基态复合物。

图5 不同温度下S型和R型烟碱-GIh体系的lg[(F0-F)/F0]对lg[Q]拟合曲线Fig.5 Fitting curves of lg[(F0-F)/F0]to lg[Q]for S/R-nicotine-GIh systems at different temperatures

表3 不同温度下S 型/R 型烟碱与GIh 结合的相关参数Tab.3 Binding constants of S/R-nicotine and GIh at different temperatures
2.3 作用力类型
有机小分子与蛋白质之间的结合依赖弱的非共价作用力,其类型主要包括氢键、静电作用、疏水作用和范德华力等[18]。Ross 和Sun 根据大量的实验和理论[19-20],总结出了判断蛋白质与小分子结合作用力类型与热力学函数之间的关系。由Van’t Hoff 方程(5)和Gibbs-Helmholtz 方程(6),可根据不同温度下结合常数的变化计算得到有机小分子与蛋白质的相互作用热力学参数。

式中,T为实验温度,K;Ka为相应温度下的结合常数,L/mol;R 为摩尔气体常数,J/(mol·K);ΔH为焓变,kJ/mol;ΔS为熵变,J/(mol·K);ΔG为吉布斯自由能,kJ/mol。
在温度变化不大时,一般认为ΔH为恒定值,分子间的相互作用力类型可由ΔS判断:ΔH<0,ΔS>0,为静电作用力;ΔH>0,ΔS>0,为典型的疏水作用力;ΔH<0,ΔS<0,为氢键和范德华力[18,21]。S型/R型烟碱与GIh 作用体系的Van’t Hoff 拟合曲线如图6 所示,拟合结果列于表4。ΔG为负值表明S型烟碱和R型烟碱与GIh 的相互作用是一个自发的过程,且ΔH、ΔS均为正值,表明疏水作用力在该相互作用体系的结合中占主导地位。

图6 S型/R型烟碱与GIh作用体系的Van’t Hoff拟合曲线Fig.6 Van’t Hoff fitting lines of the interaction system of S/R-nicotine and GIh
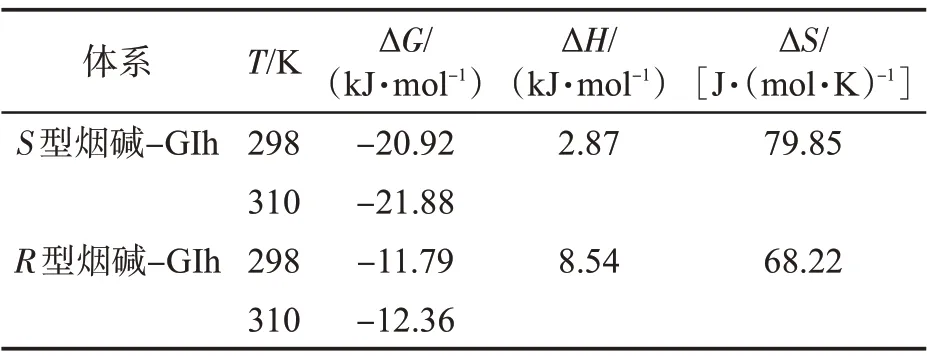
表4 不同温度下S 型/R 型烟碱与GIh 结合的相关参数Tab.4 Thermodynamic parameters of S/R-nicotine and GIh at different temperatures
2.4 S型/R型烟碱与GIh结合对构型和构象的影响
当S型/R型烟碱与GIh 发生相互作用时,由于分子间或分子内作用力的改变,会导致蛋白的二级或三级结构发生改变,进而影响蛋白质的整体构象。本实验中,利用同步荧光光谱、三维荧光光谱和圆二色光谱分析了由S型/R型烟碱引起的GIh 的微环境变化和结合引起的烟碱构型的改变。
(1)同步荧光光谱
同步荧光光谱同时扫描激发和发射两个单色器波长,得到荧光信号强度与激发波长(或发射波长)相对应的荧光谱图。一般按扫描方式不同,分为恒波长、恒能量、恒基体和可变角法[22]。在有机小分子与蛋白质结合过程中,常用恒波长法,设定发射波长对激发波长的增数恒定(即Δλ=λem-λex,为常数),该增数不同,会导致同步荧光光谱反映出蛋白质分子内源性荧光发色团氨基酸残基周围不同的微环境,例如当Δλ=60 nm 时表现为Trp 氨基酸残基的荧光;Δλ=15 nm 时表现Tyr 氨基酸残基的光谱特征。该方法的优势在于将内源性荧光发色基团(对蛋白质而言,为Trp、Tyr 和Phe)的峰谱重叠从发射峰中区分出来,能简明观测到有机小分子的进攻对蛋白质特定氨基酸残基周围微环境的影响。
图7 为S型/R型烟碱与GIh 作用的同步荧光谱图。当Δλ=15 nm 时,滴加S型/R型烟碱并未看到两个同步荧光峰有明显位移,表明GIh 的发色团微环境(疏水或亲水性)未受S型/R型烟碱加入的影响。当Δλ=60 nm 时,在测试浓度范围内S型/R型烟碱的加入使GIh 在280 nm 处的同步荧光峰轻微降低且有一定程度的红移;而在350 nm 前后的同步荧光峰表现出明显的荧光增强现象和红移,表明S型/R型烟碱的加入主要对色氨酸残基本身的荧光和周围微环境产生明显影响,增加了色氨酸残基周围的极性并降低了疏水性。且通过对比两种烟碱异构体可以发现,S型烟碱对色氨酸和酪氨酸残基均有影响,而R型烟碱主要对色氨酸周围微环境影响较大。
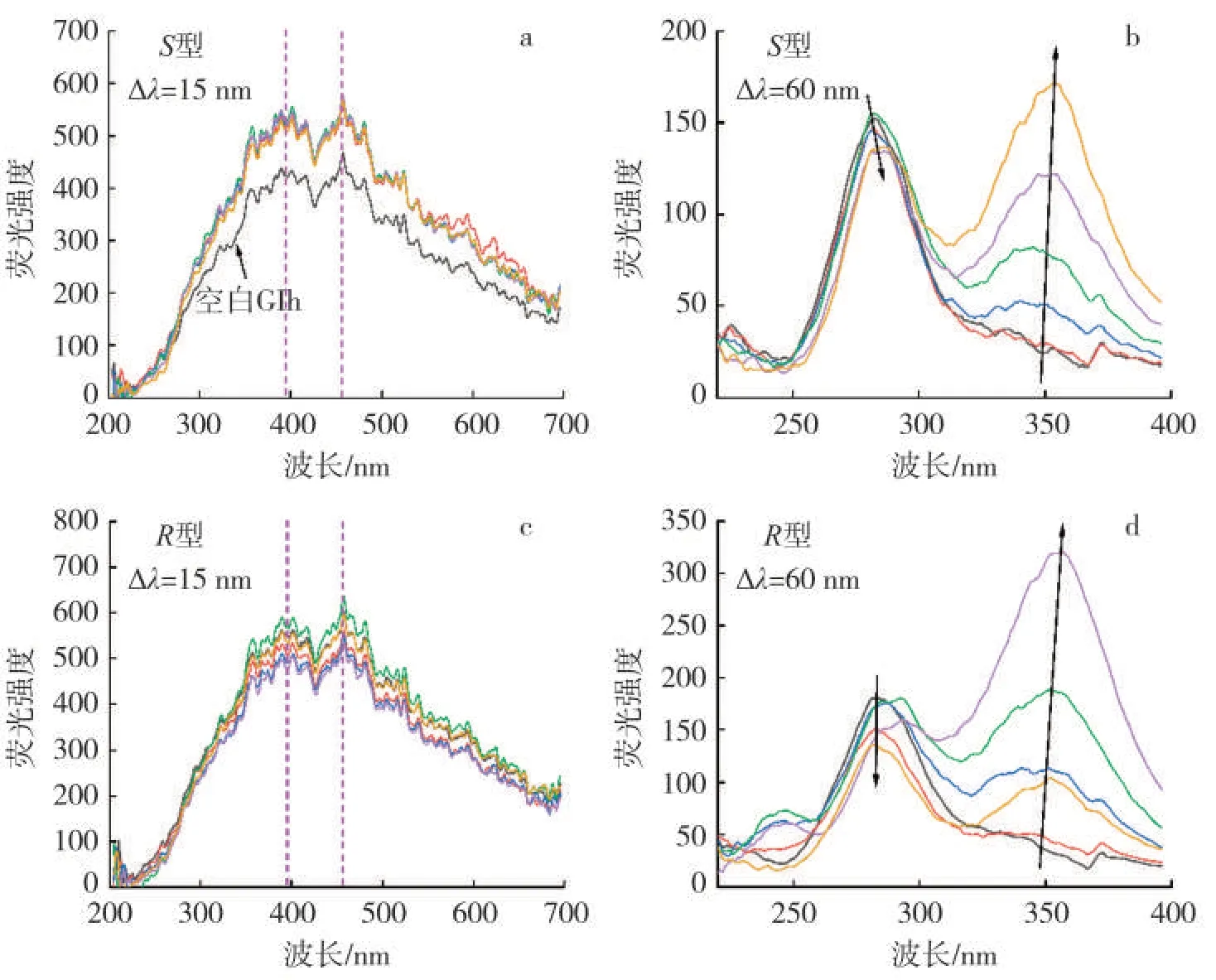
图7 Δλ=15、60 nm 时不同S 型/R 型烟碱浓度下GIh 的同步荧光光谱图Fig.7 Synchronous fluorescence spectra of S/R-nicotine and GIh at Δλ=15,60 nm
(2)三维荧光光谱
三维荧光是通过固定激发(或发射)波长来扫描发射(或激发)波长得到荧光强度随波长变换的二维平面图。三维荧光技术同时考虑激发和发射两个函数的变化,能够获得两个波长同时变化的荧光图谱,绘制得到的立体三维投影图分别以x、y、z轴作为发射波长(λex)、激发波长(λem)和荧光强度,可直接观察到蛋白特征峰位置和高度的光谱学特性,并根据λex,λem和荧光强度及峰形变化等参数考察蛋白质的构象变化[23]。在三维荧光谱图的特征峰为二倍锐利散射峰Peak A(λex=2λem),锐利散射峰Peak B(λex=λem),蛋白多肽骨架特征峰Peak 1(π→π*跃迁引起,λex/λem=225 nm/340 nm附近)以及Trp 和Tyr 氨基酸残基n→π*跃迁峰Peak 2(λex/λem=280 nm/350 nm 附近)[24]。该荧光法得到的蛋白质构象的荧光信息相对全面。
图8 为空白GIh 和加入S型/R型后的烟碱-GIh 体系的三维荧光的二维轮廓图。S型和R型烟碱的加入使Peak 1 分别下降了约1.45%和9.46%,变化很小,且斯托克斯(Stokes)位移几乎未移动,表明烟碱与GIh 发生了结合,但基本不影响蛋白多肽骨架。对于Peak 2 来说,S型和R型烟碱的加入分别使荧光强度增加了64.07%和96.13%,并伴有较大的斯托克斯位移(表5),说明对Trp 和Tyr 氨基酸残基的微环境影响较大,且R型烟碱的影响更大。该结果与同步荧光结果一致,不仅能证明蛋白的构象变化,也能辅助说明同步荧光光谱结果的可信度。

表5 GIh 和S/R 型烟碱-GIh 体系的三维荧光光谱参数Tab.5 Three-dimensional fluorescence spectrum parameters of GIh and S/R-nicotine-GIh systems

图8 烟碱-GIh 体系三维荧光的二维轮廓谱图Fig.8 Two-dimensional fluorescence profile of GIh and S/R-nicotine-GIh systems obtained from three-dimensional fluorescence
(3)圆二色光谱法
圆二色谱法从1960 年开始被广泛用于蛋白质、多肽等生物大分子的二级结构信息研究。其测试原理是利用化合物使平面偏振光变成椭圆偏振光的圆二色性[25]。对于蛋白质而言,其中的不对称氨基酸残基提供了刚性的肽链骨架和自由旋转的α-碳侧链,氨基化合物基团经偏振光后,会在远紫外区域波段存在n→π*和π→π*跃迁,从而影响多肽骨架的几何结构,蛋白质由于氨基酸序列及氨基酸残基周围微环境的不同呈现出不同的二级结构形态,扫描样品圆二色谱(蛋白质样品多为190~260 nm 远紫外区域),可得到二级结构的不同组成部分[25-26]。例如,α-螺旋的在190 nm 附近(π→π*)有一个较高正峰,208 nm(π→π*)和220 nm(n→π*)附近有两个程度相近的负峰;β-折叠会随蛋白质主螺旋结构的不同而产生不同的方向性,故特征峰型及位置会有所不同,多数在195~202 nm 有正峰信号,在215~220 nm 有负峰信号;β-转角在180~190 nm 有一个宽幅吸收带(常因溶液效应而在实际图谱上观察不到),200~205 nm(π→π*)和225 nm(n→π*)有负峰;而无规则卷曲构象则在200 nm 附近有负信号[27-28]。
由图9 可明显看出,S型和R型烟碱有明显的圆二色性,因此,在为了消除烟碱的影响,对反应后的样品峰进行了差谱处理。对比空白S型/R型烟碱及其差谱峰(图9a)可以发现,S型和R型一直是呈对称分布的,且差谱后的峰与空白峰相比呈现倒峰关系,具有一定的规律性。原因可能是S型和R型烟碱与GIh 之间发生相互作用后两种构型的烟碱发生异构化,在结合中发生了构型的翻转,这表明烟碱与生物大分子的结合可能是由构型翻转诱导的[29]。此外,图9b 显示的是单独GIh的圆二色图谱,可以看到GIh 在测试范围(190~280 nm)内均呈现负吸收,且在208 和212 nm 处有两个负蜂,这是α-螺旋的特征峰,属于螺旋结构中肽链上n→π*和π→π*的跃迁。用平均残基椭圆率(Mean residueellipticity,MRE)计算圆二色谱结果,其单位为deg·cm2·dmol-1,计算公式如下:

图9 烟碱-GIh 体系的圆二色光谱图Fig.9 Circular dichroism of nicotine-Gih system

式中:cp是蛋白的浓度,mol/L;n为蛋白的氨基酸残基个数,17 个;l为测试皿的光径,0.1 cm。GIh 二级结构中α-螺旋质量百分比的计算式为:

计算结果显示,GIh 的α-螺旋的质量百分比约为38.83%。虽然目前仍未得到GIh 的单晶数据,但从CD 结果可以看出,GIh 的二级结构中含有一定量的α-螺旋结构。由于GIh 的分子量很小,圆二色信号较弱,加入两种构型的烟碱后主要显示出烟碱的特征吸收峰。因此,无法通过圆二色光谱法来研究S型和R型烟碱与GIh 之间的结合对蛋白二级结构的影响。
3 结论
①两种构型的烟碱与GIh 之间均存在由疏水作用力占主导的较弱的相互作用,S型烟碱与GIh间的结合强度略强于R型,且均对温度比较敏感,一定程度提高温度有利于两种构型的烟碱与GIh间的结合。②S型/R型烟碱对GIh 的荧光淬灭机理相同,均为静态淬灭方式。③两种构型的烟碱作用于GIh 时均会引起一定程度的氨基酸残基周围微环境的改变,且CD 结果显示在与GIh 结合时具有构型翻转的现象,表明烟碱构型对于与GIh的结合具有重要影响。
