黄腐酸与微生物菌剂协同对烟草青枯病及根际土壤细菌群落的影响
2021-10-09施河丽向必坤彭五星尹忠春
施河丽,向必坤,左 梅,彭五星,尹忠春,王 瑞,谭 军*
1.湖北省烟草公司恩施州公司烟叶科技中心,湖北省恩施市市府路65 号 445000
2.湖北省烟草公司恩施州公司宣恩县烟叶分公司,湖北省宣恩县建设路36 号 445500
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的一种易感染、传播快、危害极大的土传细菌性病害[1-2]。烟草青枯病的发生是多种因素相互影响、相互作用的结果,长期连作及化学肥料的大量使用导致土壤出现严重退化是引起烟草青枯病大面积发生的根本原因,具体表现为土壤板结、酸化严重、养分供应失调、物理性状变差、微生态环境失衡等[3-5]。土壤微生态是个复杂的系统,土壤、微生物和植物3 者均可对土壤中微生物的组成、数量、群落结构及相互作用等造成影响。研究表明,土壤微生物多样性、群落结构和微生物种群间相互作用的改变显著影响植物健康[6-7],可通过施用微生物菌剂调控土壤微生态,改善土壤环境,进而达到对土传病害的有效防治[8]。黄腐酸作为土壤改良剂,是土壤中最好的腐殖酸成分,也是形成土壤团粒结构的核心物质[9],有改善土壤理化性质,提高土壤肥效,促进植物生长,增强植物抗逆性,增加产量的作用[10],已被广泛应用于小麦、玉米、棉花等多种作物的种植中[11-12]。黄腐酸有羟基、羧基、苯羧酸等基团,这与一些苯氧羧酸类、酚类农药的有效成分相同,具有一定的抑菌抗病毒作用[13],可为有益微生物菌群创造良好的生存环境。因此,通过施用黄腐酸可实现某些植物病害的防控。Afifi 等[14]发现,喷施浓度为150 mg/L 黄腐酸显著降低了黄瓜枯萎病病原体生长速度和病害的严重程度;Giovanardi等[15]研究表明,黄腐酸可用于桃溃疡病的防治,并且可促进土壤中微生物群落的发育;赵世元[16]研究表明,大田喷施10 mmol/L 的黄腐酸60 d 后仍对烟草青枯病有较好的防控效果,其相对防效可达35.64%。然而,关于黄腐酸与微生物菌剂协同应用于烟草青枯病防治的研究则鲜见报道,其对烟株根际土壤细菌群落的影响也不明确。本文中通过研究黄腐酸与微生物菌剂协同对烟草青枯病的防治效果及对根际土壤细菌群落的影响,旨在为土壤改良剂和微生物菌剂能更广泛地应用于烟草青枯病的防治提供依据。
1 材料与方法
1.1 试验区概况
试验于2019 年在湖北省恩施土家族苗族自治州宣恩县椒园镇锣圈村8 组进行。土壤类型为恩施烟区具有代表性的山地黄棕壤,土壤质地为壤土。试验开始前耕层(0~20 cm)土壤的基本理化性质:土壤pH 5.37(水土体积比2.5∶1)、有机质26.72 g/kg、碱解氮149.11 mg/kg、有效磷24.73 mg/kg和速效钾109.58 mg/kg。
1.2 试验材料
供试烤烟品种为云烟87。供试黄腐酸为褐色粉状,有机质、黄腐酸和氨基酸含量(质量分数,下同)分别为≥60%、45%和6%,pH 5.0~6.0,N、P2O5和K2O 含量分别为3%、0.5%和12%。供试微生物菌剂为防治烟草青枯病的复合芽孢杆菌,规格为100 g/袋,有效活菌数≥2×108CFU/g。
1.3 试验设计
共设置4 个处理,包括MT1(对照):清水;MT2:微生物菌剂1.5 kg/hm2;MT3:微生物菌剂1.5 kg/hm2+黄腐酸22.5 kg/hm2;MT4:黄腐酸22.5 kg/hm2。随机区组排列,3 次重复,共计12 个小区。每小区5 行,行距1.20 m,株距0.55 m,每行种烟12 株。
按当地常规施肥:有机肥(N、P2O5和K2O 含量分别为1.0%、1.5%和2.5%)900.0 kg/hm2,烟草专用复合肥(N、P2O5和K2O 含量分别为8.0%、16.0%和24.0%)900.0 kg/hm2,磷肥(P2O5含量为12.0%)375.0 kg/hm2,硝铵磷肥(N 和P2O5含量分别为30.0%和6.0%)67.5 kg/hm2,硫酸钾(K2O 含量为50%)150.0 kg/hm2。有机肥、烟草专用复合肥和磷肥作为底肥,硝铵磷肥作为提苗肥,硫酸钾作为追肥;4 月5 日施肥后起垄;4 月28 日移栽。
移栽后25 d,MT1 处理中将清水按0.1 kg/株,淋至根部;MT2 处理中将微生物菌剂按0.6 kg/hm2兑水1 500 kg,每株烟0.1 kg,淋至根部;MT3 处理中将微生物菌剂按0.6 kg/hm2和黄腐酸按9 kg/hm2混合兑水1 500 kg,每株烟0.1 kg,淋至根部;MT4处理中将黄腐酸按9 kg/hm2兑水1 500 kg,每株烟0.1 kg,淋至根部。然后围兜、封口。
移栽后40 d,MT1 处理中将清水按0.15 kg/株;MT2 处理中将微生物菌剂按0.9 kg/hm2兑水2 250 kg,每株烟0.15 kg;MT3处理中将微生物菌剂按0.9 kg/hm2和黄腐酸按13.5 kg/hm2混合兑水2 250 kg,每株烟0.15 kg;MT4 处理中将黄腐酸按13.5 kg/hm2兑水2 250 kg,每株烟0.15 kg;以上处理均在离烟株3~5 cm 处打15 cm 深的孔施入。
1.4 试验方法
1.4.1 田间病害调查
按照GB/T 23222—2008《烟草病虫害分级及调查方法》[17]调查每个小区的发病株数及发病等级,计算发病率和病情指数。根据青枯病的发生情况,烟苗移栽后每隔30 d 调查1 次,连续调查4次以上。发病率和病情指数计算公式如下:

1.4.2 田间取样
2019 年9 月中旬,烟叶采收结束后,按S 型五点采样法,每小区选取5 株烟,去掉0~2 cm 表层土壤,挖出烟株根系,去除较大土壤团块,收集附着在烟株根系表面0~4 mm 的土壤,混合均匀后放入自封式取样袋中,带回实验室置于-80 ℃冰箱保存。
1.4.3 土壤微生物高通量测序分析
对土壤样品的基因组DNA 进行提取,以稀释后的基因组DNA 为模板,采用引物515F(5′-GTGC CAGCMGCCGCGGTAA-3′),806R(5′-GGACTAC HVGGGTWTCTAAT-3′)对16S V4 区进行扩增。PCR 扩增产物经2%(质量分数)琼脂糖凝胶电泳检测,之后使用德国Qiagen 公司的胶回收试剂盒回收目的条带产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit(美国Illumina 公司)建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,文库合格后,使用NovaSeq6000(美国Illumina 公司)进行上机测序。本研究中的样品基因组DNA 的提取、PCR 扩增、PCR 产物的混样和纯化、文库构建、NovaSeq 上机测序和生物信息分析均由北京诺禾致源科技股份有限公司完成。
1.4.4 数据处理
首先对原始数据用FLASH 软件(Version 1.2.7)拼接、Qiime 软件(Version 1.9.1)过滤、VSEARCH 软件去除嵌合体后,得到最终的有效数据。利用Uparse 软件对所有样本的全部有效数据进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units,操作分类单元)。对OTUs 序列进行物种注释,用Mothur 法与SILVA132[18]的SSUrRNA 数据库[19]进行物种注释分析,获得分类学信息并分别在各个分类水平统计各样本的群落组成。使用Qiime 软件(Version 1.9.1)计算观测物种数(Observed_species)、文库覆盖率(Goods_coverage)、Chao 1 指数、ACE 指数、香农指数(Shannon index)、辛普森指数(Simpson index)等多样性指数;使用R 软件(Version 2.15.3)绘制韦恩(Venn)图、主坐标分析(PCoA)图;使用Qiime 软件(Version 1.9.1)计算Unifrac 距离、构建UPGMA 聚类树[20];使用Excel 2010 软件对相对丰度数据进行统计分析,绘制相对丰度柱状图;LEfSe 分析[21]时使用LEfSe 软件,默认设置LDA Score 的筛选值为4;部分表格数据整理与分析采用Excel 2010 及SPSS Statistics 22.0 软件完成。
2 结果与分析
2.1 黄腐酸与微生物菌剂协同对烟草青枯病的防效
不同处理的烟草青枯病发病情况如表1 所示,烟草青枯病在移栽60 d 后开始出现,移栽90 d 后进入盛发期,移栽120 d 后达到高峰。移栽60 d 和90 d 后,烟草青枯病发病率和病情指数在不同处理间差异不显著;移栽120 d 后,MT2、MT3 和MT4处理的烟草青枯病发病率和病情指数均显著低于MT1 处理,其中MT3 处理的发病率和病情指数最低,较MT1 处理分别降低了49.32%和64.00%。从图1 可以看出,移栽120 d 后,MT1 处理的烟株已无烟叶可以采收,而MT2、MT3 和MT4 处理烟株的中上部叶片还可继续采收,其中MT3 处理的可采烟叶数最多。表明黄腐酸与微生物菌剂协同对烟草青枯病有较好的防治效果。

图1 田间烟株生长情况(移栽后120 d)Fig.1 Growth states of tobacco plants in fields(120 d after transplanting)

表1 不同处理的烟草青枯病发病情况①Tab.1 Incidence of tobacco bacterial wilt under different treatments
2.2 黄腐酸与微生物菌剂协同对根际土壤细菌群落的影响
2.2.1 不同处理的根际土壤细菌群落OTU 特异性分析
对不同处理的根际土壤细菌群落(图2)比较发现,MT1、MT2、MT3 和MT4 处理的共有OTUs数量为2 524 个,MT2、MT3 和MT4 处理较MT1 处理OTUs 总数分别增加了2.28%、13.30% 和12.02%,其中以MT3 处理OTUs 总数增加最多;MT1、MT2、MT3 和MT4 处理特有OTUs 数量分别为155、181、334 和274 个,分别占各处理样本OTUs 总数的4.12%、4.71%、7.84%和6.51%,其中以MT3 处理特有OTUs 数量最多、占比最大。表明黄腐酸与微生物菌剂协同可增加根际土壤细菌群落OTUs 总数和特有OTUs 数量。
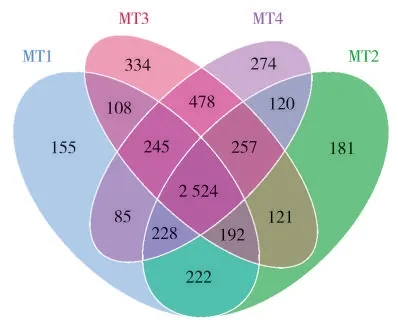
图2 不同处理的根际土壤细菌群落韦恩图Fig.2 Venn diagram of bacterial community in rhizosphere soil under different treatments
2.2.2 不同处理的根际土壤细菌群落多样性
2.2.2.1 α多样性
对不同处理根际土壤细菌群落进行6 种α多样性指数计算,由表2 可知,观测物种数(Observed_species)、香农指数(Shannon index)和辛普森指数(Simpson index)在不同处理间差异达到显著水平。MT3 处理的观测物种数、香农指数和辛普森指数显著高于MT1 处理,较MT1 处理分别增加了13.60%、8.37%和0.61%;MT3 处理的香农指数和辛普森指数显著高于MT2 处理,较MT2处理分别增加了6.86%和0.61%。MT4 处理的香农指数和辛普森指数显著高于MT1 处理,较MT1处理分别增加了6.27%和0.51%;MT4 处理的香农指数和辛普森指数显著高于MT2 处理,较MT2 处理增加了4.79%和0.51%。α多样性分析结果表明,黄腐酸与微生物菌剂协同可显著提高根际土壤细菌群落的多样性。

表2 不同处理的根际土壤细菌群落α多样性指数Tab.2 Alpha diversity indexes for bacterial in rhizosphere soil under different treatments
2.2.2.2 β多样性
基于Weighted Unifrac 距离对样品进行主坐标分析(PCoA),以了解根际土壤细菌群落结构的变化。由图3 可知,第一主坐标成分(PC1)和第二主坐标成分(PC2)的贡献率分别为59.96%和21.09%,累计贡献率达81.05%。不同处理的样本点在PC 轴上分布有差异,MT1 和MT2 处理的样本点在主坐标分析图中的距离较接近,表明MT1 和MT2 处理的物种组成较为相似。

图3 不同处理下根际土壤细菌群落多样性的主坐标分析Fig.3 PCoA analysis of bacterial community in rhizosphere soil under different treatments
以Weighted Unifrac 距离矩阵做UPGMA 聚类分析,对不同处理进行等级聚类(图4),发现MT1和MT2 处理的各菌群丰度与MT3 和MT4 处理的各菌群丰度被聚类为2 个分支,表明黄腐酸与微生物菌剂协同对根际土壤各菌群的丰度有较大影响。

图4 不同处理的UPGMA 聚类树(门水平)Fig.4 UPGMA clustering tree under different treatments(phylum level)
2.2.3 不同处理的根际土壤细菌群落结构分析
物种相对丰度前10 位的细菌门见图5,各处理均以变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)为主要菌门,其相对丰度总和分别占各处理的83.51%(MT1)、83.03%(MT2)、80.05%(MT3)和82.06%(MT4)。物种相对丰度前10 位的细菌属见图6,Chujaibacter属、鞘氨醇单胞菌属(Sphingomonas)和罗思河小杆菌属(Rhodanobacter)为各处理根际土壤的优势菌属,其相对丰度总和分别占各处理的27.63%(MT1)、27.91%(MT2)、15.47%(MT3)和20.36%(MT4)。使用LEfSe 分析不同处理根际土壤细菌群落中主要差异物种(P<0.05,LDA Score>4)(图7),在门水平上,变形菌门、酸杆菌门和拟杆菌门的相对丰度分别在MT2、MT3 和MT4 处理的根际土壤中显著增加;在属水平上,Chujaibacter属的相对丰度在MT1 处理根际土壤中显著增加。

图5 不同处理下根际土壤细菌群落的相对丰度(门水平)Fig.5 Relative abundance of bacterial community in rhizosphere soil under different treatments(phylum level)
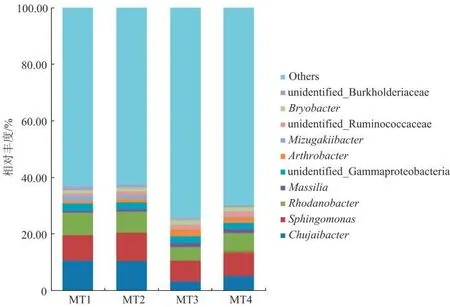
图6 不同处理下根际土壤细菌群落的相对丰度(属水平)Fig.6 Relative abundance of bacterial community in rhizosphere soil under different treatments(genus level)

图7 不同处理下差异物种的LDA 值分布柱状图Fig.7 Histogram of LDA value distribution of different species under different treatments
2.3 根际土壤细菌群落中与烟草青枯病发病相关的菌群分析
2.3.1 根际土壤细菌群落与烟草青枯病发病率和病情指数之间的相关性分析
对相对丰度前50 位的细菌属与烟草青枯病发病率、病情指数(移栽120 d 后)以及雷尔氏菌属(Ralstonia)相对丰度进行皮尔逊(Pearson)相关性分析,结果如表3 所示。未确定属的伯克氏菌科(unidentified_Burkholderiaceae)、未确定属的芽单胞菌科(unidentified_Gemmatimonadaceae)、链霉菌属(Streptomyces)、戴氏菌属(Dyella)、拟无枝酸菌属(Amycolatopsis)、未确定属的细菌(unidentified_Bacteria)和Jatrophihabitans属与烟草青枯病发病显著正相关,节杆菌属(Arthrobacter)、未确定属的瘤胃菌科(unidentified_Ruminococcaceae)、Bryobacter属、慢生根瘤菌属(Bradyrhizobium)、未确定属的毛螺菌科(unidentified_Lachnospiraceae)和寡养单胞菌属(Stenotrophomonas)与烟草青枯病发病显著负相关。雷尔氏菌属与烟草青枯病发病呈正相关关系,但未达到显著水平。雷尔氏菌属与未确定属的芽单胞菌科、链霉菌属、拟无枝酸菌属、Jatrophihabitans属和热酸菌属(Acidothermus)显著正相关。
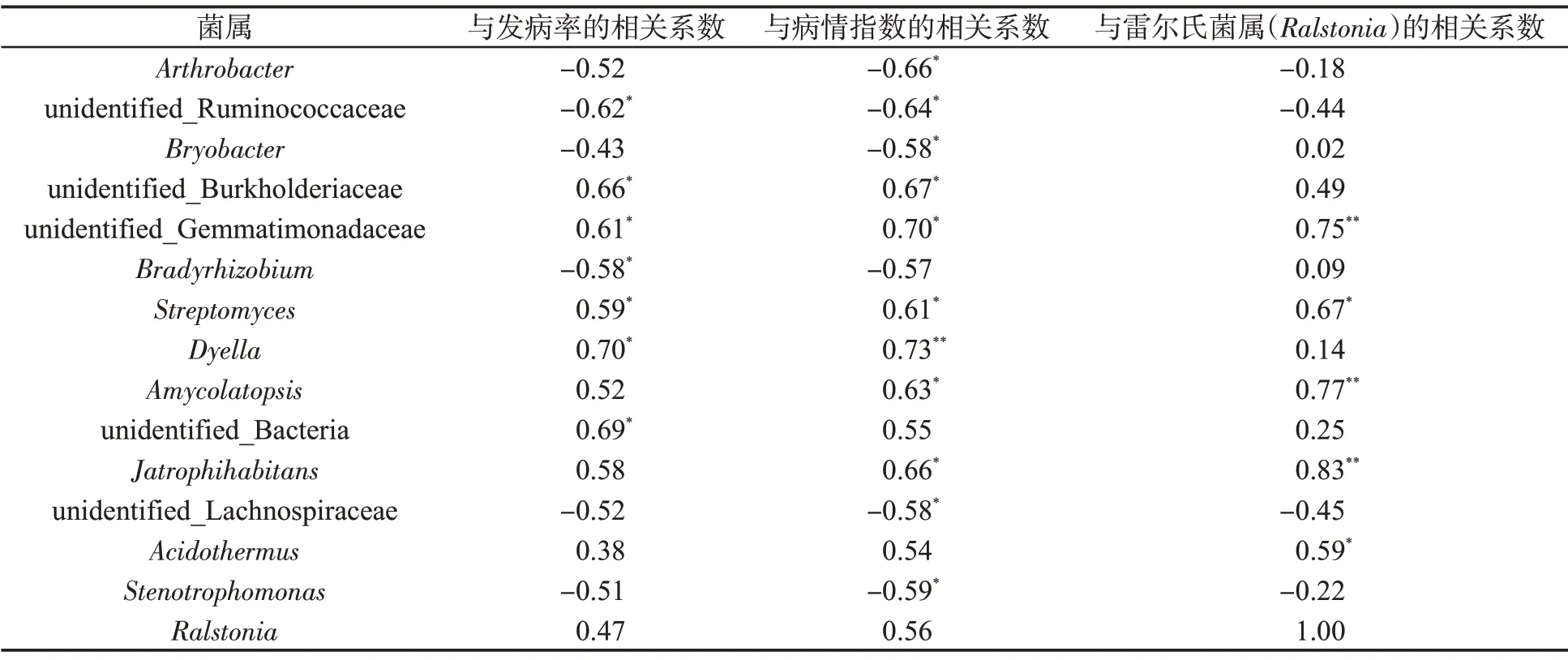
表3 根际土壤细菌与青枯病发病率和病情指数以及雷尔氏菌属之间的相关性①Tab.3 Correlations between bacteria in rhizosphere soil and bacterial wilt disease incidence and disease index,or Ralstonia
2.3.2 与烟草青枯病发病显著相关的菌属分析
由表4 可知,节杆菌属和寡养单胞菌属在MT3 和MT4 处理中的相对丰度显著高于MT1 和MT2 处理;Bryobacter属在MT3 处理中的相对丰度显著高于MT1 和MT2 处理;未确定属的伯克氏菌科和链霉菌属在MT1 处理中的相对丰度显著高于MT3 和MT4 处理;未确定属的芽单胞菌科在MT1 处理中的相对丰度显著高于MT3 处理;戴氏菌属在MT1 和MT2 处理中的相对丰度显著高于MT3 和MT4 处理。雷尔氏菌属的相对丰度在各处理中差异不显著,但在MT1 处理中最高。

表4 不同处理中与烟草青枯病发病显著相关菌属的相对丰度Tab.4 Relative abundances of genus significantly associated with bacterial wilt disease under different treatments
3 讨论
3.1 黄腐酸与微生物菌剂协同对根际土壤细菌群落结构的影响
本研究中发现,黄腐酸与微生物菌剂协同处理有增加根际土壤细菌群落OTUs 总数和特有OTUs 数量的趋势,同时可显著提高根际土壤细菌群落观测物种数、香农指数和辛普森指数等α多样性指数,这与前人的研究结果一致[22]。α多样性是对单样品的多样性分析,单从α多样性指数的角度并不能准确说明细菌群落发生了变化,因此,有必要对不同组间样品的细菌群落构成进行β多样性比较。本研究中对不同处理进行β多样性分析发现,未施用黄腐酸处理(MT1 和MT2)和施用黄腐酸处理(MT3 和MT4)的根际土壤细菌物种构成差异较大。对不同分类水平的细菌群落组成分析发现,黄腐酸与微生物菌剂协同处理可显著提高根际土壤中酸杆菌门的相对丰度,该菌门在土壤物质循环和生态环境构建过程中起到非常重要的作用[23]。黄腐酸与微生物菌剂协同可以促进土壤微生物的生长和繁殖,增加根际土壤细菌数量,提高根际土壤细菌群落多样性,有效改善根际土壤细菌的生态环境。
3.2 根际土壤细菌群落结构中与烟草青枯病发病相关的菌群
本研究中对与烟草青枯病发病显著相关的菌属进行分析发现,节杆菌属、寡养单胞菌属和Bryobacter属的相对丰度在黄腐酸与微生物菌剂协同处理中显著提高,且与烟草青枯病发病显著负相关。这些菌群有利于分解土壤有机质、促进碳循环[24]和养分转化吸收[25],为植物生长提供足够的营养,同时还可以降解有机污染物和吸附重金属[26],减轻其对根系的损伤,并抑制土传病原菌对植物生长的危害[27-28]。此外,未确定属的伯克氏菌科、未确定属的芽单胞菌科、链霉菌属和戴氏菌属的相对丰度在黄腐酸与微生物菌剂协同处理中显著降低,且与烟草青枯病发病显著正相关。链霉菌属(Streptomyces)被公认为最具价值的一种生防菌,目前已从土壤中筛选出多株可抑制青枯雷尔氏菌的链霉菌[29-31],本研究中链霉菌属的相对丰度在黄腐酸与微生物菌剂协同处理中显著降低的原因可能是其他致病性链霉菌属物种或腐生链霉菌属物种在根际土壤中聚集较少。田程等[32]研究发现戴氏菌属与枯萎病发病率呈显著正相关,与本研究结果一致。沈桂花[33]筛选出了18 个可作为潜在的抑制烟草青枯病的指示细菌类群,其中就包括了节杆菌属、寡养单胞菌属、Bryobacter属和戴氏菌属等。黄腐酸与微生物菌剂协同通过提高根际土壤中一些有益菌群的相对丰度和降低一些与病害发生呈正相关关系菌群的相对丰度来抑制烟草青枯病的发生。
本研究中还发现,雷尔氏菌属与烟草青枯病发病正相关,但不显著,其相对丰度在不同处理间差异也不显著;雷尔氏菌属(Ralstonia)在根际土壤中的相对丰度与未确定属的芽单胞菌科、链霉菌属、拟无枝酸菌属、Jatrophihabitans属和热酸菌属显著正相关。表明,黄腐酸与微生物菌剂协同对青枯病原菌的调节能力有限,可能通过调节一些与烟草青枯病发病相关的菌群或者与雷尔氏菌属相互作用的菌群,从而影响烟草青枯病的发生。植物疾病状态或健康状态通常不仅是病原体直接影响的结果,也是微生物群落相互作用间接影响的结果。越来越多的研究发现,植物土传病害的发生往往是由于土壤微生态失衡失调引起的[34-36]。
4 结论
移栽120 d 后,黄腐酸与微生物菌剂协同可显著降低烟草青枯病发病率和病情指数,降幅分别为49.32%和64.00%。黄腐酸与微生物菌剂协同可显著提高根际土壤细菌群落观测物种数、香农指数和辛普森指数,增幅分别为13.60%、8.37%和0.64%。黄腐酸与微生物菌剂协同根际土壤细菌群落结构发生了明显变化,可显著提高根际土壤中节杆菌属、寡养单胞菌属和Bryobacter属的相对丰度,同时显著降低未确定属的伯克氏菌科、链霉菌属、未确定属的芽单胞菌科和戴氏菌属的相对丰度。根际微生物的数量和种类与植物病害密切相关,调控根际土壤微生物可增强植物抵御病害的能力,合理施用土壤调节剂和微生物菌剂可调控根际土壤微生物多样性和群落结构,对烟草青枯病起到较好的防治效果。
