血清S100B、HIF-1α、NGB、AQP7在缺血性脑卒中患者中的表达
2021-10-08田媛媛耿德勤
田媛媛,耿德勤
(徐州医科大学附属医院,江苏 徐州 221000)
急性缺血性脑卒中可能引发永久性脑梗死,占脑卒中患者的70%~80%[1],发病早期主要表现为神经功能损伤症状,严重程度与梗死部位和梗死体积密切相关[2].静脉溶栓是目前治疗急性缺血性脑卒中最有效的手段,目前,临床上虽然已对溶栓禁忌证进行了严格筛选,但仍存在一定的出血转化率[3].探讨能够评估缺血性脑卒中患者病情严重程度和静脉溶栓后出血转化风险的血清分子标志物,对合理制定治疗方案、改善患者预后具有重要意义.S100蛋白参与细胞的增殖、分化、凋亡等多个方面,其功能尚未完全明确[4];目前研究[5]发现:S100蛋白表达水平能够反映胶质细胞功能,并调控复杂神经元活性.在大鼠缺血脑组织中可见缺氧诱导因子1α(HIF-1α)大量表达,并调节红细胞生成、葡萄糖代谢等生物过程[6].脑红蛋白(NGB)在体外培养的神经元中具有保护作用,能够降低缺氧对神经元的损伤[7].水通道蛋白7(AQP7)存在于线粒体内膜,能够调节脑组织能量平衡,与缺氧缺血性脑损伤大鼠脑组织水肿和神经细胞凋亡密切相关[8].目前,关于S100B、HIF-1α、NGB、AQP7蛋白在缺血性脑卒中患者中表达特点的研究仍十分少见.为此,本研究主要探讨了血清S100B、HIF-1α、NGB、AQP7在缺血性脑卒中患者中的表达情况.
1 对象与方法
1.1 研究对象
选择徐州医科大学附属医院2019年2月—2020年4月收治的缺血性脑卒中患者366例,其中,男216例,女150例,年龄52~78岁,平均(62.57±6.05)岁.根据脑梗死体积分为:小体积梗死组(<5 cm3)198例,中大体积梗死组(≥5 cm3)168例.根据静脉溶栓后24 h复查CT结果分为出血转化组82例,非出血转化组284例.静脉溶栓治疗前进行美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分,根据评分结果,NIHSS评分≤15分组301例,NIHSS评分>15分组65例.
入选标准:符合缺血性脑卒中临床表现,经头颅CT或MRI检查证实;首次发病,起病到入院在4.5 h内;入院检查无静脉溶栓禁忌证,接受溶栓治疗.
排除标准:有颅脑手术史;合并凝血功能异常、自身免疫性疾病;感染性疾病的患者.本研究经医院伦理委员会批准(批号:2019-LDH-08).
1.2 方 法
1.2.1 临床资料
静脉溶栓治疗前进行NIHSS评分,记录患者的空腹血糖、收缩压、舒张压、溶栓时间窗.梗死体积通过CT或MRI检查进行评估,计算公式:梗死体积(mm3)=梗死灶最大长度(mm)×最大垂直直径(横向,mm)×梗死层面数×5(mm)/2.
1.2.2 Western blot检测S100B、HIF-1α、NGB、AQP7的表达水平
静脉溶栓治疗前采集患者外周静脉血4 mL,使用蛋白提取试剂盒(北京金克隆生物科技有限公司)提取血清总蛋白,BCA试剂盒(北京鼎国昌盛生物有限公司)测定蛋白浓度,-80 ℃保存待测.取其中50 g蛋白样本,行浓度6%的SDS聚丙烯酰胺凝胶电泳2 h,聚偏二氟乙烯膜转模60 min.室温下使用浓度10%的脱脂奶粉封闭2 h,滴加鼠抗人S100B单克隆抗体(1∶500稀释)、鼠抗人HIF-1α单克隆抗体(1∶300稀释)、兔抗人NGB单克隆抗体(1∶500稀释)、鼠抗人AQP7单克隆抗体(1∶1 000稀释)、鼠抗人β-actin单克隆抗体(1∶1 000稀释),4 ℃孵育过夜,次日滴加对应的二抗:羊抗鼠IgG、羊抗兔IgG(1∶3 000稀释),室温下静置2 h,洗膜、显色、曝片后进行分析.
1.3 统计学分析
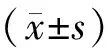
2 结 果
2.1 不同梗死体积组患者临床资料
中大体积梗死组患者NIHSS评分、收缩压、舒张压明显高于小体积梗死组,差异具有统计学意义(P<0.01);空腹血糖、溶栓时间窗在小体积梗死组与中大体积梗死组之间比较差异无统计学意义(P>0.05).见表1.
2.2 不同出血转化情况组患者临床资料
出血转化组患者NIHSS评分、空腹血糖、收缩压、舒张压、溶栓时间窗明显高于非出血转化组,差异具有统计学意义(P<0.01).见表2.
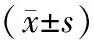
表1 不同梗死体积组患者临床资料Tab.1 Clinical data of patients with different infarct volumes
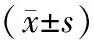
表2 不同出血转化组患者临床资料Tab.2 Clinical data of patients with different infarct volumes
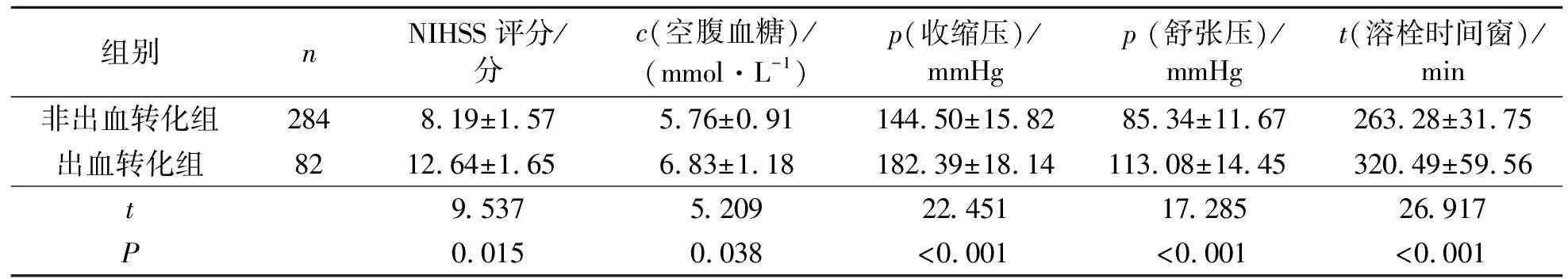
组别nNIHSS评分/分c(空腹血糖)/(mmol·L-1)p(收缩压)/mmHgp (舒张压)/mmHgt(溶栓时间窗)/min非出血转化组2848.19±1.575.76±0.91144.50±15.8285.34±11.67263.28±31.75出血转化组8212.64±1.656.83±1.18182.39±18.14113.08±14.45320.49±59.56t9.5375.20922.45117.28526.917P0.0150.038<0.001<0.001<0.001
2.3 不同梗死体积组患者血清S100B、HIF-1α、NGB、AQP7蛋白的表达水平
中大体积梗死组患者血清S100B、HIF-1α、NGB、AQP7蛋白表达水平明显高于小体积梗死组,差异具有统计学意义(P<0.01).见表3,图1.
2.4 不同出血转化情况组患者血清S100B、HIF-1α、NGB、AQP7蛋白的表达水平
出血转化组患者血清S100B、HIF-1α、NGB、AQP7蛋白表达水平明显高于非出血转化组,差异具有统计学意义(P<0.01).见表4,图2.
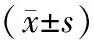
表3 不同梗死体积组患者血清S100B、HIF-1α、NGB、AQP7蛋白的表达水平Tab.3 Serum S100B,HIF-1α,NGB and AQP7 protein expression levels in patients with different infarct volumes
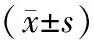
表4 不同出血转化情况组患者S100B、HIF-1α、NGB、AQP7蛋白的表达水平Tab.4 S100B,HIF-1α,NGB and AQP7 protein expression levels in patients with different hemorrhagic transformation groups
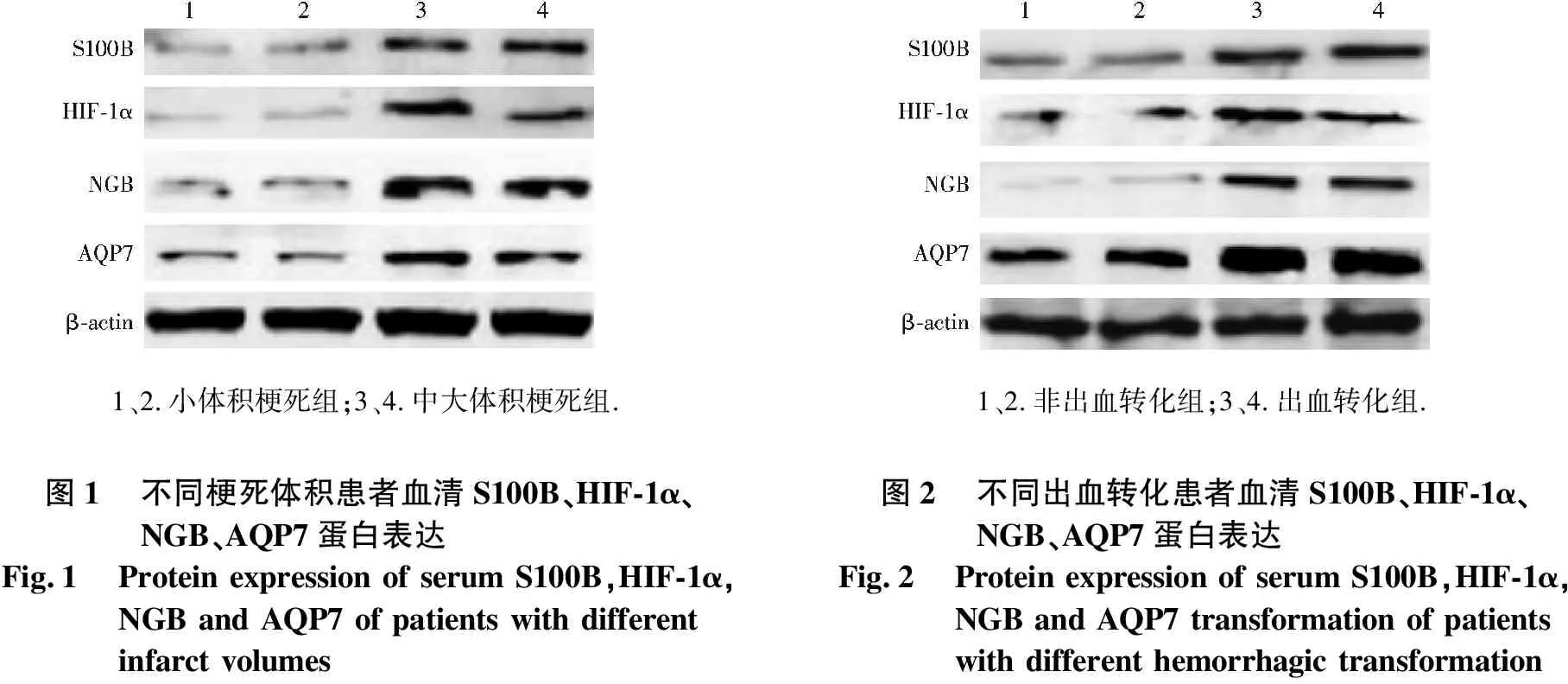
1、2.小体积梗死组;3、4.中大体积梗死组.图1不同梗死体积患者血清S100B、HIF-1α、NGB、AQP7蛋白表达Fig.1Protein expression of serum S100B,HIF-1α,NGB and AQP7 of patients with different infarct volumes1、2.非出血转化组;3、4.出血转化组.图2不同出血转化患者血清S100B、HIF-1α、NGB、AQP7蛋白表达Fig.2Protein expression of serum S100B,HIF-1α,NGB and AQP7 transformation of patients with different hemorrhagic transformation
2.5 不同NIHSS评分组患者血清S100B、HIF-1α、NGB、AQP7蛋白的表达水平
NIHSS评分>15分组患者血清S100B、HIF-1α、NGB、AQP7蛋白表达水平明显高于NIHSS评分≤15分组,差异具有统计学意义(P<0.01).见表5,图3.
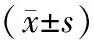
表5 不同NIHSS评分组患者S100B、HIF-1α、NGB、AQP7蛋白的表达水平Tab.5 S100B,HIF-1α,NGB and AQP7 protein expression levels in different NIHSS score groups
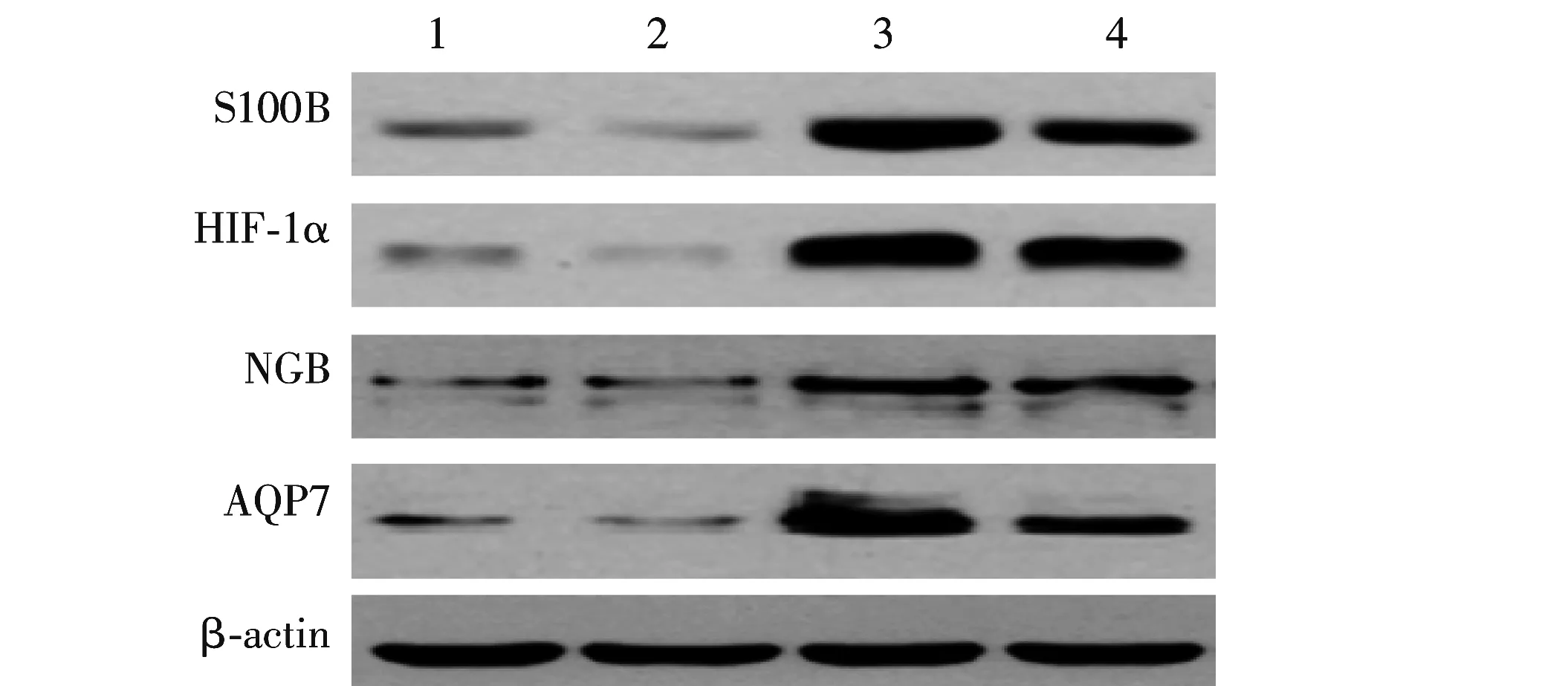
1、2.NIHSS评分≤15分组;3、4.NIHSS评分>15分组.图3 不同评分组患者血清S100B、HIF-1α、 NGB、AQP7蛋白表达Fig.3 Protein expression of serum S100B,HIF-1α,NGB and AQP7 of patients with different scores
3 讨 论
早期溶栓治疗是目前改善缺血性脑卒中患者预后的最有效手段,但受脑缺血再灌注损伤的影响,存在一定比例的溶栓后出血转化,导致羟自由基大量生成引发神经毒性,改变血脑屏障的通透性,出现脑水肿,增加缺血半暗带体积[9].本研究结果显示:中大体积梗死组患者NIHSS评分、收缩压、舒张压明显高于小体积梗死组;出血转化组患者NIHSS评分、空腹血糖、收缩压、舒张压、溶栓时间窗明显高于非出血转化组.提示NIHSS评分、收缩压及舒张压升高与梗死体积和溶栓后出血转化密切相关,同时空腹血糖和溶栓时间窗增加也会提高溶栓后出血转化的发生风险.
S100B蛋白主要由神经胶质细胞分泌,广泛分布于中枢神经系统中.本研究结果显示:中大体积梗死组患者血清S100B蛋白水平明显高于小体积梗死组,可能原因:随着梗死体积的增加,脑胶质细胞功能出现障碍,并且发生持续性凋亡,最终导致S100B蛋白外溢[10].因此,监测血清S100B蛋白水平变化有助于评估缺血性脑卒中患者梗死体积的变化情况;出血转化组患者血清S100B蛋白水平明显高于非出血转化组.S100B蛋白分子量较大,正常生理状态下无法通过血脑屏障,脑组织损伤时血脑屏障和脑细胞被破坏,S100B蛋白释放入血,血清S100B蛋白水平越高反映缺血性脑卒中患者出血转化程度越严重[11].HIF-1α是存在于哺乳动物体内的氧调节亚基,缺氧状态下水解HIF-1α的酶活性减弱,其在体内累积,启动机体对缺氧环境的适应性反应[12].目前对于HIF-1α的研究主要集中在基础研究领域,其在临床中的应用价值研究仍十分少见.本研究结果显示:随着梗死体积的增加,血清HIF-1α水平明显升高,且在出血转化组患者血清中的表达水平明显高于非出血转化组,可能原因:缺血性脑卒中梗死体积和出血严重程度与脑组织缺氧程度呈正相关,监测血清HIF-1α水平变化有利于对缺血性脑卒中患者的病情进行评估和溶栓方案的选择.
NGB是具有神经保护活性的蛋白,既往的动物实验和细胞学实验[13-14]均发现,急性缺血、缺氧状态下NGB水平明显升高,可能其在缺血再灌注损伤中发挥神经保护作用.在上述研究基础上,本研究对NGB在缺血性脑卒中患者中表达变化进行分析,结果显示:随着梗死体积的增加,患者血清NGB水平明显升高,且在出血转化组患者血清中的表达水平明显高于非出血转化组,说明NGB能够较好地评价缺血性脑卒中患者的梗死体积,预测溶栓治疗的预后情况.AQP家族广泛存在于人体多个脏器的细胞膜上,AQP9表达与脑水肿的关系已被研究证实[15],但AQP7与脑组织病理改变的关系的研究仍十分少见.相关研究[16]显示:AQP7与电解质紊乱密切相关.本研究结果显示:AQP7水平随着梗死体积的增加和溶栓后出血转化的发生明显提高,提示血清AQP7水平变化可用于评估缺血性脑卒中患者的病情严重程度和溶栓治疗出血转化风险.有研究[17]报道,灯盏乙素能够明显下调缺血性脑损伤大鼠脑组织模型的HIF-1α、AQP7表达,抑制神经细胞凋亡,降低大鼠脑水肿的发生率,因此,HIF-1α、AQP7在缺血性脑卒中患者中的协调作用有待于深入研究.目前,临床用于判断缺血性脑卒中患者病情严重程度的公认指标为NIHSS评分,为进一步提高研究结论的可靠性,本研究将缺血性脑卒中患者按照溶栓前的NIHSS评分分为NIHSS评分≤15分组(轻中度缺血性脑卒中)、NIHSS评分>15分组(重度缺血性脑卒中).本研究结果显示:NIHSS评分>15分组患者血清S100B、HIF-1α、NGB、AQP7蛋白表达水平明显高于NIHSS评分≤15分组,提示血清S100B、HIF-1α、NGB、AQP7蛋白表达水平与缺血性脑卒中患者病情严重程度密切相关,可用于临床对患者病情的评估.
综上所述,血清S100B、HIF-1α、NGB、AQP7在缺血性脑卒中患者中高表达,且与梗死体积、溶栓后出血转化发生率以及NIHSS评分明显相关,可用于缺血性脑卒中患者病情严重程度的动态监测和溶栓后出血风险的评估.
