急性髓系白血病微小残留病灶检测方法的建立及其应用
2021-10-08赵佳琪李伟静郑亮亮宋玉国
赵佳琪,李伟静,王 旭,郑亮亮,宋玉国,
(1.北华大学医学技术学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132011)
急性白血病(acute leukemia,AL)是造血干细胞的恶性克隆性疾病,骨髓中异常的原始细胞和幼稚细胞(即白血病细胞)大量增殖,同时抑制正常造血,其中,急性髓系白血病(acute myelogenous leuk- emia,AML)是成人多见的一类白血病.AML不是单一性疾病,包括AML伴有或不伴有重现性遗传学异常等多种类型,各型AML之间有不同的形态、免疫表型、遗传学和分子生物学特征.虽然应用规范、成熟的化疗方法能使大部分AML患者病情得到缓解,但是完全缓解(CR)率只能达到50%~80%[1],其他患者在3~5 a内复发,复发的原因是患者体内残留一定数量的白血病细胞,这部分细胞称为微小残留病灶(minimal residual disease,MRD)[2-3].MRD常用的检测方法主要有分子生物学和流式细胞术等方法,常用的分子生物学方法有PCR技术和新一代测序技术[4-6].许多文献[7-11]报道,基于多激光多通道流式细胞仪而建立起来的多参数流式细胞术(multiparameter flow cytometry,MP-FCM)检测MRD对于疾病的巩固治疗和预后判断具有重要的临床应用价值.本研究应用FCM对初诊患者进行白血病细胞免疫分型,以此确定白血病相关免疫表型(LAIPs),患者治疗后或复诊时,依据LAIPs建立个体化MRD检测方法,给临床治疗提供实验诊断学指标.
1 资料和方法
1.1 基本资料
23例AML患者均来源于北华大学附属医院血液科2019年1月—2020年12月的住院患者,其中,男11例,女12例,年龄26~71岁,平均(46.78±13.55)岁.按白血病诊断标准全部为AML病例,其中,M2患者13例,M3患者3例,M4患者7例.入组患者均签署知情同意书,本研究经医院伦理委员会审核批准.
1.2 主要仪器与试剂
NAVIOS流式细胞仪(Beckman公司,美国,三激光10色),可以识别10种荧光素;荧光标记单克隆抗体(Beckman公司,美国)
1.3 检测方法
标本采集:由临床医生采集骨髓穿刺液2 mL,收集在含EDTA-K2的真空采血管中,送流式细胞室检测.
荧光抗体标记:在流式细胞仪专用试管内加入所需的荧光抗体各10 μL,加入骨髓穿刺液100 μL,室温避光标记15 min;溶血及洗涤处理:溶解红细胞后,加入3 mL PBS混匀,1 100 r/min离心5 min,同样再洗涤1次,加入500 μL PBS,用300目尼龙网过滤处理,上机检测.本研究选择的23例白血病患者初诊时均行白血病免疫分型并确定LAIPs,做MRD检测所用荧光抗体要涵盖抗原跨系表达、抗原跨阶段表达,在读取数据时注意抗原过度、过低或缺失表达以及光散射异常等[12].
流式细胞仪检测MRD方案设定:依据白血病免疫分型时所确定的LAIPs,对每一位患者制定个体化的MRD检测方案,但所有患者检测方案中有一定数量的相同坐标图,包括以FS INT/FS PEAK为坐标设去粘连门、FS INT线性坐标/SS INT对数坐标设活细胞门、CD117/SS INT和CD34/SS INT圈原始细胞门.在每一个检测方案中,依据白血病细胞确定原则,计数白血病细胞数量,用该细胞数除以所检测的所有细胞数,即可计算出MRD的数量.
1.4 统计学分析
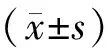
2 结 果
2.1 多参数流式细胞术检测MRD结果
应用多参数流式细胞术检测MRD,即在同一个测定管内加入多种所需抗体,同步检测多种抗原,便于分析细胞性质.本研究依据LAIPs的确定原则设计多参数流式细胞术检测MRD的具体方案.图1和图2是多参数流式细胞术检测MRD的典型方案.图1中图a是去粘连图,图b是选择活细胞图,图c是选择CD117+的幼稚细胞(G门),图d是G门内的细胞表达CD13和CD33的情况.
图2是多参数流式细胞术检测MRD抗原表达分析的典型图例.从图2 e可见,红色细胞高表达CD117、中度表达CD13,可能为异常的白血病细胞;蓝色细胞不表达CD117,强表达CD13,是正常粒细胞.从图2 f可见,红色细胞高表达CD117,强表达CD33.从图2 g可见,红色细胞表达CD117,而不表达CD15,证明是髓系早期细胞;从图2 h可见,红色细胞高表达CD33、中度表达CD13,符合髓系细胞特点;从图2 i可见,红色细胞中度表达CD13,不表达CD15;从图2 j可见,红色细胞高表达CD33,不表达CD11b,以上均证明该群细胞是髓系早期细胞,如果符合LAIPs的条件即可进行计数,并确定MRD数值.
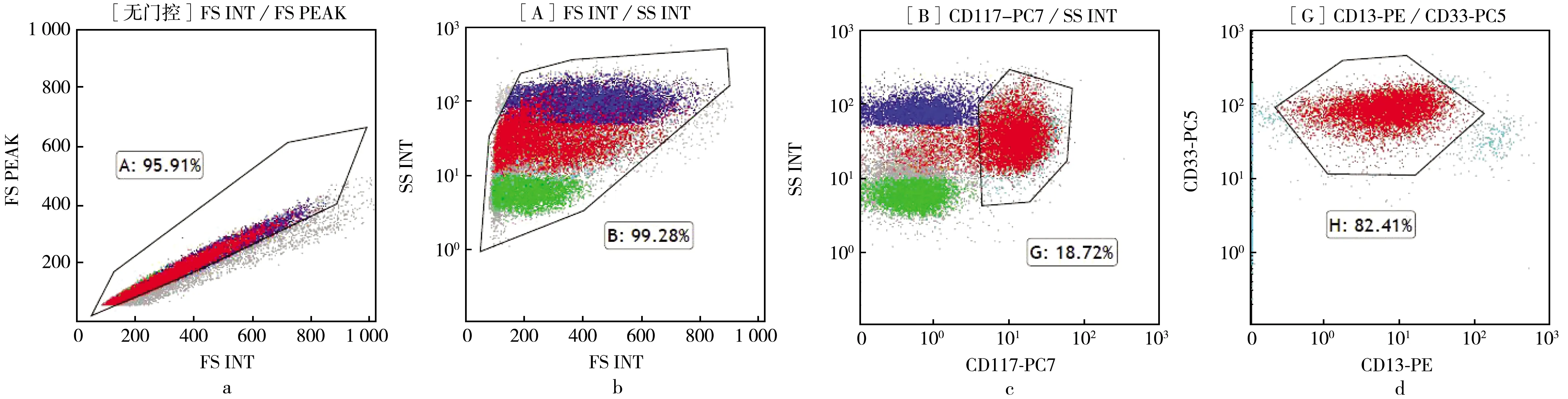
a.去粘连门;b.对A门内细胞进行分析;c.对B门内细胞进行分析;d.对G门内细胞进行分析.图1 多参数流式细胞术检测MRD设门方法Fig.1 Gating method for detection of MRD by multi parameter flow cytometry
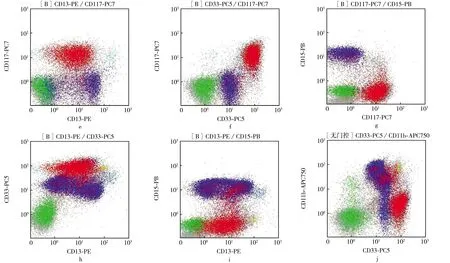
图2 多参数流式细胞术检测MRD抗原表达分析Fig.2 Analysis of MRD antigen expression detected by multi parameter flow cytometry
2.2 抗体组合结果
本研究通过检测MRD确定了抗体组合,发现白血病细胞跨阶段异常表达抗原的病例数较多,为18例;跨系异常表达抗原的病例数相对较少.见表1.

表1 有效抗体组合使用频率Tab.1 Frequency of effective antibody combination
2.3 患者不同生存期MRD检测结果
本研究的患者生存期以2 a为界限,将23例患者分为生存期大于2 a组和小于2 a组,将此两组的MRD平均值进行统计分析.见表2.
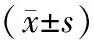
表2 患者不同生存期MRD检测结果Tab.2 MRD test results of patients in different survival periods
3 讨 论
MRD指标高是急性白血病治疗后复发的原因之一,MP-FCM为准确检测MRD提供了新的技术手段,MP-FCM就是应用不同荧光素标记的多种不同单克隆抗体对被检测的细胞表面抗原和/或细胞内抗原的表达情况同时进行检测分析.由于在同一个检测试管内,同时加入多种荧光抗体,很容易对细胞的来源、分化程度、抗原表达是否异常做出正确判断,在初筛白血病免疫分型时既可以做出型别诊断又可以个体化确定LAIPs.目前常用的流式细胞仪均采用多激光识别多种荧光素的技术手段,完全可以满足MP-FCM的技术要求.在现有流式细胞技术的基础上,应用MP-FCM技术建立急性髓系白血病MRD检测方法具有重要的临床应用价值.
MRD是指白血病患者经过治疗达到血液学完全缓解后体内残存的通过形态学等传统检测方法无法检测到的微量肿瘤细胞.检测MRD主要依据LAIPs,对初诊急性白血病患者进行白血病免疫分型是确定LAIPs检测MRD的关键.KERN W等[13]对诱导治疗和巩固治疗的AML进行了研究,确定LAIPs的方法对建立MRD具有重要的指导意义.本研究依据抗原不同步表达、跨系表达等特点基本建立了多参数流式细胞术检测AML MRD的方法,为指导临床治疗、判断预后在一定程度上提供了实验诊断依据.在方法学研究中,对抗体组合进行了优化确定.23例患者抗原不同步表达CD33CD13CD15CD34CD45的抗体组合应用最多,占56.52%(13/23);CD33CD13CD15CD117CD45的抗体组合占21.74%(5/23).抗原跨系表达的抗体中CD33CD13CD19CD34CD45和CD33CD13CD7CD34CD45比例相对较少,分别为17.39%(4/23)和4.35%(1/23).本研究发现,依据抗原跨系表达确定LAIPs比较容易,因此,随着研究深入,病例数量的积累,会获得更多这类患者的临床数据,研究将更具有临床指导意义.本研究对23例AML患者有效随访2 a,将全部病例分为生存期大于2 a组和生存期小于2 a组,分别统计分析MRD检测数据,发现生存期大于2 a的患者MRD数值明显低于生存期小于2 a的患者,差异具有统计学意义(P<0.01).
由于白血病细胞存在高度的克隆异质性,不同治疗方案对白血病细胞免疫表型存在一定程度的影响,治疗后不同时间节点采集的标本存在一定差异,以及不同的抗体组合、荧光素搭配、圈门策略等多种因素均对MRD检测结果存在影响,因此,MRD检测是一项复杂的技术,需在今后的研究中不断完善,获取更具有临床指导意义的数据,为临床治疗和判断预后提供更有价值的参考.
