羧甲基壳聚糖和纳米银对芍药切花观赏品质及生理特性的影响
2021-10-07陈国伟韩戴宇鞠志新
陈国伟,韩戴宇,杜 雪,鞠志新
(1.吉林农业大学园艺学院,吉林 长春130118;2.吉林农业科技学院农学院,吉林 吉林132101)
芍药(Paeonia lactifloraPall.)是芍药科芍药属的多年生草本植物,在我国栽培历史悠久,是中国的传统名花,其花型优美、花色艳丽、香气袭人,近年来已成为国内外市场上的高档切花,生产和销售份额逐年增加[1]。芍药花期短且集中在5—6月,自然瓶插寿命相对于百合、月季、康乃馨等切花来说也很短暂,通常只有7 d左右,这些因素都造成芍药切花供应的季节性,严重制约了芍药切花产业的发展[2-4]。
芍药切花采切后茎端受损,木质部导管堵塞影响水分循环,水分平衡被打破造成的水分胁迫加速切花的衰老[5],同时,芍药对乙烯等有害物质较为敏感,切花脱离母体后产生的乙烯也会影响切花寿命[6]。研究表明,膜质过氧化和内源激素失衡是导致切花衰老的重要生理原因,切花瓶插期间膜脂过氧化增加,造成细胞膜损伤甚至死亡,影响细胞膜透性[7-8],氧自由基代谢失调诱导内源激素失衡,引起吲哚乙酸(IAA)、赤霉素(GA)、细胞分裂素(CTK)等含量下降和脱落酸(ABA)、乙烯(Eth)含量上升,加速切花衰老与萎蔫[9-10]。因此,保鲜剂中添加杀菌防腐剂、乙烯抑制剂和抗氧化剂等物质,对于延长芍药切花瓶插寿命,增加其观赏价值尤为重要。
纳米银(Nano-silver,NS)是一种安全环保的广谱型纳米级无机抗菌材料,制备简单,被广泛应用于医疗、纺织、建材等领域[11-12],近些年在果蔬、鲜花保鲜领域的研究与应用也在逐渐增加。研究人员利用NS对麝香百合的基部进行预处理,结果发现,NS显著抑制了假单孢菌属、肠杆菌属等病原菌的生长[13]。程桂平等[14]以香石竹为试材,发现NS脉冲处理可以有效减缓花枝鲜重,提高超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等保护酶活性,延长瓶插寿命。与NS类似,羧甲基壳聚糖(Carboxymethyl chitosan,CMCS)也具有良好的抗菌性、水溶性、抗氧化性和成膜性,其作为壳聚糖羧基化的产物,来源广泛、价格低廉,也被广泛应用于医疗、食品、农业等领域[15]。研究表明,利用CMCS对芒果、草莓等喷涂或浸渍保鲜时,可在果实表面形成大约4 μm的透明保护膜,该膜可以控制果实内外二氧化碳、乙烯等气体交换,调节采后生理代谢,控制呼吸强度和蒸腾作用,延长果实的保鲜期[16-17]。采用含CMCS和蔗糖的保鲜液对菊科切花进行保鲜时,其瓶插寿命比对照有所延长[18-19]。不过,NS和CMCS作为两种新型抗菌材料,在芍药切花保鲜方面研究较少。本试验以芍药切花为材料,通过在瓶插基本保鲜液中添加不同浓度的NS和CMCS,探讨两种抗菌剂的保鲜效果及生理特性,以期为芍药切花高效环保型保鲜技术研发提供理论依据和技术支持。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
芍药切花品种“种生粉”采自吉林农业科技学院校内牡丹苗圃,花材均长势健壮,茎秆直立,提前一周去除侧蕾。采收标准参照成仿云等[20]的方法,采切时间均为上午8点整,长度均为40~50 cm,保留上部1~2片复叶,采切后立即放入水中,洗去叶片及花瓣上的分泌物。试验所有花材随机进行分组,瓶插前茎秆基部在水中再次切割,以清除茎端空气堵塞,切口为45°。控制实验室温度(21±2)℃,相对湿度50%~70%,室内自然散光。
羧甲基壳聚糖:购于上海源叶生物科技有限公司;纳米银:购于上海沪正纳米科技有限公司;蔗糖、柠檬酸、95%乙醇、考马斯亮蓝G-250等均为国产分析纯;所需试剂盒均购于南京建成生物工程研究所。
1.1.2 仪器与设备
723G型可见分光光度计,UV1000型紫外分光光度计,HH-2型数显电子恒温水浴锅,SQP型电子天平,DDS-307A型电导仪,GL-20G型台式高速冷冻离心机。
1.2 方法
1.2.1 材料处理
在预试验中,确定CMCS的最佳浓度为200 mg/L,NS的最佳浓度为20 mg/L,同时确定基本瓶插液为3%蔗糖+200 mg/L柠檬酸+25 mg/L水杨酸。试验设置对照组CK1、CK2分别为相同体积的蒸馏水和基本瓶插液,处理组S1、S2分别为基本瓶插液中添加最佳浓度的CMCS和NS。芍药切花单枝瓶插,每个处理15枝,8枝在每天固定时间进行形态观察,测定花径、水分平衡值以及瓶插寿命,其余则用于相对电导率、可溶性蛋白含量和保护酶活性等生理指标测定,每个处理重复3次。
1.2.2 测定项目与方法
1.2.2.1 瓶插品质
瓶插品质有瓶插寿命、最佳观赏期、花径变化率3个指标,自瓶插之日起,每天固定时间测定并拍照记录。瓶插寿命为瓶插0 d至花朵最外围50%以上开始出现萎蔫、掉落或褐变的天数;最佳观赏期为切花半开期至始衰期的天数。
花径变化率计算公式:花径变化率(%)=(瓶插期测得花径-瓶插初期测得花径)/瓶插初期测得花径×100
1.2.2.2 水分平衡值
水分平衡值采用称重法[21],其可反应切花新鲜程度,计算公式为:
失水量=(Hn+1+Pn+1)-(Hn-P n)
吸水量=Pn+1-Pn
水分平衡值=吸水量-失水量
式中:Hn为第n天花材质量(g),Pn为第n天溶液和瓶的质量之和(g)。
1.2.2.3 花瓣相对电导率、丙二醛(MDA)、游离脯氨酸(Pro)含量
相对电导率:采用电导率法测定;丙二醛含量:采用硫代巴比妥酸(TBA)法测定;游离脯氨酸含量:采用茚三酮显色反应测定。
1.2.2.4 花瓣可溶性蛋白质含量
采用考马斯亮蓝G-250法测定。
1.2.2.5 保护酶活性
超氧化物歧化酶活性:采用氮蓝四唑(NBT)光还原法测定;过氧化物酶(POD)活性:采用愈创木酚法测定;过氧化氢酶活性:采用紫外吸收法测定。以上指标均参照李合生[22]的方法并加以改进。
1.2.3 数据处理
数据采用Microsoft Word 2013进行统计处理,用SPSS 25.0进行差异性显著分析,显著水平α=0.05。
2 结果与分析
2.1 CMCS和NS处理对芍药切花瓶插品质的影响
从表1可以看出,S1和S2处理均延长了芍药切花的瓶插寿命和最佳观赏期,显著提升观赏品质(P<0.05)。其中S1处理较对照CK1相比,瓶插寿命和最佳观赏期分别延长了3.01 d和1.87 d,最大花径增大了2.17 cm;S2处理较CK1相比,瓶插寿命和最佳观赏期分别延长4.26 d和2.75 d,最大花径增大了3.19 cm,均达到显著差异(P<0.05)。如图1所示,两组对照处理芍药切花在瓶插3 d后进入盛花期,瓶插寿命为9 d,S1处理4 d进入盛花期,9 d后花瓣开始卷曲萎蔫。S2处理与S1处理表现较为一致,4 d进入盛花期,9 d后花瓣失水萎蔫,表明S1、S2处理均可有效延缓切花衰老。
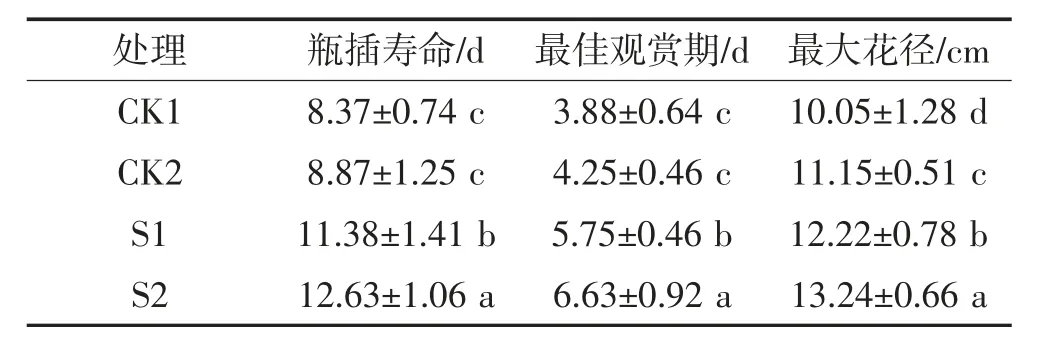
表1 CMCS和NS处理对芍药切花瓶插品质的影响Table1 Effects of CMCS and NS treatments on ornamental qualities of P.lactiflora cut flowers

图1 芍药切花瓶插期形态变化Fig.1 The morphological changes of P.lactiflora cut flowers during vase phase
芍药切花花茎变化率随开放进程而变化,瓶插前期花枝快速吸水,花蕾迅速膨大,花茎快速变大,花径变化率快速上升,后期切花衰老,花瓣萎蔫,花茎变小,花茎变化率下降。图2表明,盛花期前,各处理花径变化基本一致,S1、S2处理均在5 d达到峰值,此时S2处理的花径变化率显著高于其他3组处理(P<0.05),表明S2处理在促进芍药切花开放,延长寿命方面效果较好。
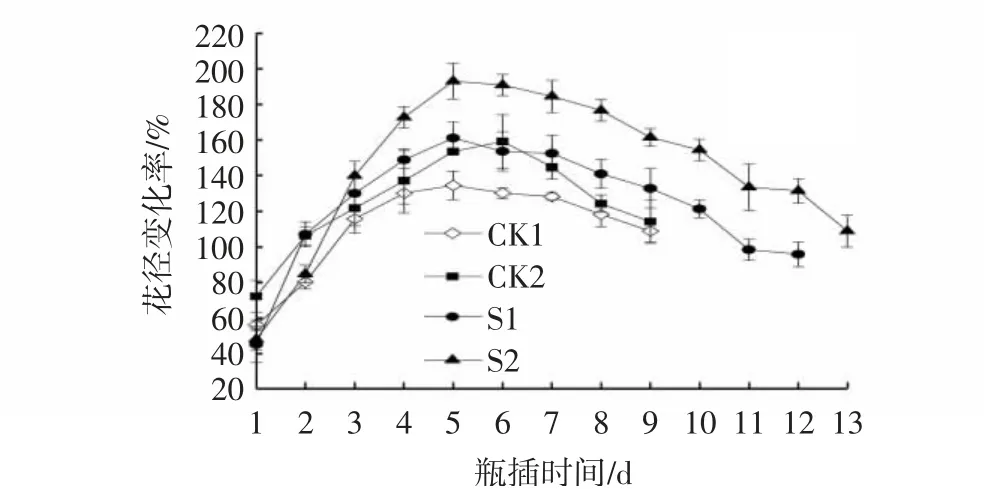
图2 CMCS和NS处理对芍药切花瓶插期间花径变化率的影响Fig.2 Effects of CMCS and NS treatments on flower diameters change rates of P.lactiflora cut flowers during vase phase
2.2 CMCS和NS处理对芍药切花水分平衡值的影响
如图3所示,瓶插期间各处理的水分平衡值均呈现先上升后下降的趋势。瓶插前期,S1、S2处理水分平衡值均高于CK1,瓶插第3天,各处理组的水分平衡值均到达峰值。随着切花进入盛开期,机体代谢旺盛,水分平衡值逐渐到达0。各处理组到达0的时间有所不同,CK1、S1处理和S2处理的时间分别为3.3 d、3.4 d和3.8 d,S1处理和S2处理延缓了水分平衡值到达0的时间,且S2处理出现的时间最晚,证明S2处理的保水能力更好,可以更有效地调控芍药切花体内水分代谢,维持水分平衡,延缓切花衰老进程。
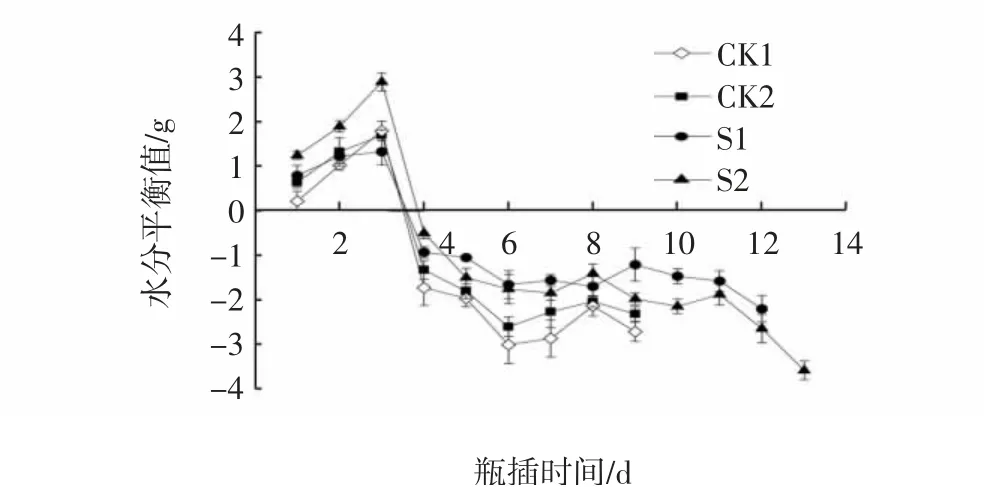
图3 CMCS和NS处理对芍药切花瓶插期间水分平衡值的影响Fig.3 Effects of CMCS and NS treatments on moisture balance values of P.lactiflora cut flowers during vase phase
2.3 CMCS和NS处理对芍药切花瓶插期间相对电导率、MDA和Pro含量的影响
如图4所示,芍药切花瓶插期间各项处理的相对电导率均呈现上升趋势,两组对照处理自瓶插3 d起相对电导率急速上升,而S1处理和S2处理均推迟了上升幅度,并且瓶插8~11 d时,S2处理的相对电导率变化幅度较小,表明该处理可以改变细胞膜透性,有效防止细胞内物质外渗,减缓细胞膜脂过氧化程度,保持细胞膜完整性,延长切花的瓶插寿命。
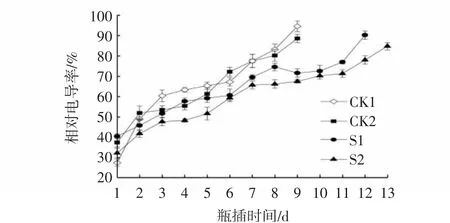
图4 CMCS和NS处理对芍药切花瓶插期间相对电导率的影响Fig.4 Effects of CMCS and NS treatments on relative conductivities of P.lactiflora cut flowers during vase phase
MDA是膜脂过氧化的最终产物,是衡量细胞膜损伤程度的重要指标。本试验结果表明(图5),MDA含量在整个切花保鲜阶段总体呈逐渐上升趋势,瓶插4 d进入盛花期后MDA含量迅速上升,其中CK1和CK2的MDA含量最高,S2处理的MDA含量显著低于S1处理(P<0.05),S1处理的MDA含量与CK1相比有所降低但无显著差异,说明S2处理可以减轻膜脂过氧化水平,保护细胞膜的完整性。
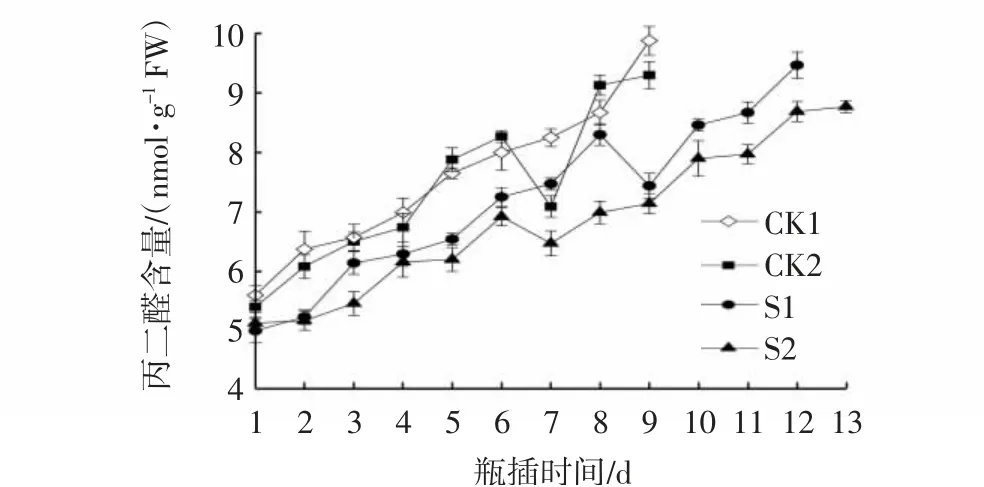
图5 CMCS和NS处理对芍药切花瓶插期间MDA含量的影响Fig.5 Effects of CMCS and NS treatments on MDA contents of P.lactiflora cut flowers during vase phase
从图6可以看出,在芍药切花瓶插期间,不同处理的Pro含量均呈上升趋势,且在瓶插寿命内,S1处理和S2处理的Pro含量显著低于对照CK1和CK2处理(P<0.05)。S1处理在瓶插8 d后Pro含量快速升高,S2处理在瓶插9 d时快速上升,总体来说,S1和S2均可以减少芍药切花瓶插期间Pro积累,维持细胞膜代谢,减缓水分亏缺。
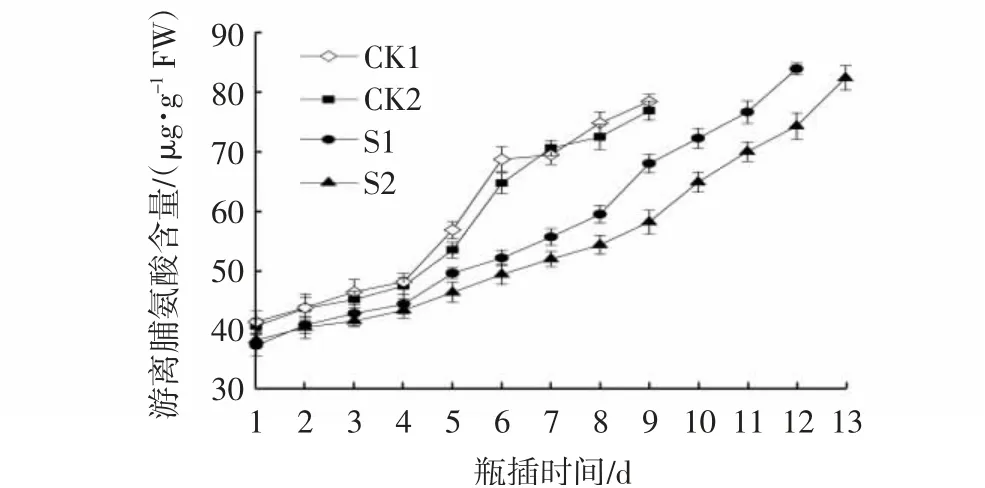
图6 CMCS和NS处理对芍药切花瓶插期间Pro含量的影响Fig.6 Effects of CMCS and NS treatments on Pro contents of P.lactiflora cut flowers during vase phase
2.4 CMCS和NS处理对芍药切花可溶性蛋白质含量的影响
可溶性蛋白质含量与切花衰老密切相关,其含量的高低直接影响切花的瓶插品质和寿命。由图7可以看出,各处理的可溶性蛋白质含量均呈现前期缓慢上升后期下降的趋势,两对照组的可溶性蛋白质含量峰值分别出现在瓶插3 d和5 d,S1处理和S2处理均在瓶插7 d达到峰值,此时,S1处理的可溶性蛋白质含量为8.45 μg/g,较对照组分别提高了37.2%和46.5%,S2处理的可溶性蛋白质含量为8.89 μg/g,较对照组分别提高40.3%和49.2%,且S2处理的效果明显优于其他处理组,说明NS处理可以提高芍药切花体内可溶性蛋白质的含量并维持稳定。
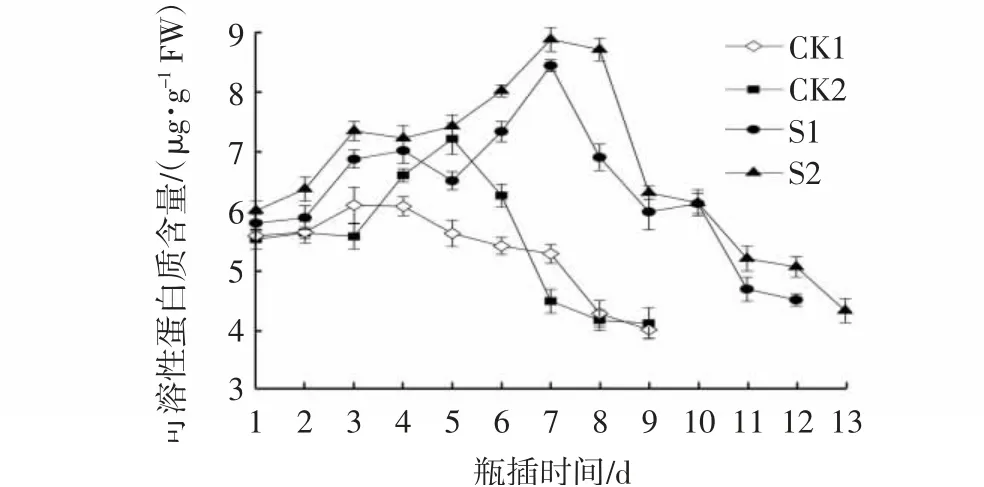
图7 CMCS和NS处理对芍药切花瓶插期间可溶性蛋白质含量的影响Fig.7 Effects of CMCS and NS treatments on soluble protein contents of P.lactiflora cut flowers during vase phase
2.5 CMCS和NS处理对芍药切花瓶插期间保护酶活性的影响
SOD是清除和抑制自由基的酶。由图8所示,瓶插期间SOD活性呈现先上升后下降的趋势。除S2处理外,其他3组处理的SOD活性均在瓶插4 d达到峰值,S2处理将峰值时间推迟到第5天,且S2处理的SOD活性显著高于其他处理(P<0.05)。并且在瓶插后期SOD活性也维持在很高的水平。S1处理的SOD活性虽有提高,但与对照组相比无显著差异。说明NS有较强的抗氧化防卫功能,有利于清除切花内部的O2,保鲜效果最好。
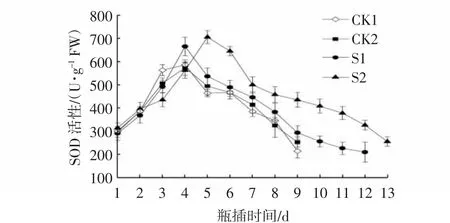
图8 CMCS和NS处理对芍药切花瓶插期间SOD活性的影响Fig.8 Effects of CMCS and NS treatments on SOD activities of P.lactiflora cut flowers during vase phase
POD作为一种保护酶,既可以分解植物体内的强氧化性物质,减少氧化损害,也可以生成ROS,因此与植物体的代谢密切相关[23]。图9显示,瓶插期间各处理组的POD活性呈现先上升后下降的趋势。除S1处理外,其他处理的POD含量均在第4天达到峰值,CK1和CK2处理的变化趋势相似,其中S1处理的峰值为0.52 U·g-1FW·min-1,比CK1提高15.9%,S2处理的峰值为0.54 U·g-1FW·min-1,比CK1提高了22.7%。瓶插中后期,各处理组的POD活性开始下降,S2处理的POD活性下降缓慢且始终高于其他处理,可见,NS可有效保持切花POD活性。
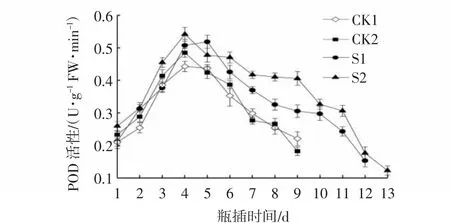
图9 CMCS和NS处理对芍药切花瓶插期间POD活性的影响Fig.9 Effects of CMCS and NS treatments on POD activities of P.lactiflora cut flowers during vase phase
CAT可以分解切花体内的过氧化氢。图10表明,S1和S2处理均不同程度的提高了CAT活性,与两组对照相比,S1和S2处理明显推迟了峰值出现的时间,且在整个瓶插过程中,S2处理的CAT活性始终高于其他处理,表明S2处理的效果最佳。
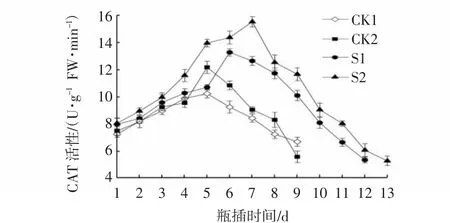
图10 CMCS和NS处理对芍药切花瓶插期间CAT活性的影响Fig.10 Effects of CMCS and NS treatments on CAT activities of P.lactiflora cut flowers during vase phase
3 讨论
(1)切花的瓶插寿命是影响其商品价值的重要因素,切花采收后脱离母体,水分、养分和能量供给不足,切花寿命大大缩短,加之瓶插期环境改变和茎端机械损伤等,使保鲜液中滋生大量以细菌为主的病原微生物,对茎秆造成堵塞,导致水分吸收受阻,进而产生水分平衡失调的现象,严重影响切花的品质和瓶插寿命[24-25]。本研究结果表明,瓶插液中加入NS和CMCS,对于芍药切花的瓶插寿命、最大花径有不同程度的改善,其中NS处理能显著增大花径,延长瓶插寿命,提升观赏品质,与前人在百合切花、牡丹切花的研究结果一致[13,26]。NS溶于水后,不仅可以杀死切花茎端细菌,而且会通过木质部进入花瓣,控制乙烯生物合成基因,减少乙烯合成量,进而延缓切花衰老。李欣等[27]和王艳巧等[28]对牡丹切花进行壳聚糖喷涂试验,发现其可以诱导切花产生一系列防御反应,抑制乙烯的合成,提高牡丹瓶插观赏品质,原因可能是喷涂处理在切花表面形成的高分子薄膜,具有更好的气体选择性,有利于调节切花的呼吸强度和蒸腾作用[16],关于CMCS的切花保鲜应用有待于进一步研究。
(2)切花采后的水分状况是影响切花寿命和观赏品质的重要指标,水分平衡值决定其新鲜程度。切花离体后,受环境等因素的影响导致吸水量和失水量失调,进而干扰植物的各项生理活动,加速衰老。本研究结果显示,在保鲜液中加入NS和CMCS,均可改善水分关系。瓶插初期,NS处理水分平衡值快速上升,表明NS能促进芍药切花早期水分吸收;瓶插中后期,S1处理水分平衡值较高,表明CMCS可以提升花枝的保水能力,延长切花的瓶插寿命和最佳观赏期,进一步提高观赏品质(图1)。
(3)植物受到胁迫后,细胞膜结构受损,细胞膜透性变大,细胞内电解质外渗[29],相对电导率变大。本研究结果显示,S2处理的平均相对电导率最低,原因可能是瓶插液中的NS溶解后,活性极强的Ag+大量溶出,与带有负电荷的病菌直接接触,消除电性进而杀菌抗菌[30]。MDA作为膜脂过氧化的最终产物,可直接反映植物受逆境迫害的程度[8-9]。已有研究表明[5],适宜浓度的NS可以降低切花波斯菊的MDA含量。本研究发现,S2处理的芍药切花花瓣中MDA含量显著低于其他处理(P<0.05),说明NS可以减少ROS及中间产物的积累,进而减缓对酶和膜的损伤程度,延缓切花衰老。另外,Pro作为植物体内一种重要的渗透调节物质,可维持膜、细胞亚结构的稳定,缓解逆境对植物的伤害[31]。本试验结果显示,随着瓶插期的延长,Pro呈现上升趋势,但S2、S1处理Pro含量显著低于对照处理(P<0.05),说明两种处理可有效维持体内膜的通透性,延缓切花衰老,NS的效果最佳,这与Liu等[32]研究结论类似。
(4)切花离体之后,其体内的淀粉、核酸等营养物质和结构物质会发生降解,可溶性蛋白质含量也会持续降低,因此其也是植物花朵衰败的重要指标之一[33]。本研究结果显示,S1、S2处理花瓣内可溶性蛋白质含量最高,表明两组处理均可以提升芍药切花花瓣内细胞的保水能力,更好地维持生命活性。这与程桂平等[14]的研究结果一致。其中S2处理在瓶插后期可溶性蛋白质含量均下降的情况下仍高于S1,表明NS处理保鲜效果较好。
(5)植物体内普遍存在着酶促氧自由基防御体系,抗氧化防御体系可使细胞免受活性氧的侵害,作为内源活性氧清除剂的关键酶SOD、POD和CAT可以在一定程度上清除植物体内过剩的ROS,维持氧活性代谢平衡,保护膜结构,延缓衰老[34]。本试验结果表明,S1、S2两组处理的芍药切花花瓣中的SOD和CAT活性在整个瓶插期间均明显高于CK,NS处理的SOD和CAT活性最高,并且推迟了CAT活性峰值出现的时间,说明NS有较强的清除自由基能力,提高了抗氧化防卫能力,从而延缓切花衰老。
4 结论
本研究结果表明,NS处理可以显著改善芍药切花的水分平衡值,降低相对电导率,抑制MDA、Pro等物质的积累,提高可溶性蛋白质含量和SOD、POD、CAT等保护酶活性。在瓶插保鲜液中添加适宜浓度的CMCS和NS均可提高芍药切花的保鲜效果,延长瓶插寿命,提升观赏品质,其中20 mg/L NS的保鲜效果最佳。
