1-MCP处理对杨梅果实贮藏期间品质及活性氧代谢的影响
2021-10-07黄钰萍刘青娥
黄钰萍,刘青娥
(丽水学院,浙江 丽水323000)
杨梅是我国南方著名的特色水果之一,主要分布于浙江、江苏、福建等省,因其果实色泽鲜艳,酸甜多汁,风味浓郁,营养丰富,深受消费者的青睐。然而,杨梅果实无外部保护层,加之成熟于温暖多雨的梅雨季节,呼吸作用旺盛,采摘后若不加以及时处理,2~3 d便腐烂变质,素有“一日采收、二日变色、三日变味”的说法[1],致使杨梅采后贮运困难,耗损严重。近年来,大量研究表明膜脂过氧化是果蔬衰老变质的主要内因,其表现为:采后活性氧清除系统功能下降,活性氧大量累积,致使膜脂过氧化加重,加剧了丙二醛(MDA)、超氧阴离子等的生成及细胞膜透性的升高,引起果蔬细胞膜的氧化损伤和组织衰老[2-3]。因此,研究杨梅保鲜技术,延缓果实衰老,对于杨梅规模化生产和市场流通具有重要意义。
1-甲基环丙烯(l-MCP)是一种乙烯受体抑制剂,能抑制乙烯与受体蛋白结合,从而延缓果实衰老,延长贮藏期,因其具有高效、无毒、稳定性好、作用浓度低等优点,已被广泛用于呼吸跃变型果实的保鲜[4-5]。已有研究表明,1-MCP处理能显著抑制杨梅采后呼吸强度、乙烯释放量和相对电导率,同时能有效降低杨梅总糖、总酸、水分含量等指标[6-8]。此外,1-MCP处理还可维持桃果实较高的活性氧(ROS)清除能力,并能降低MDA含量[9]。另有研究表明,1-MCP处理也能提高苹果[10]、香梨[11]、甜瓜[12]等果实的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等活性氧代谢相关酶的活性,从而降低果实活性氧水平,延缓果实衰老。但近年来关于1-MCP处理对杨梅果实活性氧代谢影响的研究报道较少。因此,本试验以“东魁”杨梅为试材,以1-MCP处理浓度和处理时间为考察因素,研究其对杨梅果实活性氧代谢、相关抗氧化酶活性及抗氧化活性物质含量的影响,以期为杨梅保鲜技术的改进提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“东魁”杨梅于2020年6月采自浙江省丽水市莲都区岩泉街道里佳源村,采后当天用加冰袋的泡沫箱运回实验室。挑选颗粒饱满、大小均匀、无损伤、无病虫害的果实作为试材。
SOD、CAT、POD、还原型谷胱甘肽(GSH)、VC、H2O2等试剂盒,均购于南京建成生物工程研究所;1-MCP(含有效成分0.14%粉剂),购于咸阳西秦生物科技有限公司。
1.1.2 仪器与设备
Synergy H1多通道酶标测定仪,美国伯腾仪器有限公司;UV-1780型紫外可见分光光度计,日本岛津公司;3K15型台式高速冷冻离心机,德国希格玛实验室离心机公司。
1.2 方法
1.2.1 样品处理
将挑选出的杨梅分为两大部分:一部分用于进行不同浓度1-MCP处理试验;另一部分用于进行1-MCP不同处理时间试验。
将挑选的一部分杨梅分成4组(每组2 kg),其中:一组作为空白对照,不做任何处理;另外3组分别用0.5、1.0、2.0 μL/L 1-MCP处理16 h。1-MCP处理参考钱骅等[13]方法,根据容积大小和相应浓度,称取1-MCP粉剂,溶于装有蒸馏水的小瓶中,摇匀后迅速放入聚乙烯薄膜袋包裹的塑料筐内释放出1-MCP气体,于0~4℃熏蒸相应时间,熏蒸结束后打开薄膜袋,将杨梅放入聚乙烯塑料袋中,于0~4℃下贮藏。每3 d取一次样进行相关指标的测定。
同时,将挑选出的另一部分杨梅分成4组,一组不做任何处理,另外3组用1.0 μL/L 1-MCP分别处理8、16、24 h。将处理后的杨梅放入聚乙烯塑料袋中,于0~4℃下贮藏。每3 d取一次样进行相关指标的测定。
1.2.2 测定项目与方法
1.2.2.1 腐烂率
以表面有霉菌、破裂、流水现象记为腐烂,计算公式为:
腐烂率(%)=腐烂果实数量/总果实数量×100
1.2.2.2 生理生化指标
称取2.5 g杨梅果肉组织用5 mL经预冷的提取缓冲液(0.05 mol/L Tris-HCl,0.35 mmol/L山梨醇,2 mmol/L EDTA和2.5 mmol/L DTT,pH 7.5)冰浴匀浆破碎后纱布过滤,取滤液于4℃,10 000 r/min离心20 min,取上清液用于各项生理生化指标的测定。
SOD、CAT、POD活性和GSH、H2O2、VC含量的测定均根据试剂盒说明书操作,其中SOD、CAT、POD活性以每毫克蛋白所含的活力单位数表示(U/mg Pro);GSH含量以每毫克蛋白所含的GSH含量计算(mg/mgPro);H2O2含量以每毫克蛋白所含的H2O2含量计算(mmol/mg Pro);VC含量以每100 g样品所含的VC含量计算(mg/100g)。每个处理重复3次,结果取平均值。
1.2.3 数据处理
采用DPS统计软件对试验数据进行方差分析及显著性检验(P<0.05为差异显著,P<0.01为差异极显著)[14]。采用GraphPad Prism 4.0软件对数据进行作图。
2 结果与分析
2.1 1-MCP处理对杨梅果实腐烂率的影响
由图1可知,随着贮藏时间的延长,各组杨梅果实的腐烂率均呈上升趋势,但经不同浓度1-MCP处理的果实腐烂率均极显著低于对照组(P<0.01)。贮藏15 d时,经0.5、1.0、2.0 μL/L 1-MCP处理的果实腐烂率分别比对照组低23.95、44.79和44.24个百分点。在贮藏期间,1.0 μL/L 1-MCP处理组与2.0 μL/L 1-MCP处理组间的果实腐烂率差异不显著。
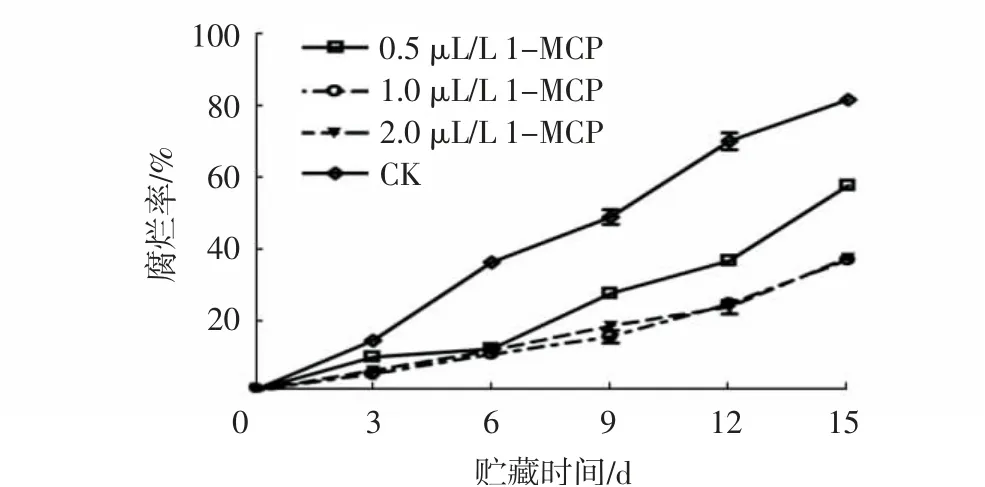
图1 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中腐烂率的影响Fig.1 Effects of different 1-MCP concentrations on decay rates of M.rubra fruits during storage at 0~4℃
由图2可知,1-MCP处理时间对杨梅果实腐烂率具有较大影响。随着贮藏时间的延长,经1-MCP处理的果实腐烂率上升趋势明显慢于对照组,且随着处理时间的延长,其腐烂率上升越缓慢,贮藏至15 d时,经1-MCP处理24 h的果实腐烂率为36.61%,较对照组下降了48.25个百分点。
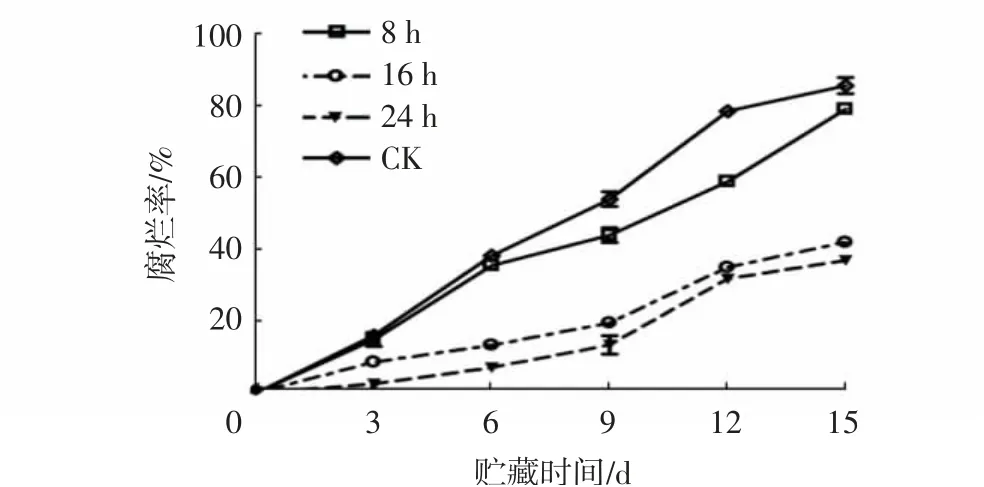
图2 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中腐烂率的影响Fig.2 Effects of different 1-MCP treatment time on decay rates of M.rubra fruits during storage at 0~4℃
上述结果表明,1-MCP处理可有效降低杨梅果实采后的腐烂率,使果实保持良好的品质和新鲜度,且最适浓度为1.0~2.0 μL/L,最适处理时间为24 h。
2.2 1-MCP处理对杨梅果实H2O2含量的影响
H2O2是植物体内一种主要的活性氧,其含量变化在一定程度上可反映活性氧的积累情况[15],而活性氧的产生正是造成果实衰老的重要诱因之一。由图3~4可知,与对照相比,1-MCP处理对杨梅果实H2O2含量影响极显著(P<0.01)。随着贮藏时间的延长,各处理组杨梅果实H2O2含量均呈上升趋势,但对照组的上升趋势最为显著,贮藏至3 d时,其H2O2含量就高达300 mmol/mg Pro以上。而各1-MCP处理组的H2O2含量上升缓慢,贮藏0~9 d时,各浓度1-MCP处理组的H2O2含量均低于320 mmol/mg Pro,且不同处理浓度间无显著差异;贮藏12~15 d,1.0 μL/L 1-MCP处理组的H2O2含量最低,较对照组下降了87.45~187.88 mmol/mg Pro。贮藏0~6 d时,经1 μL/L 1-MCP处理8、16、24 h的果实H2O2含量均较低,且各组间无显著性差异;贮藏9~15 d时,经1 μ/L 1-MCP处理24 h的果实H2O2含量增速最慢,贮藏15 d时,其H2O2含量较对照下降了128.58 mmol/mg Pro。
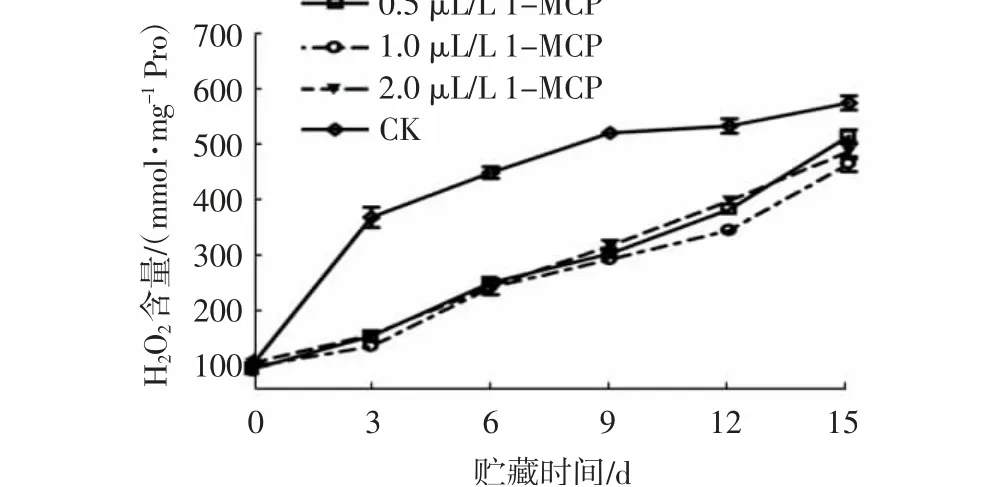
图3 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中H2O2含量的影响Fig.3 Effects of different 1-MCP concentrations on H2O2 contents of M.rubra fruits during storage at 0~4℃
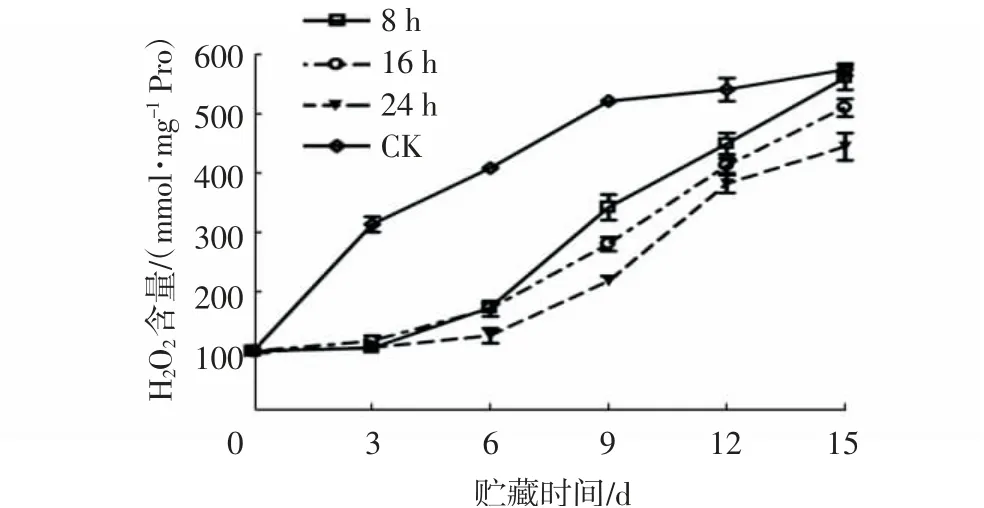
图4 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中H2O2含量的影响Fig.4 Effects of different 1-MCP treatment time on H2O2 contents of M.rubra fruits during storage at 0~4℃
上述结果说明,1-MCP处理能显著抑制杨梅果实采后H2O2累积,且以1.0 μL/L 1-MCP处理24 h的抑制效果最佳。
2.3 1-MCP处理对杨梅果实VC含量的影响
由图5~6可知,随着贮藏时间的延长,杨梅果实的VC含量逐渐降低(贮藏3 d时1.0 μL/L 1-MCP处理组除外)。在贮藏期内(贮藏15 d除外),1.0 μL/L和2 μL/L 1-MCP处理组的果实VC含量均极显著高于对照组(P<0.01),且1.0 μL/L 1-MCP处理组的VC含量下降程度最为缓慢,在贮藏12 d时,其VC含量比0.5 μL/L和2 μL/L 1-MCP处理组分别上升了10.57 mg/100 g和4.7 mg/100 g。在贮藏期内,经1.0 μL/L 1-MCP处理8 h的杨梅果实VC含量与对照之间差异不显著,而处理16 h和24 h杨梅果实则极显著高于对照组(P<0.01),且24 h处理组的VC含量下降最为缓慢,贮藏15d时,其VC含量较对照高7.71mg/100 g。
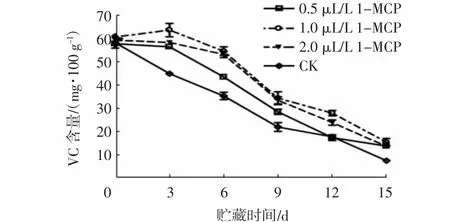
图5 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中VC含量的影响Fig.5 Effects of different 1-MCP concentrations on VC contents of M.rubra fruits during storage at 0~4℃
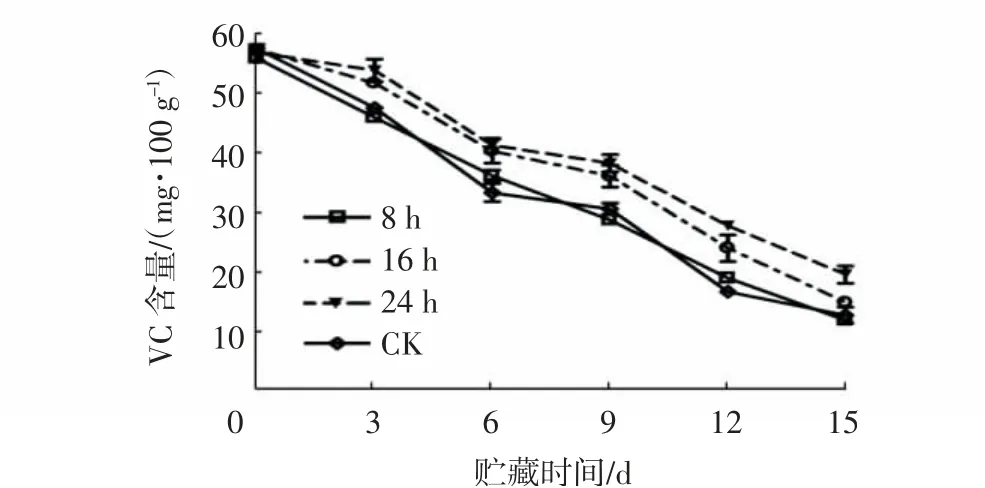
图6 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中VC含量的影响Fig.6 Effects of different 1-MCP treatment time on VC contents of M.rubra fruits during storage at 0~4℃
上述结果表明,1-MCP处理可以显著减缓杨梅果实贮藏期间VC的降解,且以1.0 μL/L 1-MCP处理24 h的缓解效果最佳。
2.4 1-MCP处理对杨梅果实SOD活性的影响
果实作为植物特有的发育器官,采摘后容易受到活性氧的伤害而导致衰老[16]。SOD是果实内非常重要的抗氧化酶,能有效清除果实内的活性氧,催化组织内的O2变为H2O2,延缓果实的衰老[17]。由图7~8可知,与对照相比,不同浓度1-MCP处理与不同1-MCP处理时间对杨梅果实SOD活性均具有极显著影响(P<0.01)。由图7可知:贮藏0~9 d时,随着贮藏时间的延长,各处理组的杨梅果实SOD活性均明显上升;贮藏9 d时达到最高峰,且从高到低依次为1.0 μL/L 1-MCP组(109.86 U/mg Pro)、2.0 μL/L 1-MCP组(102.39 U/mg Pro)、0.5 μL/L 1-MCP组(81.47 U/mg Pro)和CK组(75.88 U/mg Pro);贮藏9 d后,各组SOD活性逐渐下降;贮藏至15 d时,1.0 μL/L和2.0 μL/L 1-MCP处理组之间SOD活性差异不显著,但极显著高于0.5 μL/L 1-MCP处理组和对照组(P<0.01)。由图8 可知:贮藏0~9 d时,各组杨梅果实SOD活性均显著升高(P<0.05),贮藏9d时各组果实的SOD活性最高,且1-MCP处理时间越长,其活性越高,24 h处理组果实的SOD活性较对照组升高了48.03 U/mg Pro;之后随着贮藏时间的延长,各组果实SOD活性均下降,但对照组下降最为显著,贮藏15 d时,其SOD活性仅为37.82 U/mg Pro,而8、16、24 h 1-MCP(1.0 μL/L)处理的果实SOD活性分别为73.51、81.15、94.74 U/mg Pro。
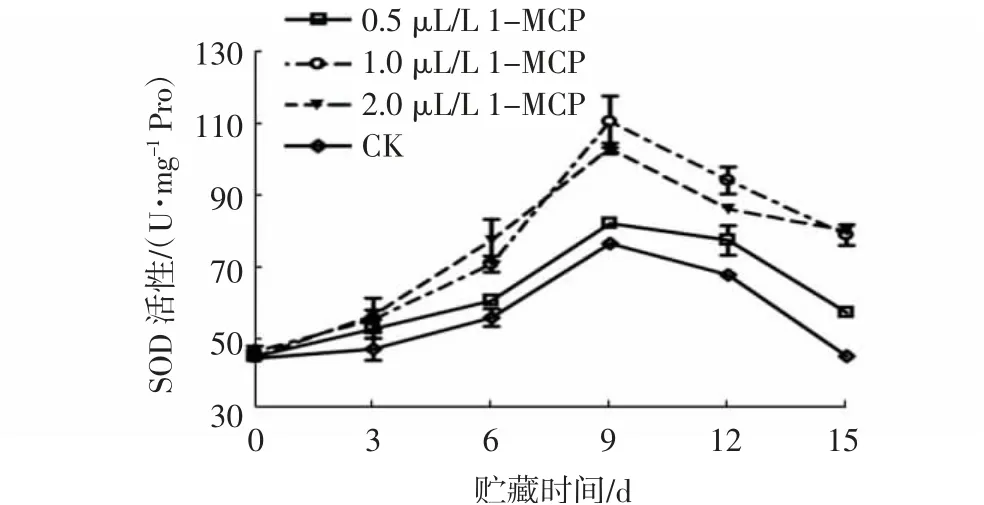
图7 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中SOD活性的影响Fig.7 Effects of different 1-MCP concentrations on SOD activities of M.rubra fruits during storage at 0~4℃
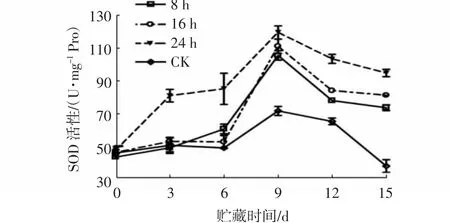
图8 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中SOD活性的影响Fig.8 Effects of different 1-MCP treatment time on SOD activities of M.rubra fruits during storage at 0~4℃
由以上分析可知,1-MCP处理能诱导杨梅果实SOD活性的升高,并在整个贮藏期间保持较高活性,且以1.0 μL/L 1-MCP处理24 h的诱导效果最佳。
2.5 1-MCP处理对杨梅果实CAT活性的影响
造成果实成熟衰老的重要原因之一是活性氧积累,因此当果实体内活性氧积累过多时,必须通过抗氧化酶系统来维持活性氧水平的动态平衡[18]。CAT是果实后熟衰老过程中重要的保护酶之一,它可有效清除体内多余的H2O2,维持活性氧代谢平衡[19]。由图9~10可知,贮藏期间,杨梅果实CAT活性整体虽呈下降趋势,但1-MCP各浓度处理组的CAT活性均显著高于对照组(P<0.05),1.0 μL/L和2.0 μL/L处理组的CAT活性差异不显著。由图10可知,贮藏0~6d,1.0 μL/L 1-MCP熏蒸16 h和24 h处理组的CAT活性极显著高于熏蒸8 h处理组和对照组(P<0.01),其活性高达23~24 U/mg Pro,且两者间差异不大。贮藏9~12 d,1.0 μL/L 1-MCP熏蒸24 h处理组的CAT活性极显著高于其他组(P<0.01)。
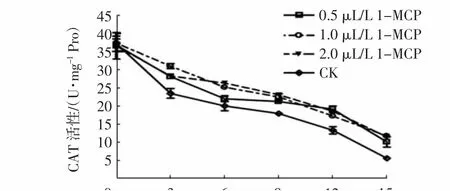
图9 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中CAT活性的影响Fig.9 Effects of different 1-MCP concentrations on CAT activities of M.rubra fruits during storage at 0~4℃
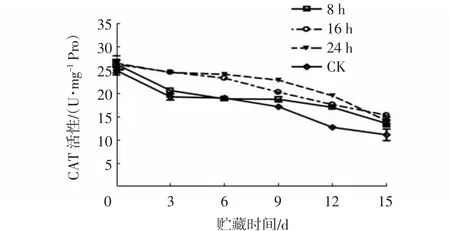
图10 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中CAT活性的影响Fig.10 Effects of different 1-MCP treatment time on CAT activities of M.rubra fruits during storage at 0~4℃
综合以上分析可知,1-MCP处理可显著延缓杨梅果实CAT活性的下降,从而可在一定时间内维持果实中氧自由基代谢的稳定,且最适浓度为1.0~2.0 μL/L,最适处理时间为24 h。
2.6 1-MCP处理对杨梅果实POD活性的影响
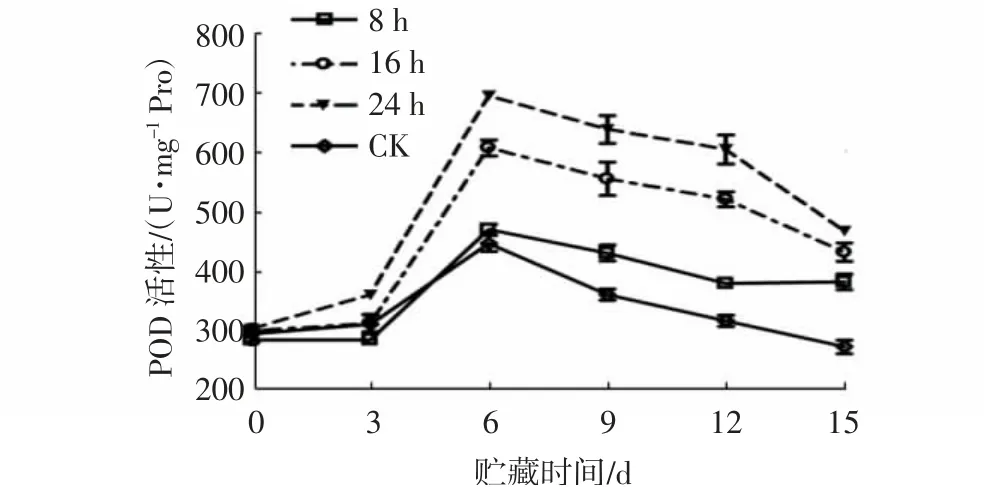
图12 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中POD活性的影响Fig.12 Effects of different 1-MCP treatment time on POD activities of M.rubra fruits during storage at 0~4℃
POD是果实中一种重要的氧化还原酶,具有清除过氧化物的作用,可将H2O2降解为H2O和O2,能够维持活性氧系统的代谢平衡[20]。由图11~12可知,在贮藏期间,杨梅果实POD活性总体呈先上升后下降趋势,且贮藏结束时不同浓度1-MCP处理组和相同浓度不同处理时间组的杨梅果实极显著高于对照组(P<0.01)。浓度为1.0和2.0 μL/L 1-MCP处理组果实的POD活性在贮藏6 d时出现峰值,高达681.23、639.43 U/mg Pro,两者间无显著差异;而0.5 μL/L 1-MCP组在贮藏9 d时出现峰值,且极显著低于1.0、2.0 μL/L 1-MCP处理组(P<0.01)。这可能是贮藏前期,果实处于呼吸高峰期,生命代谢旺盛,产生大量的自由基,而POD活性的上升可以有效维持果实活性氧代谢系统平衡[21]。贮藏9~15 d,1.0 μL/L 1-MCP处理组的POD活性极显著高于其他各浓度处理组(P<0.01)。贮藏0~6 d内,1.0 μL/L 1-MCP熏蒸8 h组与对照组之间无显著差异,而熏蒸24 h和16 h处理组相较熏蒸8 h组和对照组增速较快,贮藏6 d时,各组果实均出现POD活性峰值,由高到低分别为1-MCP熏蒸24 h组(697.43 U/mg Pro)、1-MCP熏蒸16 h组(609.67 U/mg Pro)、1-MCP熏蒸8 h组(471.8 U/mg Pro)和对照组(448.43 U/mg Pro)。整个贮藏期间,1.0 μL/L 1-MCP熏蒸24 h组杨梅果实的POD活性始终处于较高水平。
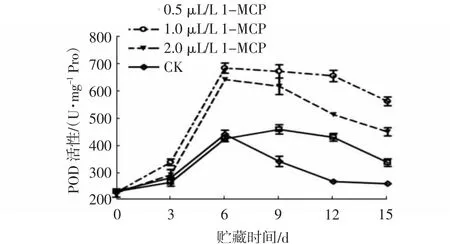
图11 不同浓度1-MCP处理对杨梅果实0~4℃贮藏过程中POD活性的影响Fig.11 ffects of different 1-MCP concentrations on POD activities of M.rubra fruits during storage at 0~4℃
上述结果表明,1-MCP处理能诱导杨梅果实POD活性的升高,从而较好地清除果实内的活性氧,维持活性氧代谢平衡,以延缓果实衰老,且以1.0 μL/L 1-MCP处理24 h的效果最好。
2.7 1-MCP处理对杨梅果实GSH含量的影响
GSH是植物体中的一种抗氧化剂,在GSH过氧化物酶(GSH-Px)和GSH转移酶(GST)的作用下能将H2O2还原成H2O,从而减少自由基的产生;同时GSH可通过其侧链的巯基直接与自由基结合并将其清除,以发挥其抗氧化作用[22]。由图13可知,在贮藏期内,各处理组杨梅果实GSH含量均呈下降趋势,但1 μL/L和2 μL/L 1-MCP处理组的GSH含量均显著高于对照组和0.5 μL/L 1-MCP处理组,且在贮藏的6~15 d,1 μL/L 1-MCP处理组果实的GSH含量最高。由图14可知,在整个贮藏过程中,经1 μL/L 1-MCP熏蒸24 h的杨梅果实GSH含量均显著高于其他3组(P<0.05)。
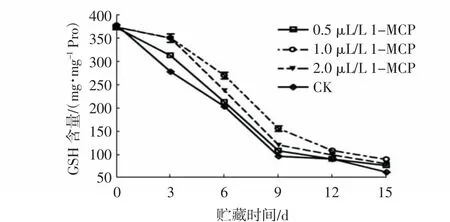
图13 不同1-MCP浓度对杨梅果实0~4℃贮藏过程中GSH含量的影响Fig.13 Effects of different 1-MCP concentrations on GSH contents of M.rubra fruits during storage at 0~4℃

图14 不同1-MCP处理时间对杨梅果实0~4℃贮藏过程中GSH含量的影响Fig.14 Effects of different 1-MCP treatment time on GSH contents of M.rubra fruits during storage at 0~4℃
上述结果说明,1-MCP处理能延缓杨梅果实GSH含量的下降,维持活性氧的代谢平衡,以延缓果实的衰老,且以1 μL/L 1-MCP熏蒸24 h的效果最佳。
3 讨论与结论
杨梅是一种典型的呼吸跃变型果实[23],采后果实呼吸作用强,果面微生物活性高,极易发生霉烂变味,及时预冷是保鲜的关键[8]。因此,本试验将杨梅采摘后马上用加冰袋的泡沫箱运回实验室,且在0~4℃下进行处理与贮藏。1-MCP是一种无毒、无污染的新型乙烯竞争抑制剂,目前已广泛应用于果蔬的贮藏保鲜[24]。腐烂率是衡量贮藏期果实品质和保鲜效果最直观的指标。VC不仅是植物体中普遍存在的非酶系统抗氧化剂,也是影响果实风味和品质的重要因素之一[25]。两者常作为保鲜研究的重要检测指标。王威等[8]研究发现,预冷后的杨梅经1-MCP处理,其货架期可达5 d,腐烂率低于10%。杜林笑等[11]研究表明,1.0 μL/L 1-MCP处理可保持库尔勒香梨果实的VC含量。本试验也发现,1-MCP处理可有效降低杨梅果实的腐烂率,同时延缓VC的降解。这说明1-MCP处理可较好地保持果蔬的品质和新鲜度。此外,有研究表明,1-MCP处理延缓果蔬衰老的效果与其处理温度、处理浓度和处理时间有关[7]。但近年来关于1-MCP对杨梅保鲜的研究主要集中在处理浓度的筛选上,而关于处理时间的研究较少,而且一般认为,1-MCP的处理时间至少需要12 h[26]。茅林春等[7]在研究1-MCP对杨梅果实采后生理和品质的影响时对杨梅处理了15 h。而本试验研究发现,随着1-MCP处理时间的延长,杨梅果实腐烂率的上升和VC含量下降程度越小,经1 μL/L 1-MCP处理24 h的效果最佳。由此可知,1-MCP处理时间是影响果蔬保鲜程度的重要因素之一。
活性氧(ROS)是植物体内主要的自由基,主要包括O2·、H2O2等,其产生速率和清除与果实的衰老腐烂密切相关[27]。采后果实在贮藏期间活性氧的异常累积,易破坏细胞膜结构,导致细胞内部平衡失调和功能丧失,从而造成果实的衰老腐烂。而SOD、POD、CAT等保护酶系统和GSH、VC等非酶保护系统的存在可有效清除活性氧自由基,保持体内活性氧平衡,从而延缓衰老,因此其活性和含量的高低可作为判定果实成熟衰老的重要标志[17,28]。本试验研究表明,随着贮藏时间的延长,杨梅果实的H2O2含量呈上升趋势,但对照组的上升趋势最为显著,而各1-MCP处理组的H2O2含量上升缓慢。同时研究发现,在贮藏期间1-MCP处理组杨梅果实的SOD、CAT、POD活性以及GSH、VC含量均高于对照组。杜林笑等[11]研究同样表明,经1-MCP处理的库尔勒香梨果实的CAT和SOD活性均高于对照组。穆茜等[29]发现,1-MCP能抑制海棠果实POD活性的下降,在货架15 d时1-MCP处理组的POD活性达最大值,之后呈下降趋势,而对照组基本检测不到POD活性。这说明,1-MCP处理能通过诱导果实SOD和POD活性的升高,减缓CAT活性和GSH、VC含量的下降,以清除活性氧自由基,有效地保持细胞膜结构,延缓果实的衰老。此外,有研究表明酚类物质和类黄酮也是清除活性氧自由基的关键成分。Zhang等[30]研究发现,1-MCP可显著提高鳄梨果实中可溶性总酚、类黄酮和总抗氧化能力的积累水平,且当1-MCP浓度升高时效果更加显著。但1-MCP处理是否可提高杨梅果实酚类物质和类黄酮含量还有待进一步研究。
综上所述,1-MCP处理可通过提高杨梅果实的SOD、CAT、POD等抗氧化酶活性以及GSH和VC含量以有效地清除活性氧自由基,从而延缓杨梅果实采后衰老,延长其保鲜时间,且1-MCP最适处理浓度为1.0 μL/L,处理时间为24 h。
